Points of View PRO(Patient Reported Outcome)の最新動向-臨床試験登録データベースを用いた調査・分析-
医薬産業政策研究所 主任研究員 吉田晃子
1.はじめに
PRO(Patient Reported Outcome、患者報告アウトカム)とは、臨床アウトカムの一つであり、包括的尺度としてSF-36、EQ-5D、疾患・症状特異的尺度として、疼痛に用いられるVAS、関節炎・腰痛に用いられるWOMAC等がその代表例である。症状やQOLに関して、患者が自分自身で判定し、その結果に医師を始め他の者が一切介在しないという評価方法である。患者自身の症状や印象の変化が重要な疾患が対象であり、すべての疾患が該当するものではない。「痛み」や「痒み」、「眠気」のような患者の主観以外に信頼性の高い適切な評価方法がないものが想起しやすいが、そうした疾患に対し、わが国では、かつては、PROを利用せざるを得ないとする消極的な活用がなされていた。しかし、近年は、医師による評価が可能なものであっても、患者が直接評価することで同等あるいはそれ以上に意義のある評価が得られる場合に、PROを積極的に活用するようになりつつある1)。
また、本政策研ニュースの「PPI(Patient and Public Involvement)の最新動向」に記載するように、2021年9月には、PMDAより「独立行政法人医薬品医療機器総合機構 患者参画ガイダンス」(以下、患者参画ガイダンス)2)が発行されている。そして、その中で、PROは「審査において患者のBenefitを評価するための有用なツール」であり、「活用することは、臨床的意義が患者に支持される医薬品等の効率的な開発に資する」との記載がなされていることから、今後、PROを評価項目の一部とした治験の結果を含む承認申請が日本でも増加することが想定される。
そうした背景から、PROに近年増々注目度が高まっているのではないかと推測される。本稿では、臨床試験における医薬品の評価において、PRO関連情報がどの程度用いられるようになっているのかについて、最新の動向を把握するため、臨床試験登録データベース(Clinical Trials.gov)を用いた調査・分析を行うことにした。3年前の10年間データ3)と比較しながら、分析し報告する。
2.手法
臨床試験登録データベースの中でもグローバルで代表的なClinicalTrials.govを用いて、PROに関連した臨床試験がどの程度実施・計画されているかを調査・分析した4)。データベースにおける検索条件は以下のとおり。
- a )2012年1月1日から2021年12月31日までに新規に登録された試験計画書の中で、Interventional Study(介入試験)で、かつ介入の対象としてDrugあるいはBiologicalと記載があるもの(Device, Behavior, Radiation等は除外)
- b )PROに関連し得る検索用語として、Patient Reported, Patient self-reported, Patient Handling Questionnaire, Patient Satisfactionとし、これらのうちいずれかの用語が、評価項目(Outcome Measures)に記載されているもの
-
注 )本検索条件は、あらゆるPRO評価ツール(VASやEQ-5D等)を具体的に規定して検索できていないため、網羅性には限界がある。また、評価手法の解説として直接評価、患者満足といった表現を用いただけの試験(本来のPROには該当しない)も、PRO関連臨床試験として抽出されていることに留意する必要がある。
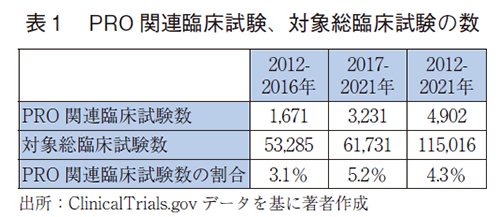
3.PRO関連臨床試験数の推移
検索条件a)にて抽出された臨床試験(対象期間、介入方法が一致する全ての臨床試験:以下、対象総臨床試験と略す)は、トータルで115,016試験(109,294試験、3年前の10年間データをカッコ内に記載する)あった。その中で、検索条件b)でヒットした試験(以下、PRO関連臨床試験)は、4,902試験(3,265試験)であった(表1)。なお、期間を5年間で区切り、前後で比較すると、PRO関連臨床試験数はおよそ2倍(2倍)に増え、対象総臨床試験数におけるPRO関連臨床試験数の割合は3年前より一層増加していた。
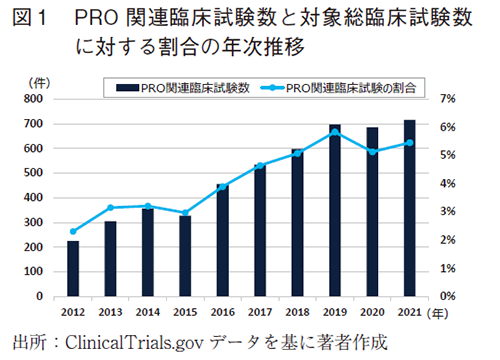
また、年次推移を見ると、ほぼ右肩上がりに増加する傾向がみられた3年前とは異なり、2019年から2021年までは、PRO関連臨床試験数はほぼ横ばいであり、PRO関連臨床試験数の割合はやや低下したようにも見えるデータであった。(図1)一概には言えないが、この期間は、COVID-19の流行期と重なっていることから、新たな臨床試験の開始や進行中の臨床試験を、休止・中断する等があり、総臨床試験数やPRO関連臨床試験数に影響を与えた可能性がある。
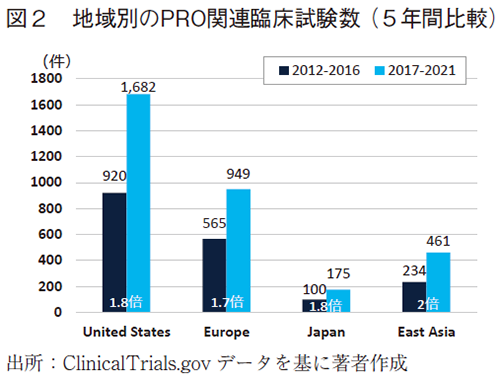
4.地域別
次に地域別の変化を図2に示した。前後5年間で比較したところ、どの地域でもPRO関連臨床試験数は増加しており、日本の増加比は1.8倍(1.5倍)となり、欧州や米国並みとなっている。
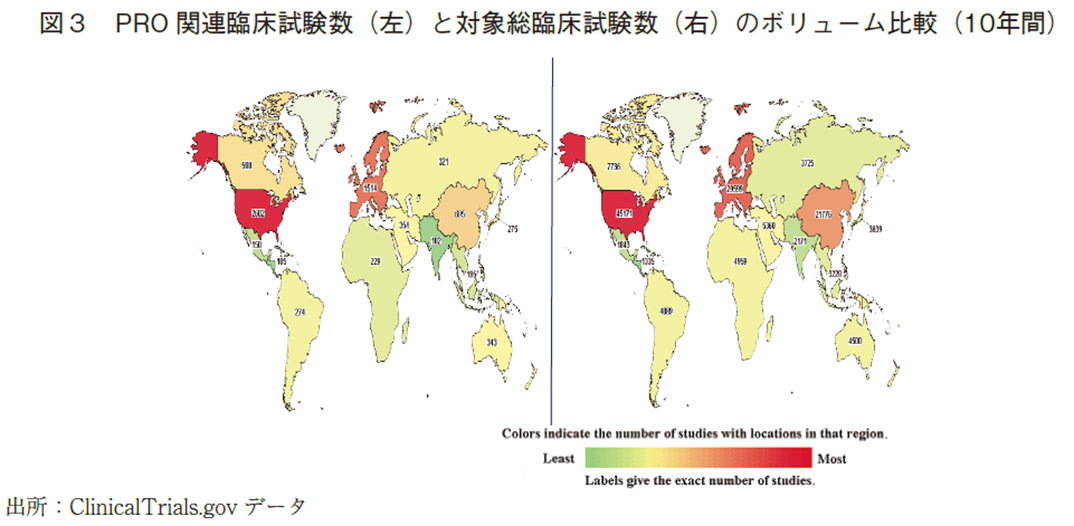
図3に、PRO関連臨床試験(左)と対象総臨床試験(右)のボリューム比較(10年間)を掲載するが、対象総臨床試験数の多い地域でPRO関連臨床試験数が多くなっている。日本のPRO関連臨床試験数は、他の地域と比べるといまだ少ないが、対象総臨床試験数に起因するものと推測される。
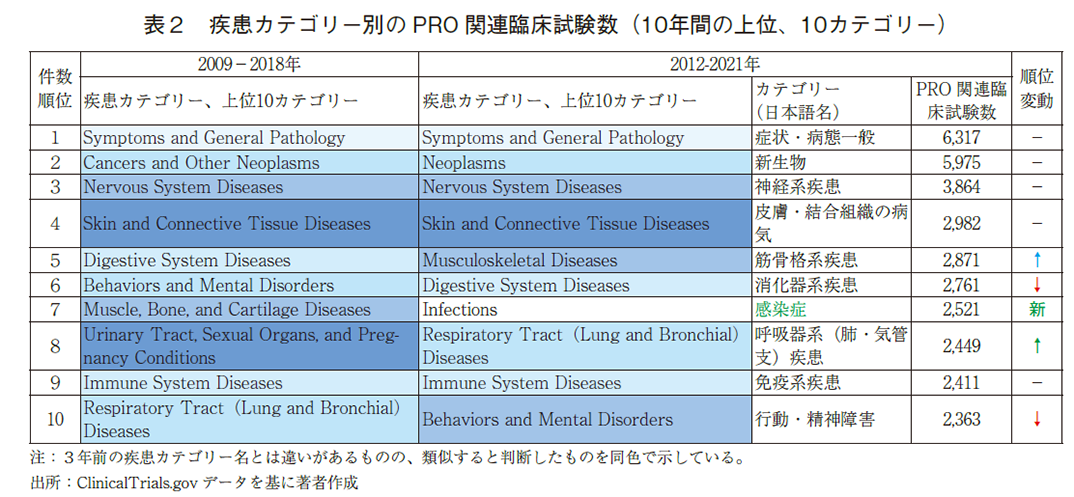
5.疾患カテゴリー別
続いて、疾患カテゴリー別のPRO関連臨床試験数について、直近10年間でPRO関連臨床試験数が多かった上位10カテゴリーを3年前の10年間データと比較し、順位の変動と共に示した。(表2)筋骨格系疾患および呼吸器疾患での伸びが見られ、新たに感染症が上位10カテゴリーにランクインしている。呼吸器疾患や感染症におけるPRO関連臨床試験数の伸びについても、COVID-19の流行に関連している可能性がある。
-
注 )この疾患カテゴリーはClinicalTrials.govの独自カテゴリーによるもの(本調査結果は22カテゴリーに該当)。1つの試験が複数の疾患カテゴリーに属する場合などは、重複して試験数をカウントしている点に、また、3年前のカテゴリー名と必ずしも同じでない点に留意する必要がある。
6.試験Phase別
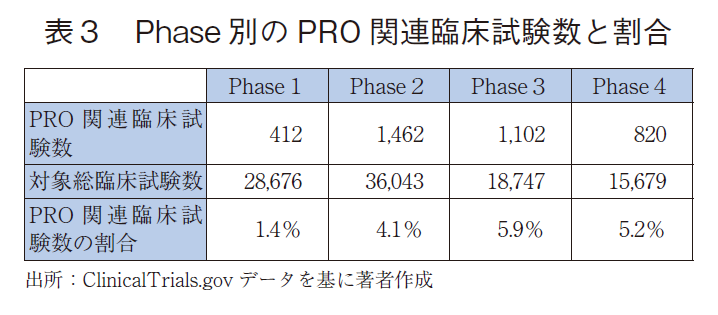
最後に、試験Phase別のPRO関連臨床試験数について以下に示した。まず、各Phaseの対象総臨床試験数に対するPRO関連臨床試験数の割合はPhase3で最も高く、次いでphase4が高かった(表3)。これは3年前と同じ傾向である。
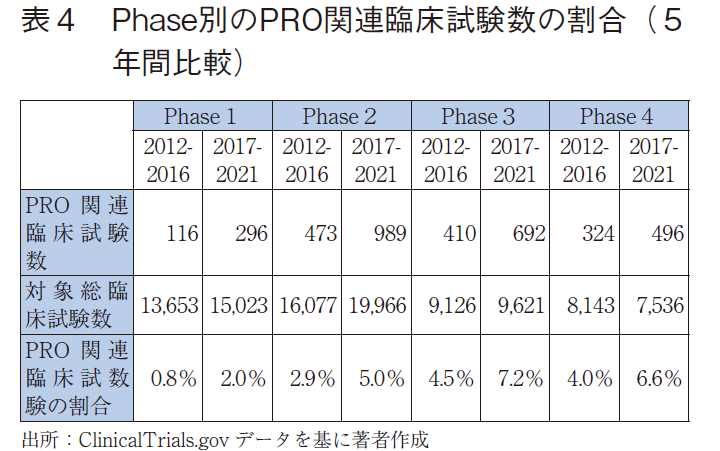
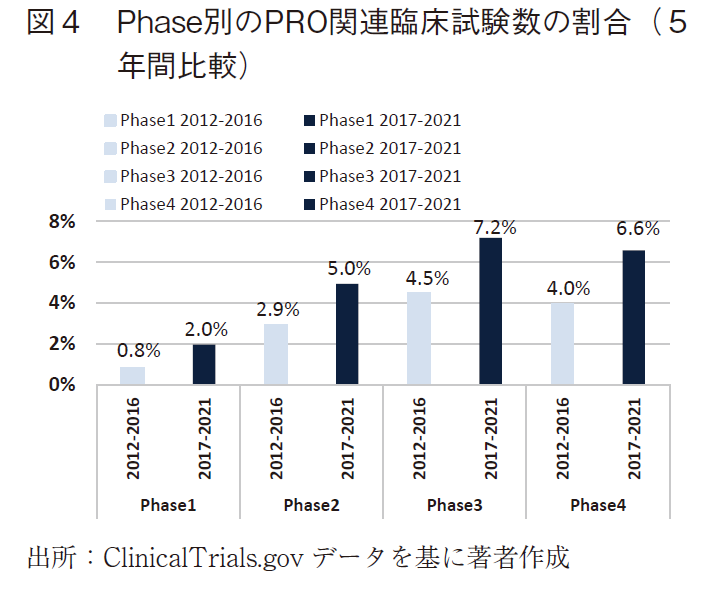
次に、PRO関連臨床試験数の割合を5年間比較でみると、全てのphaseにおいて直近5年間での割合が増加していた(表4、図4)。また、phase3の直近5年間ではPRO関連臨床試験数の割合が7%を超えていた。
7.まとめ
臨床試験における医薬品の評価において、PRO関連情報がどの程度用いられるようになっているのか、直近10年間の調査・分析を行った。2020年初め頃より世界各国でCOVID-19が流行していることから、PRO関連臨床試験数や対象総臨床試験数、その割合、疾患カテゴリー等にも影響を与えている可能性はある。しかしながら、直近5年間で見ても、米国、欧州、日本、東アジアにおいて、今回の抽出では、PRO関連臨床試験数が増えていた。かつてはPROという言葉自体が、あまり使われていなかったことも踏まえると、PRO関連臨床試験数の増加の背景には、PRO関連の用語がより頻繁に用いられるようになったこともあると推察されるが、PROへの注目が高まっているとは言えるだろう。
8.おわりに
今後は、PROを評価項目の一部とした治験の結果を含む承認申請が日本でも増加することが想定される。また、患者参画ガイダンスには、「国内外での使用実績等の観点に留意しつつ、その取扱いについて検討する」旨の記載がなされていることから、そうした観点でも、今後の国内外でのPRO動向に引き続き注目すべきである。
リサーチペーパー・シリーズNo.64(2015年3月)において、小林は、欧米に比べてPROという概念に対する理解が大きく遅れていることや、PROをバリデートするためのガイドライン、ガイダンスがないことをわが国の本質的な課題としていた。しかし、その後、PROを用いた臨床研究の各段階(尺度の選定、研究計画、統計解析、結果報告等)において、他のアウトカムを用いた臨床研究と同様に、標準化への取り組みがなされている5)。わが国においても、規制当局によるPROガイダンスが作られる日も近いと推測され、環境・体制の整備と実績も相まって、PROという概念に対する理解がより深まっていくことを期待する。
-
1)医薬産業政策研究所、「Patient-Centered の促進に伴うPatient Reported Outcome の新薬開発への適用に関する研究」、リサーチペーパー・シリーズNo.64(2015年3月)
-
2)PMDA患者参画検討ワーキンググループ、「独立行政法人医薬品医療機器総合機構 患者参画ガイダンス」(参照日2021/1/21)
-
3)医薬産業政策研究所、「Patient Reported Outcome(PRO)の最新動向—臨床試験登録データベースを用いた調査・分析—」政策研ニュースNo.57(2019年7月)、2009年1月1日から2018年12月31日までの10年間データを2019年5月21日時点で検索したもの。
-
4)2022年1月12日時点におけるClinicalTrials.govのウェブサイト(参考:https://clinicaltrials.gov/)に登録されているデータを基に調査を実施した。
-
5)山口拓洋ら、「Patient Reported Outcome(PRO)とPRO-CTCAE について」、ファルマシアVol.54 No.3 2018(参照日2022/1/29)

