Points of View DTx の保険償還におけるアウトカム指標の考察-欧米の最新動向を踏まえた多様な価値評価に向けて-
医薬産業政策研究所 主任研究員 辻井惇也
1.はじめに
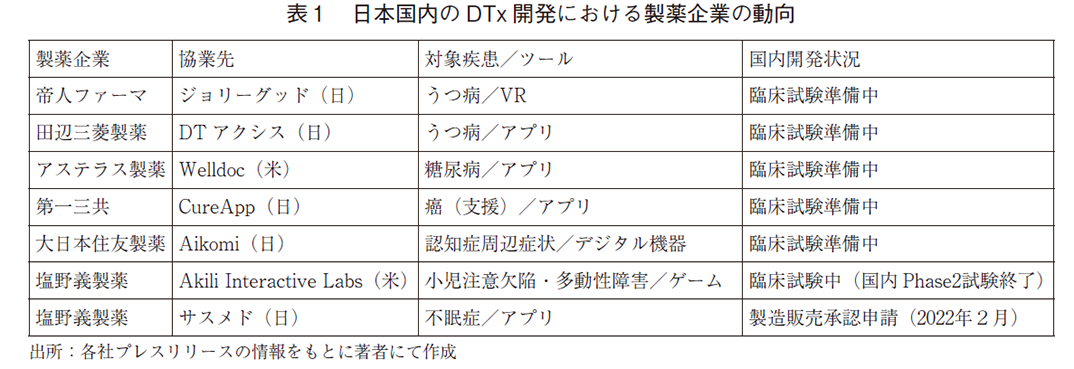
糖尿病患者の血糖値管理アプリであるWelldoc社「BlueStar」が、2010年にアメリカ食品医薬品局(FDA)の薬事承認を取得して以降、世界各国で複数のデジタルセラピューティクス(以下、DTx)が登場している。例えば米国では、既に10を超えるDTxがFDAから認可/承認を受けており1)、ドイツでは審査継続の仮登録も含め、28の製品/適応での臨床利用が認められている2)。一方、日本では、2020年にCureApp社のニコチン依存症治療アプリが本邦初のDTxとして薬事承認を取得し、保険収載された3)。さらに2021年5月には、同じくCureApp社が高血圧治療アプリの薬事申請も行っており4)、日本においてもDTxの開発が活発化しつつある。加えて、製薬企業の参入も増えており、様々な製品の開発が進行している(表1)。
デジタルテクノロジーの進展に伴い、続々とDTxが登場しつつある中、わが国においてはそれらの医療展開を支える諸制度の整備・構築が急務となっている。特に、DTx開発の促進や開発企業の事業予見性等に大きく関わる保険償還制度の整備は喫緊の課題である。2021年度に入り、中央社会保険医療協議会(以下、中医協)において、令和4年度保険医療材料制度改革に向けた議論がなされ、保険医療材料制度に「プログラム医療機器の評価について」の記載が組み込まれた。保険診療上の評価軸については、プログラム医療機器の特性を反映した有効性・安全性以外の価値も考慮していくことが明示されている5)。
そこで、本稿では、わが国におけるDTxの保険償還の評価軸を考察するため、DTx認可/承認品目数の多い米国、ドイツに加え、医薬品等に対する多様な価値評価が進む英国に焦点を当て、各国のDTxの保険償還の現状とアウトカム指標を調査した。
2.本調査に関する整理
米国Digital Medicine Societyの定義によると、健康関連のデジタルソリューションは広く「デジタルヘルス」と呼ばれ、利用目的やエビデンスレベルに応じて、さらに「デジタルメディスン」、「DTx」に細分される6)。このうち、医学的障害や疾病の予防、管理、治療のために治療的介入を行うDTxのエビデンスレベルが最も高く、臨床的効果や実臨床で収集されるデータが必要とされている。
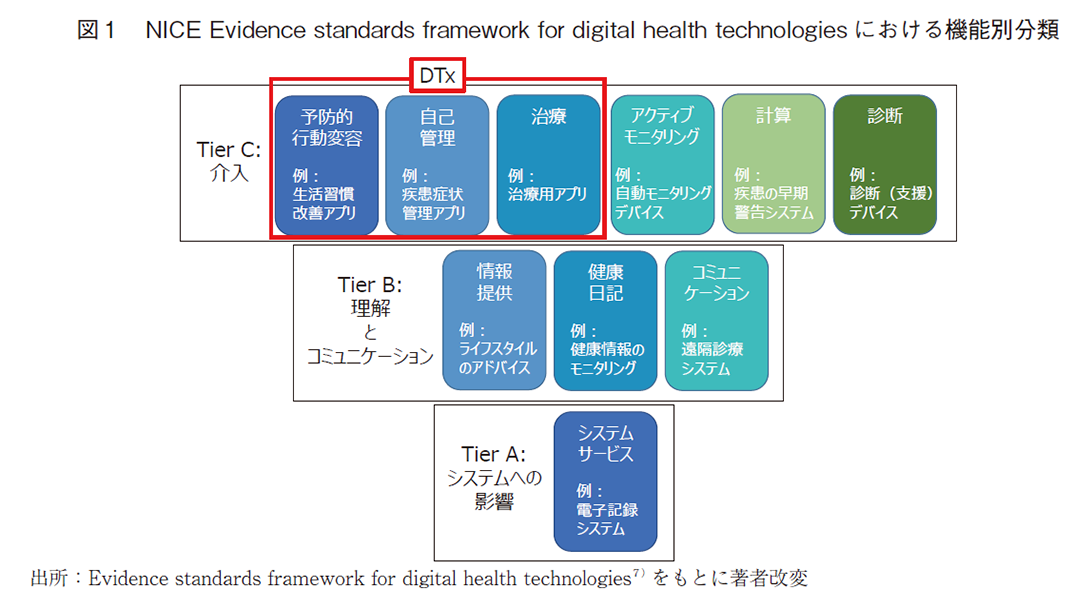
また、英国の国立医療技術評価機構(NICE)が発出した「Evidence standards framework for digital health technologies」では、利用目的や人体への影響度(リスククラス)に応じてデジタルヘルスを区分し、それぞれに対して求められるエビデンスのフレームワークを示している7)。これらはリスククラスの低いものからTier A、B、Cの3段階に分かれており、DTxはTier Cに該当する(図1)。Tier AからCで求められるエビデンスは累積的であり、Tier Cの要件を満たすことは、必然的にTier A、Bの要件も満たすこととなる。
以上から、DTxのエビデンスを構築するアウトカム指標の考察は、DTxのみならず、今後、デジタルメディスンやデジタルヘルスの評価軸を検討する際の参考にもなると考える。なお、本調査では保険償還に関係する指標を広範に収集したため、ソフトウェア品質のような製品品質も調査結果に含まれることに留意いただきたい。
3.日本におけるDTxの保険償還の現状
各国の保険償還の調査結果に移る前に、日本のDTxに対する保険償還の現状を概観したい。
わが国においてDTxは、「プログラム医療機器(Software as a Medical Device:SaMD)」の構成要素の一つとして整理されており、プログラム医療機器全体で、保険償還や実用化に向けた制度の議論が進められている。本邦初のDTxであるCureApp社のニコチン依存症治療アプリは、呼気一酸化炭素濃度測定用のCOチェッカーを含め、「新規技術料」として評価された8)。ただし、本アプリの保険適用に関する中医協(2020年11月11日)の議論において、「プログラム医療機器の保険適用の考え方や仕組みを早期に整理する必要がある」ことが言及され9)、デジタル技術の進展と当時の制度にギャップが存在したことがうかがえる。
このような背景を踏まえ、規制改革実施計画(令和3年6月閣議決定)において、重点的に取り組む規制改革の実施事項として、「プログラム医療機器を活用して患者に対して提供される医療の質の確保・向上に係る評価の考え方を明確化する」ことが盛り込まれた10)。さらに、中医協保険医療材料専門部会を中心に保険償還制度の議論が行われている。この中で、医療機器業界は、原則としてアウトカムでの評価を求めており、「患者の有効性安全性」、「社会的必要性」、「経済性・効率性」を軸に、医療の質の均てん化や医療の生産性向上等のプログラム医療機器特有の価値についても評価対象とすることを提言している11)。業界意見も踏まえた保険医療材料制度の見直し案5)が中医協で了承されており、医師の働き方改革の観点を踏まえた医療技術の均てん化や診療支援等が評価されることが明確化された。今後、本制度の運用が進む中、関係業界等からの意見に加え、諸外国の保険償還制度も参考にしたさらなる検討が求められる。
4.各国の保険償還経路とアウトカム指標
4-1.米国
米国の医療保険制度は日本の制度とは本質的に異なる。公的医療保険は、大きく分けて65歳以上の高齢者および障がい者を対象とする「メディケア」と低所得者を対象とする「メディケイド」の2種類が存在するが、米国国民の多くは公的医療保険の受給対象にはなく、民間医療保険を利用している12)。そのため、米国におけるDTxの保険償還は、公的医療保険の他、民間医療保険による経路も存在することが特徴である。一方、これにより、事業予見性は日本と比べ複雑であり、どのようなCommercial Pathwayを指向するか、また、そのために必要となるアウトカム指標は何かを開発段階からイメージすることが重要である。
公的医療保険による償還
FDAでは、DTxを含むSaMDに対する新たな制度設計を精力的に進めており、既に複数の製品が510(k)やDe novoによる認可/承認を受けている13)。一方、公的医療保険との連携は十分行われてはおらず、現状、患者が直接使用するDTxは給付カテゴリーの対象とはなっていない14)。しかしながら、デジタル技術の急速な浸透を背景に、DTxの公的医療保険による償還の議論が加速している。
例えば、2020年3月に米国議会上院でメンタルヘルス、物質使用障害のDTxをメディケアおよびメディケイドプログラムの適用とするための法案(Prescription Digital Therapeutics to Support Recovery Act)が提出された15)。また、Centers for Medicare & Medicaid Services(以下、CMS)は、2021年1月に、FDA BreakThrough Deviceの指定を受けた革新的医療技術に対して、4年間のメディケア適応が認められる規則(The Medicare Coverage of Innovative Technology and Definition of ‘Reasonable and Necessary’:MCIT/ R&N)の最終案を発表した16)。ただし、これらはいずれも成立しておらず、公的医療保険におけるDTxの償還制度は未だ議論の途上にあると言える。
また、産業界からも公的医療保険によるDTxの償還に関する提言が行われている。米国の医療機器協会であるAdvanced Medical Technology Associationは、2020年9月に「Modernizing Medicare Coverage of Digital Health Technologies」と題したホワイトペーパーを発出し、DTxに対する給付カテゴリーの設置(既設区分の修正または新設)や保険償還経路の改善によるアクセス性向上等について、米国政府、米国保健福祉省、CMSに改善検討を促している17)。また、保険償還に関わるデジタルヘルス(DTx含む)のアウトカム指標について、CMSやFDAが主導する官民コンソーシアムを立ち上げ、政府機関、民間医療保険、プロバイダー、患者等が連携し、評価のベストプラクティスを構築することを求めている。具体的な指標としては、「品質、健康アウトカム(臨床的効果)、患者安全性、コスト」を挙げており、開発企業がCMSに提出すべきエビデンスフレームワークの確立を提言している。
民間医療保険による償還
個別にDTxを保険償還の対象とする保険会社が増えつつあるが、いくつかの薬剤給付管理会社(PBM)では、独自に「Digital Health Formulary」を作成し、DTxを含むデジタルヘルスの保険償還を体系的に進めている。これは既定のエビデンスが認められれば、SaMDに限らずNon-SaMDでもフォーミュラリーの対象としており、広くデジタルヘルスへのアクセス性を高めている。例えば、Express Scripts社では、糖尿病、高血圧等の疾患や介護者ケアを対象とした15のモバイルアプリケーションを含む「Evernorth Digital Health Formulary」を策定している18)。また、CVS Health社では、「CVS Health Point Solutions Management」を策定し、12のデジタルソリューションを選定している19)。
フォーミュラリーへの収載可否の判断にあたっては、製品の有効性・安全性に関わる「臨床的効果」や「セキュリティ/プライバシー」、「コスト」に加え、「ユーザーエクスペリエンス」のような日常生活に密接に関与するデジタルヘルスに特徴的なアウトカム指標が評価されている。
米国における保険償還のアウトカム指標
以上から、米国においてDTxの保険償還を指向する場合、臨床的効果(健康アウトカム)、品質(セキュリティ/プライバシー等)、コスト、ユーザーエクスペリエンスに関する指標が鍵となると考える。
臨床的効果に関するアウトカム情報は薬事承認および保険償還の可否を決定する重要な情報である20)。有効性・安全性はランダム化比較試験(以下、RCT)により検証される場合が多く、DTx関連企業の業界団体であるDigital Therapeutics Allianceが公開する製品ライブラリにおいても、その多くで1試験以上のRCTが実施されていた1)。また、CVS Health社では、RCTの結果から臨床的効果を評価することが示されている19)。
また、セキュリティ/プライバシーについて、Digital Health Center of Excellenceでは、FDAが発出するガイダンスやホワイトペーパーをまとめて公開している。例えば、2018年に発行された「Content of Premarket Submissions for Management of Cybersecurity in Medical Devices21)」では、サイバーセキュリティを考慮したデバイス設計や申請資料に含むべき事項が示されており、保険償還に対する評価においても、これらのエビデンスが考慮されていると想定される。
加えて、医療コストの高い米国では、費用対効果等の経済性指標が重要であり、デジタルヘルスに対しても、開発企業が関与し、検証を行っている。例えば、FDA 510(k)クリアランスを取得したFreespira(Freespira社、心的外傷後ストレス障害等)では、救急治療や投薬コストをそれぞれ60%以上削減することを確認している(総医療コストを年間2,280ドル削減)22)。また、Express Scripts社のフォーミュラリーに収載されるLivongo社の糖尿病管理プログラムでは、レトロスペクティブ試験での検証により、一人当たりの月額医療費を約88ドル削減することが報告されている23)。さらに、CVS Health社のフォーミュラリーに収載されるBig Health社のデジタル睡眠改善プログラムでは、一人当たりの年間医療費を1,677ドル削減することを示している24)。
このように、従来の治療法と比較した医療経済上の効果が検証されている(補足1)。
補足1 ICERによる費用対効果評価
米国で費用対効果評価を行うInstitute for Clinical and Economic Review(ICER:臨床経済的評価研究所)が、デジタル治療に対する最初の費用対効果評価を2020年11月に公表している25)。このレポートでは、DTx(510(k)クリアランス取得)を含む3つのオピオイド使用障害のデジタルヘルスを対象としているが、3つのうち2つのデジタルヘルスは、エビデンス不足により費用対効果評価そのものが検証できなかった。唯一、費用対効果をモデル化できたDTxについても、長期継続によるエビデンスが不足していること等を理由に、現在の価格では長期的な費用対効果は低いと結論付けられている。(ICERの評価マトリックスにおいて、C+(Comparable or Incremental:健康への貢献度が同等もしくは小さい)に分類されている。
またICERは、デジタルヘルスの費用対効果評価において、短期的な有効性および安全性に関するエビデンスのみならず、1)有益な臨床効果の持続性、2)医療利用への影響、3)医師の生産性への影響、4)医師および患者の経験に基づくユーザビリティ、5)セキュリティ、6)多様な患者集団および医療システムへの適用、7)より大きな集団への拡張、について強固なエビデンスを準備すべきとしている。
今後、DTx承認数の増加に伴い、ICERによる費用対効果評価が償還価格に影響を与える可能性がある。
米国:多様なアウトカム指標の事例
DTxに特徴的なアウトカム指標として、ユーザーエクスペリエンスに基づくユーザビリティがある。
例えば、Express Scripts社では、ユーザビリティとして、使いやすさやトラッキング、データ同期、アクセシビリティを挙げており、専門家による検証を行っている26)。
また、米国でのデジタルヘルスフレームワークの構築に向け、ジョンズホプキンス大学が政府機関等に提唱する「Digital Health Scorecard27)」では、ユーザビリティの基準を、「様々な要件(視覚障害、運動障害、認知機能障害等)を持つ患者に対して、使いやすさや測定労力、入力負担等が許容されるものであること」としている。加えて、臨床現場でのデータ連携や負担等、医療従事者視点での期待も十分に反映すべきと言及している。
米国でのユーザビリティ評価は、ユーザー(患者や医療従事者等)のエンゲージメントを向上させ、かつ継続利用が可能なソリューションであることを、多様な視点でのアウトカム評価から実証することが求められていると言える。
4-2.ドイツ
ドイツでは、2019年12月にDigital Supply Act(DVG)が施行され、DiGA(ドイツ語でデジタルヘルスアプリの意)ディレクトリに登録されたDTx等を、公的医療保険を通じて利用できるようになった(図2、利用対象者は公的医療保険に加入する約7,300万人(約9割)の国民)。さらに、DVGに基づき導入されたファスト・トラック制度28)は、申請から登録可否判断までの速さ(申請から3か月以内)やメーカーによる償還1年目の価格設定への関与等から、迅速な市場アクセス性や高い事業予見性を有す制度として世界の注目を集めている。また、Digital Health Applications Ordinance(DiGAV:申請手続きやエビデンス要件等を規定)やDigital Care and Nursing Modernisation Act(DVPMG:データ保護やセキュリティ等を規定)等、種々の制度が整備されており、DTxの医療展開が積極的に進められている29)。
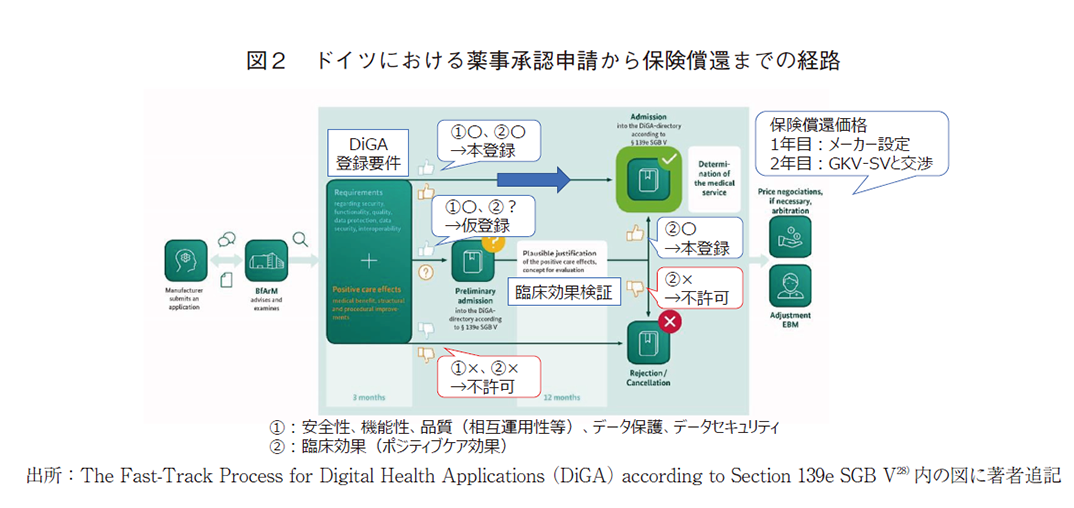
これらの制度のもとDiGAディレクトリに登録された製品/適用は、2022年2月3日時点で28ある(本登録:8、仮登録:20)30)。DiGAディレクトリに登録されるためには、まず、「安全性、機能性、品質(相互運用性等)、データ保護、データセキュリティ」の各要件に適合することが必要となる。例えば、機器の安全性については、欧州CEマークの取得が必須であり、データ保護については、欧州一般データ保護規則(GDPR)や連邦データ保護法(BDSG)への遵守が求められている。また、品質については、他のデジタルアプリケーションとのデータ相互運用性を始め、堅牢性やユーザー保護、使いやすさ、医療従事者サポート、医療コンテンツの品質、患者安全性等に関して、要求基準への適合性が確認される。
上記の要件を充足した上で、臨床効果(ポジティブケア効果)に対する検証が行われる。ただし、臨床効果はDiGAディレクトリ申請時に必須ではなく、十分なエビデンスが取得できていない場合は、文献による評価や臨床効果の試験計画が認められれば、仮登録の形で保険償還される。この場合、12か月(最長24か月)の間にリアルワールドデータ等を活用し、効果を実証することが求められる。
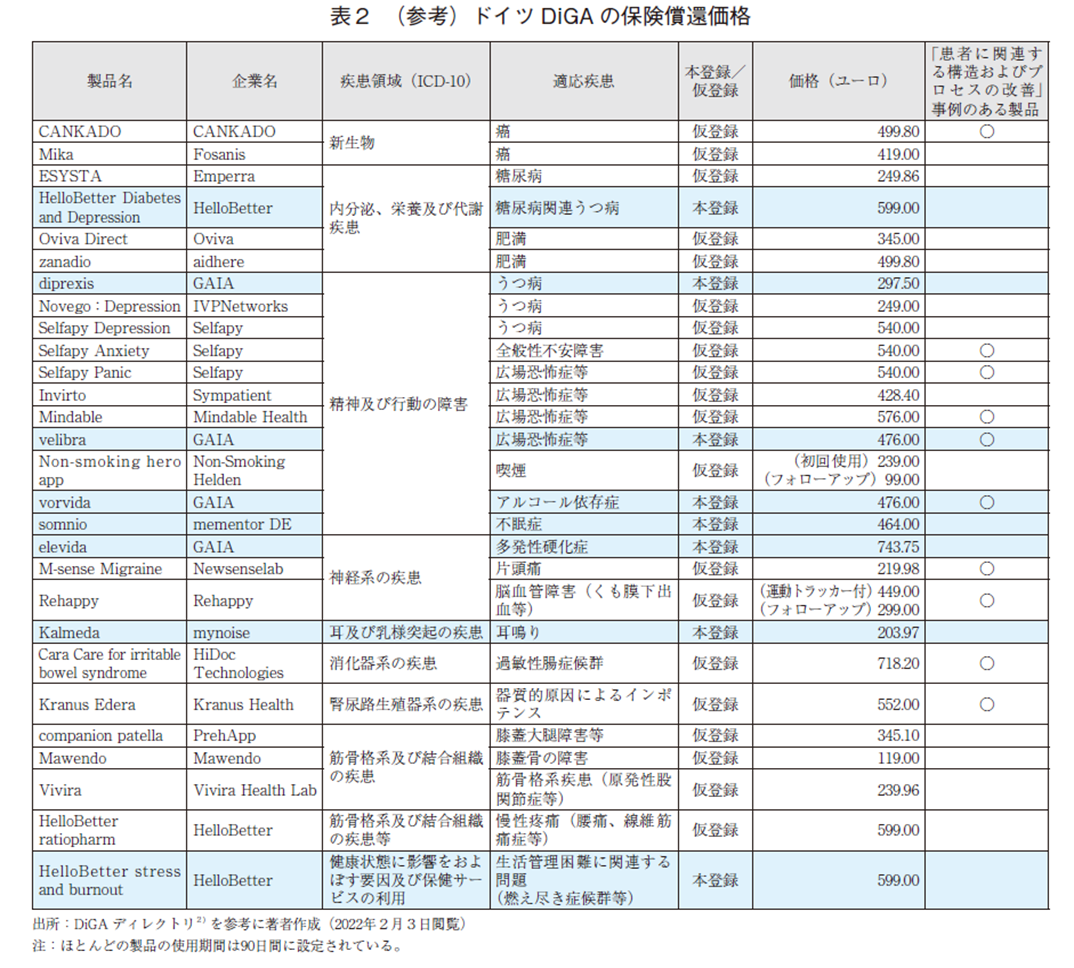
一方、興味深いことに保険償還価格の決定に関与するNational Association of Statutory Health Insurance Funds(GKV-SV)が、2021年1月に、DiGAの要件と基準に対するポジションペーパーを発出している31)。この中で、GKV-SVは、DiGAの薬事承認と保険償還のための法的枠組みが、ベネフィット、品質、経済効率の各要件を十分保証するよう設計されていないことに懸念を示している。特に、仮登録製品の1年目の償還価格をメーカーが設定するドイツ特有の施策について、十分な臨床効果や利用状況が検証されていない製品に対して高額な価格で保険償還することの経済合理性を課題と見ており、自由価格制の見直しを求めている32)。参考としてDiGAディレクトリに登録されている製品の償還価格を表2に示した。適応疾患や実証された効果等により価格が変わることは大前提にあるが、500ユーロ前後に価格設定されている製品が多かった。
現状、医療経済評価はDiGA登録要件にはないものの、価格交渉時に考慮される場合があると示されている28)。市民/患者やGKV-SVのコンセンサスを得るためには、今後、費用対効果等の医療経済に関するアウトカム指標が保険償還価格の決定にさらに大きな影響を与える可能性がある33)。
ドイツ:多様なアウトカム指標の事例
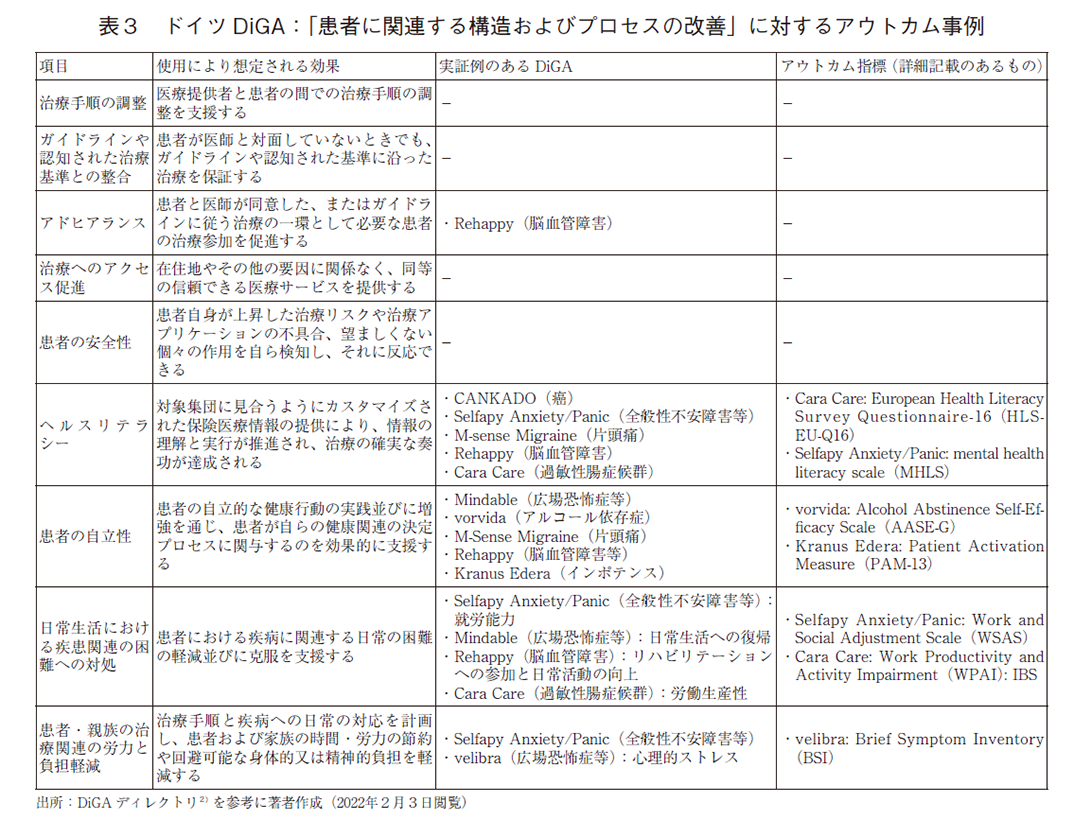
多様なアウトカム指標の検討のため、臨床効果(ポジティブケア効果)について、個別事例を調査した。臨床効果は、「医療上の効果」と「患者に関連する構造およびプロセスの改善」に大別される。両項目の実証はDiGA登録に必須ではないが、保険償還価格の決定に有利に働くことがあるとされている28)。適応疾患や効果等の違いを考慮する必要はあるが、実際に「患者に関連する構造およびプロセスの改善」に対するアウトカム事例を検証した製品では、相対的に設定価格が高い傾向が認められた(表2)。
-
(1)医療上の効果
「医療上の効果」は臨床試験で実証される治療効果であり、健康状態やQOLの改善、疾病期間の短縮等が検証される。DiGAディレクトリの収載情報から見ると、その多くは複数のRCTにより検証が行われている。ただし、連邦医薬品医療機器研究所(BfArM)はガイドラインの中で、リアルワールドデータを用いたレトロスペクティブ研究(後ろ向き研究)による検証を認めており28)、仮登録の12か月という短期間でのエビデンス創出に向け、今後RCT以外での検証の増加が予想される34)。
-
(2)患者に関連する構造およびプロセスの改善
患者に関連するDiGAの使用効果について、表3に示す評価項目(9項目)が設定されており、医療上の効果のみならず、患者やその家族の視点での多様な評価を行うことが目指されている。DiGAディレクトリの事例では、「アドヒアランス」や「ヘルスリテラシー」、「患者の自立性」、「日常生活における疾患関連の困難への対処」、「患者・親族の治療関連の労力と負担軽減」に対するアウトカムが、既に実際の評価指標として活用されていた。
具体的事例として、過敏性腸症候群の治療アプリであるCara Care(HiDoc Technologies社)では、ヘルスリテラシー(指標:HLS-EU-Q16)や労働生産性(指標:WPAI:IBS)がアウトカム指標として用いられている35)。また、アルコール依存症に対する治療支援アプリであるvorvida(GAIA社)では、アルコール消費に対する自己効力感(自立性)の向上(指標:Alcohol Abstinence Self-Efficacy Scale)が検証されている36)。広場恐怖症等の治療支援アプリであるvelibra(GAIA社)では、「患者・親族の治療関連の労力と負担軽減」として、患者の心理的ストレスを効果的に軽減できることを示している(指標:Brief Symptom Inventory)37)。
国による取り組みとして、ドイツ連邦保健省がイニシアチブを取るZukunftsregion Digitale Gesundheit(ZDG)プロジェクトでは、M-sense Migraine(Newsenselab社、片頭痛)をはじめ、複数のDiGAを対象に、ドイツ医療でのデジタル化の普及を加速するための検証が行われている38)。
この中では、糖尿病、片頭痛、腰痛のような慢性疾患や日常介護におけるデジタルケアサービスの適用が検討され、患者、医療従事者、介護家族等から広範に治療アウトカムや意見を収集している。本プロジェクトに参加する医療従事者(理学療法士)へのインタビューでは、デジタルヘルスの継続的な医療介入により、患者の治療へのアクセス性が向上することが示されている39)。本プロジェクトは2022年末まで継続される予定であるが、収集された患者等のアウトカムが各製品の保険償還の検討に用いられる可能性もある。
4-3.英国
一般的に、英国で医療機器が保険償還を受けるためには、UKCAマーク40)を取得し、かつMHRA(医薬品・医療製品規制庁)に登録された上で、NHS(国民保健サービス)による使用推奨を受けることが必要となる。また、保険償還の判断には、NICEが行う医療技術評価の結果が参照される。DTxに関しては、2018年にNICEが「Evidence standards framework for digital health technologies」を公開し、他国に先んじて広くデジタルヘルスの医療展開を図ってきた。しかしながら、現状、DTxが全国レベルで保険償還を受けるための専用経路は存在せず、地域のNHSが保険償還の主要な役割を担っている41)。英国におけるDTxの保険償還制度は未だ検討の途上にある。
このような中、NICEは、デジタル技術の進展も含め、急速に変化する医療とケアへの課題に取り組むため、2021年4月に「NICE strategy 2021 to 2026」を発表した42)。戦略の柱の1つとして、「迅速で堅牢、かつ応答性の高いテクノロジー評価」を掲げており、デジタルヘルスを今後5年間の重点分野に位置付けている。具体的には、規制、エビデンス基準の整備を支援するデジタルヘルスオフィスの立ち上げ(2021年5月設置)や新規医療技術に対するアクセス経路の開発により、デジタルヘルスへのアクセス性向上を図っている。
また、公的機関からデジタルヘルスの評価指標に関する文書がいくつか公開されている。
NHSを所掌する保健省は、2021年1月「A guide to good practice for digital and data-driven health technologies」を発出した43)。この中で、NHSがデジタル・データ駆動技術を導入するためのエビデンス要件(①データ利用の倫理、②有効性、③使いやすさとアクセシビリティ、④技術的保証、⑤臨床安全性、⑥データ保護、⑦データ透明性、⑧サイバーセキュリティ、⑨相互運用性)が示されており、開発企業はこれらを開発戦略に組み込むことが推奨されている。
NICEが発出した「Evidence standards framework for digital health technologies」では、DTxはTier C(介入:Interventions)に該当し、「①有効性(DTxの場合、RCTを推奨)、②適切な行動変容技術の使用、③データ・情報の信頼性、④使用状況・価値を示す継続的なデータ収集、⑤専門家レビュー、⑥品質とセキュリティ、⑦現状のケアシステムとの関連性、⑧ユーザー満足度、⑨平等性(ケアへのアクセシビリティ)」といった「有効性基準」に加え、「経済効果の基準」も示されている7)。
英国でDTxの保険償還を目指す場合、これらの基準を充足するエビデンスが求められると言える。
英国:多様なアウトカム指標の事例
NICEでは、市民や臨床専門家等により構成される独立委員会がエビデンスに基づく様々な文書を作成している。デジタルヘルスを含む医療機器に対しては、「Medtech innovation briefings」として、その技術やエビデンス、予想されるコスト等について、見解やアドバイスを公開している44)。本文書はNICEによる使用推奨を提供するものではないが、NHSや医療機関での当該技術の採用判断を支援する情報であることから、本文書を通じて、英国におけるユーザー視点(患者・介護者、医療従事者)のアウトカム指標を深堀したい45)。
-
(1)患者・介護者視点でのアウトカム指標
携帯型の心房細動検出モニターおよび管理アプリからなるKardiaMobile(AliveCor社)は、日常的な心電図記録から心房細動を識別することを目的としている。患者からは、不整脈が心房細動によるものか否かを迅速に確認でき、かつ医師等のケアチームと測定値を共有できる安心感(患者にとって心強い味方が手元にあること)がプラスの効果として挙げられている46)。
また、リアルタイム血糖モニタリングシステムであるDexcomG6(Dexcom社)では、英国糖尿病学会が、糖尿病の子供たちの両親や介護者が子供から離れている際に経験する糖尿病関連の不安を軽減することに潜在的利点があると述べている47)。
さらに、不眠症改善アプリであるSleepio(Big Health社)では、通院回数や治療までの待ち時間削減(アクセス性向上)が利点として言及されている48)。
-
(2)医療従事者視点でのアウトカム指標
医療従事者に対するアウトカム指標では、主に医療リソースへの影響が検証されている。慢性閉塞性肺疾患(COPD)の管理アプリであるmyCOPD(my mhealth社)に対する臨床専門家のコメントとして、アプリの使用により患者教育に費やされる医療スタッフの時間を削減したり、患者の自己管理を促すことで診療や入院の必要性を削減出来たりすることを挙げている49)。また、政策研ニュースNo.64で中野が報告しているが、うつ病の治療アプリであるSpace from Depression(Silvercloud Health社)においては、治療にかかるセラピストの対応時間を大幅に減らすこと(平均で約137分の短縮)をアウトカム指標の一つとしている50)、51)。
5.小括と考察
5-1.小括
本調査で収集した米国、ドイツ、英国の保険償還に関連するアウトカム指標の現状をまとめる。
有用性(有効性・安全性)やソフトウェア品質(データ保護、サイバーセキュリティ等)のような、DTxの本質にかかわるアウトカムは、概ね各国で共通であり、この土台の上に独自の指標が盛り込まれている。
例えば、費用対効果等の医療経済指標は米国や英国では重要なアウトカム指標の一つに設定されているが、ドイツではDiGAの登録要件にはなく、価格交渉時に考慮される場合があると示されているのみであり、活用の違いが見られた。
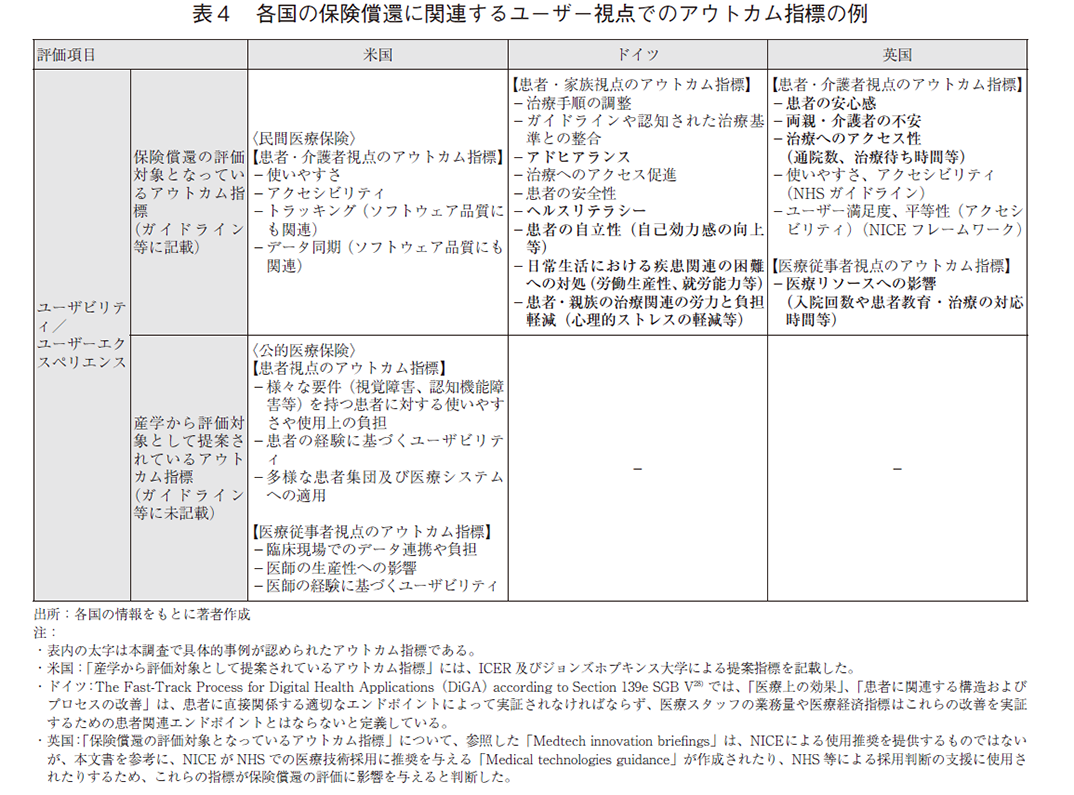
また、各国の特徴が色濃く見られたのは、ユーザビリティ/ユーザーエクスペリエンスに関するアウトカム指標であり、特にドイツ、英国ではDTxの特性にあわせ、既に様々な指標が保険償還の検討に利用されている(表4)。例えば、ドイツでは、労働生産性やヘルスリテラシー、患者の心理的ストレス等の「患者中心(家族含む)の価値」を重視しており、英国では、患者や介護者のみならず、医療従事者視点でのアウトカム指標(治療への対応時間等)も考慮している点が特徴的であった。
一方、米国では民間医療保険において、患者や介護者視点と想定されるアウトカム指標(使いやすさ、アクセシビリティ等)が取り入れられているが、具体的なアウトカム指標の事例はドイツ、英国に比べ多くはなかった。また、公的医療保険における評価指標は未だ議論の途上であり、複数の機関から提案がなされている状態にある。
今後、現行制度の運用により生じた課題点やDTxの進化等を踏まえ、各国の保険償還の評価対象となるユーザー視点のアウトカム指標がさらに整備されていくことが期待される。
5-2.わが国のDTx保険償還制度に関する考察
調査結果を踏まえ、DTxに対する日本の保険償還制度の評価軸を考える。
わが国の保険償還価格の検討において、有効性・安全性が大きなウェイトを占める中、医療機器業界は、DTxを含むプログラム医療機器に対して、有効性・安全性に加え、医療の質の均てん化に関わる「社会的必要性」や医師等の生産性に関わる「経済性・効率性」を新たなアウトカム指標として提言している。中医協での議論を経て、医療技術の均てん化や診療支援等に対する診療報酬上の位置付けが明確化されることとなったが、これらは主に医療従事者を視点としたアウトカム指標と言えるだろう。
では、その他のアウトカム指標はどうであろうか。DTxは蓄積される患者情報を医療従事者が活用するのみならず、日常を通じて患者自らが使用し、介護者等も含めて自己の健康状態を共有・管理することで医療の高質化が期待されるツールと言える。このようなDTxの特性を踏まえると、医療従事者視点のみならず、「多様なユーザー視点のアウトカム」も考慮すべきではないかと考える。また、DTxという新たなイノベーションを促進するために、多様なユーザー視点でのアウトカム指標が必要となっているからこそ、欧米でもこのような指標を積極的に取り入れようとしている側面もあるのではないだろうか。
例えば、米国では、医療機器業界が公的医療保険によるDTx等のデジタルヘルスの償還に対し、患者を含む官民コンソーシアムでのアウトカム指標の検討を求めており、ドイツでは患者関連のアウトカム指標が既に保険償還の検討に活用されている。また、英国では、4-3項で紹介した「Medtech innovation briefings」に加え、NICEがNHSにおける医療技術採用に推奨を与える「Medical technologies guidance」の策定にあたっても、患者や介護者、医療従事者、医療技術の専門家等、多様な意見を収集することが規定されている52)。このように、各国で多様なユーザー視点のアウトカムや意見を取り入れる試みが進められている。
具体的なアウトカム指標はDTxの特性や適応疾患、利用目的等も踏まえた個別の検討が必要ではあるが、既に利用実績のあるアウトカム測定ツールを活用した多様な価値評価を実践し、迅速な制度検討を進めていくことが我が国に必要ではないか。
日本におけるDTxの開発状況(表1)や各国で活用されるユーザー視点のアウトカム指標(表4)を考慮すると、精神疾患等に対する労働生産性の改善やヘルスリテラシーの向上、癌等に対する患者・家族介護者の不安軽減等の価値を示せる可能性がある。また、医療従事者の負担軽減についても、認知行動療法に基づく治療が必要となる精神疾患に対する専門セラピストの人手不足の補完や、生活習慣病における患者状態の把握のための時間の削減等が定量的に評価できると考える。
一方、上記を進めるためには、医療従事者に加え、患者や家族、介護者等、幅広いユーザーの声を保険償還の評価に反映する仕組みの構築が必要となる。
日本では、保険収載後の使用実績を踏まえ、臨床的有用性を再評価する「チャレンジ申請制度」がプログラム医療機器にも適用される。多様なユーザー視点の価値を評価する場合、本制度の枠組みを活用し、臨床的有用性のみならず、収載後の一定期間においてリアルワールドで蓄積された広範なアウトカムから得られる多様な視点での価値も再評価の対象とされることが望ましい。特にDTxの場合、他のデジタルツールとも連携しながら、患者や医療従事者等のアウトカムを広範に収集することが可能である。ただし、現状、事前の再評価計画や収集されたエビデンスの妥当性の議論に患者団体等は含まれていないことから、「ユーザー視点の価値」を適切に設定し、評価するために、患者等の意見が反映される体制や制度の構築が必要と考える。
急速に進化するデジタル技術に対しては、現行のルールや枠組みを活かした迅速な制度整備が重要と言える。
ここまでDTxの保険償還に関連するアウトカム指標を見てきたが、価格設定を含めた保険償還の可否判断に、どのアウトカム指標がどのように活用されるのか、各国における尺度の違いは不明瞭な部分もある。しかし、「ユーザー視点のアウトカム」では、例えば、ドイツにおける患者視点のアウトカム指標は保険償還価格の決定に有利に働く場合があるとされていることから、価格設定への影響が大きいと推察される。一方、英国では、NICEがNHSにおける医療技術採用に推奨を与えるガイダンスに、患者や介護者等、多様な意見を取り入れることが規定されており、保険償還の可否判断にも影響を与えていると言えるだろう。
前述のとおり、日本においては、リアルワールドで蓄積された多様なユーザー視点のアウトカムを活用し、チャレンジ申請制度により保険償還価格等を再評価することが望ましいと考えるが、今後、どの過程でこれらのアウトカムを評価すべきかについては議論が必要である。
一方、日本での医療経済指標(費用対効果)の保険償還価格への適用は、現状、市場規模が大きい、または著しく単価が高い製品に限定されている。この基準に合致するとは言えないDTxに対して、保険償還の要件として、開発企業が単独で医療経済性を算出し、提示することは現実的ではない。しかしながら、DTxは治療成績向上による重大疾患の発症・重症化リスクの抑制や医療の効率化等が期待されるため、社会保障費等の日本全体の医療資源への影響を示すことは、日本におけるDTxの医療展開を促進する一つの鍵となるであろう。ドイツでは公的資金を活用し、DTxの医療経済性を評価する研究が進められていることから33)、わが国においても、まずはDTx開発が先行する精神疾患や生活習慣病等を対象に、官民が連携した医療経済性評価を実施し、DTxの医療展開を図っていくことが必要ではないだろうか。
6.まとめ
本稿ではDTxに焦点を当て、米国、ドイツ、英国の保険償還の現状やアウトカム指標から、わが国のDTx保険償還の評価軸について考察した。
この一年でわが国のDTx保険償還の議論が劇的に進んだことは、各ステークホルダーによる不断の努力の結果と言える。今後、保険償還制度をブラッシュアップする中で最も重要なことは、DTxの特性を踏まえた適切なアウトカム指標が評価項目として設定出来ること、および関係するステークホルダーによってそれらの価値が適切に評価出来ることと考える。その枠組みの中で、国内外で蓄積される事例や各国動向を踏まえながら、個別のDTxに対する具体的なアウトカム指標や評価基準等を、産官学民が一体となり丁寧に検討していくことが重要である。さらに言えば、将来的なDTxのグローバル展開を考えると、各国で共通するアウトカム指標の基準や定量化方法等については、国際調和のとれた規制整備への取り組みも今後考慮すべきではないだろうか。その際、医薬品において、ユーザー視点の開発や国際的な制度設計に関与し、多様な価値の検討も進める製薬産業がこれらの議論に参加する意義は大いにあると言える。
今後、デジタル技術は我々の想像を遥かに超えるスピードで進化していくであろうが、どれほどデジタル技術が進歩しようと、その技術を使用するのは人であり、利用者にとって有益な技術でなければならない。その実現のためには、有効性・安全性はもちろんのこと、ユーザー中心の価値を追求し、信頼性の高いアウトカムからエビデンスを構築していくことが、DTx等の開発における重要な視点の一つになると考える。さらに言えば、そのような観点で具現化された“価値”について、然るべき制度の下、適切に評価がなされるという「安心感」が、わが国のDTx産業の振興にもつながるであろう。
「デジタル技術を活用した新たな医療・ヘルスケアのかたちが醸成されていく」、そのような未来の実現のため、製薬産業も含めた産官学民の多様なステークホルダーが協力し、議論が進められることを期待したい。
-
1)
-
2)連邦医薬品医療機器研究所(BfArM)、「The DiGA directory」(2021年12月20日閲覧)
-
3)CureApp社プレスリリース(2020年11月11日)(2021年12月13日閲覧)
-
4)日本経済新聞記事、「キュア・アップ、高血圧治療アプリの承認申請」、(2021年9月3日)(2021年12月13日閲覧)
-
5)厚生労働省、「中央社会保険医療協議会保険医療材料専門部会(第118回)材-1」(2022年1月28日閲覧)
-
6)
-
7)
-
8)厚生労働省、「中央社会保険医療協議会 総会(第468回)医療機器及び臨床検査の保険適用について総-1-1」(2021年12月13日閲覧)
-
9)厚生労働省、「中央社会保険医療協議会 総会(第468回)議事録」(2021年12月13日閲覧)
-
10)内閣府、規制改革実施計画(令和3年6月閣議決定)(2021年12月13日閲覧)
-
11)厚生労働省、「中央社会保険医療協議会保険医療材料専門部会(第112回) 材-2」(2022年1月17日閲覧)
-
12)日本貿易振興機構、「米国における医療保険制度の概要」(2021年6月)(2021年12月13日閲覧)
-
13)510(k)は開発された医療機器が市販製品と同等の有効性と安全性を有す(実質的に同等である)ことを示すための市販前申請である。また、De novoは比較可能な同等製品が存在せず、かつリスクが軽度から中等度の新規医療機器に対する市販前申請である。
-
14)Ginger社のメンタルヘルスアプリ(コロンビア特別区のメディケイドマネージドケアでの対象)やOmada社のデジタル糖尿病予防プログラム(疾病予防管理センター(CDC)が認めた糖尿病予防プログラムにおけるカリフォルニア州等の一部のメディケイドプログラムでの対象)等、地域や適用条件等が限定された公的保険償還はいくつか存在する。
https://bhbusiness.com/2021/07/28/ginger-dives-into-medicaid-with-new-amerihealth-caritas-partnership/
https://www.healthaffairs.org/doi/10.1377/hlthaff.2021.01292(いずれも2022年1月19日閲覧) -
15)
-
16)
-
17)
-
18)Express Scripts、「EVERNORTH DIGITAL HEALTH FORMULARY」(2021年12月13日閲覧)
-
19)CVS Health、「Health Point Solution Management」(2021年12月13日閲覧)
-
20)薬事承認に対する基準として、FDAからはソフトウェアの効果的な臨床評価に関するガイダンス(Software as a Medical Device(SAMD): Clinical Evaluation)や、申請資料に含むべき有効性・安全性情報に関するガイダンス(Content of Premarket Submissions for Device Software Functions)等が発出されている。(2021年12月13日閲覧)
「Software as a Medical Device(SAMD): Clinical Evaluation」(2017年12月8日)
「Content of Premarket Submissions for Device Software Functions」(2021年11月4日) -
21)
-
22)Alicia Kaplan. et al、Evaluating the Impact of Freespira on Panic Disorder Patients’ Health Outcomes and Healthcare Costs within the Allegheny Health Network、Applied Psychophysiology and Biofeedback、2020 Sep; 45(3): 175-181
-
23)Christopher M Whaley. et al、Reduced medical spending associated with increased use of a remote diabetes management program and lower mean blood glucose values、J Med Econ.、2019 Sep;22(9): 869-877
-
24)Big Healthプレスリリース(2020年5月12日)(2021年12月13日閲覧)
-
25)
-
26)
-
27)Simon C. Mathews. et al、Digital health: a path to validation、npj Digital Medicine. 2019 May 13; 2: 38
-
28)
-
29)Gottfried Ludewig. et al、Digitale Gesundheitsanwendungen: gesetzliche Einführung patientenzentrierter digitaler Innovationen in die Gesundheitsversorgung、Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2021; 64(10): 1198-1206.
-
30)
-
31)
-
32)DiGA guide(139e SGB V)では、1年目の保険償還価格を2年目の価格(メーカーとGKV-SVが交渉)より低く設定するよう求めている。また、比較可能なDiGAグループがある場合、メーカー団体とGKV-SVの間で保険償還額の上限設定が可能としている。
-
33)
-
34)
-
35)DiGAディレクトリ、「Cara Care for irritable bowel syndrome」(2021年12月28日閲覧)
-
36)DiGAディレクトリ、「vorvida」(2021年12月28日閲覧)
-
37)DiGA ディレクトリ、「velibra」(2021年12月28日閲覧)
-
38)
-
39)連邦保健省、Zukunftsregion Digitale Gesundheitインタビュー(2021年12月14日閲覧)
-
40)UKCAマークは、欧州CEマークに代わり、2021年1月1日から英国で導入された製品基準適合マークで、現在CEマークの対象となっている製品のほとんどに適用される。英国(イングランド、ウェールズ、スコットランド)での上市製品に使用されている。
-
41)
-
42)NICE、「NICE strategy 2021 to 2026」(2021年4月)(2021年12月15日閲覧)
-
43)
-
44)NICE、「Medtech innovation briefings」(2021年12月15日閲覧)
なお、精神疾患等に対するDTxに対しては、文献情報を基にした評価(Improving Access to Psychological Therapies assessment briefings)がNHS及びNICEにより実施された後、この結果から、実践評価(Medtech innovation briefings)の実施可否が決定される。 -
45)
-
46)NICE、「Medical technology consultation: GID-MT554 KardiaMobile for the ambulatory detection of atrial fibrillation Supporting documentation – Committee papers, Appendix C: Results from the patient survey」(2021年7月15日公開)(2022年2月4日閲覧)
なお、KardiaMobileに対するMedtech innovation briefing[MIB232]は、2022年1月にMedical technologies guidance[MTG64]に置き換えられ、閲覧不可となったため、Medical technologies guidance の当該記載を参考とした。 -
47)
-
48)
-
49)NICE、「myCOPD for self-management of chronic obstructive pulmonary disease[MIB214]」(2020年4月1日公開)(2021年12月15日閲覧)
なお、NHSがmyCOPDを利用する患者ストーリーを公開しており、物理的距離を超え治療へアクセスできる点を患者利点として挙げている。 -
50)医薬産業政策研究所、「医薬品の多様な価値に関する一考察-COVID-19およびDTx等の動向から-」、政策研ニュースNo.64(2021年11月)
-
51)
-
52)

