Opinion PPI(Patient and Public Involvement)の最新動向-患者・市民参画の成長期-
医薬産業政策研究所 主任研究員 吉田晃子
1.はじめに
およそ2年半前の政策研ニュースNo.58(2019年11月号)で、患者・市民参画、PPI(Patient and Public Involvement)という言葉が日本でも耳目を集めつつあるとして、PPIに関する日本での最近の動向を紹介している。そして、一般的には認知度が低い現状を踏まえれば、まずはその啓発から着実に進めていく必要があること、さらには、基礎的研究から社会実装までの過程全体を通じて、多様なステークホルダーが参画し社会のニーズや期待に合致するような形で科学技術を推進するための取り組み、RRI(Responsible Research & Innovation:責任ある研究・イノベーション)という考え方も、有効な社会実装のためには必要となると、期待を込めて述べている1)。
その後、PPIに係る動きは一層活発化し、広がりを見せている。本稿では、日本や、PPIの歴史がある欧州の英国でのPPIに関する最近の動向を紹介し、それらを踏まえた今後の日本への期待や課題を述べることにする。
2.PPIとは
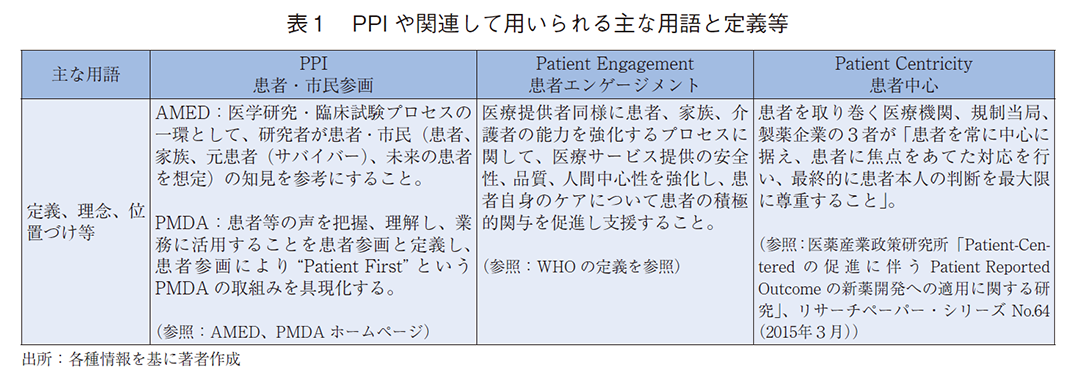
PPIは英国で最初に採り入れられた考え方で、患者・市民のために、または患者・市民について研究が行われることではなく、「患者・市民と共に、または患者・市民によって研究が行われること」という、元々は研究分野(医学研究や臨床試験など)に寄った定義がある2)。しかし、近年では、研究分野に限らず医療政策など全般において、その意思決定の場に患者・市民の参画を求めるという考え方に発展している。そのような方向性を踏まえ、本稿では、PPIを広義に考えることにする。また、本論に入る前に、PPIや関連して用いられる主な用語と定義等について、表1に整理している。

3.国内におけるPPIの近年の取り組み
およそ2年半前に、政策研ニュースでまとめた今後の課題1)について、表2に示している。こうした課題がある中で、行われてきた主な取り組み事例について、次の3.1~3.3で見ていきたい。
3.1 AMED(日本医療研究開発機構)の取り組み
AMEDでは臨床研究等における患者・市民参画に関する動向調査3)を経て、研究へのPPIの取り組みを推進している。
近年は、AMED事業において研究へのPPIの取り組みを啓発するための紹介動画4)が作成されたり、研究者等からのPPIに関する相談を受け付けるオンラインの窓口が設置5)されたりしている。
また、アレルギー疾患実用化研究事業「患者・市民参画によるスマートフォンアプリケーションを用いた花粉症の自覚症状の見える化と重症化因子解明のための基盤研究基盤研究」(順天堂大学)では、患者・市民の声を採り入れたアプリ研究を実現6)し、花粉症予防アプリ「アレルサーチ®」7)として実用化されている。
そして、AMEDの定義に基づき、研究への患者・市民参画へ取り組む医療機関や研究機関も、各地に広がりつつある。順天堂大学医学部附属順天堂医院も、臨床研究中核病院としてPPIを推進している一つである8)。
さらにAMEDでは、2021年10月1日付で「研究公正・社会共創課」を設置し、「医療研究開発に伴い生じる倫理的・法的・社会的課題(ELSI)への対応」、PPIをはじめとする「多様な幸せ(well-being)を実現するためのダイバーシティ推進」、「Society5.0における医療研究開発のための「持続可能な開発目標(SDGs)」への対応」の3点を「社会共創(Social Co-creation)」の取り組みとして位置づけ、推進している。AMEDの「社会共創」に関する昨今の代表的な取り組みとしては、感染症研究開発ELSIプログラムが挙げられている。本プログラムでは、新型コロナウイルス感染症への対応として、感染症の医療研究開発に資する知識や技術等の創出を目指す調査が行われたが、その採択にあたっては、患者の立場を代表する課題評価委員が評価業務に従事している9)。このほか、「AMED難治性疾患実用化研究事業」においても、令和2年度2次公募の事前評価に患者団体の委員が加わっている10)。
AMEDの取り組みは、PPIの意義や実践方法についての情報を得る機会が少ないとされた、開発者側だけでなく、患者や市民への知らせる、広める、育てる視点での活動であり、社会全体への波及効果も及ぼしている。

3.2 PMDA(独立行政法人 医薬品医療機器総合機構)の取り組み:患者参画ガイダンス発行
PMDAは、患者の声・意見を反映することで業務の質を高めるとともに、患者の医薬品・医療機器への理解と満足度の向上を図ることを目指すとし、PMDA及びその役職員が参照すべき活動指針を取りまとめた「独立行政法人医薬品医療機器総 合機構 患者参画ガイダンス」11)(以下、患者参画ガイダンス)を、2021年9月7日に公表している。患者参画ガイダンスの目次と概要を図1に示している。「患者等の声の積極的な情報収集を行い、業務の質の向上を図るとともに、患者等向けの情報提供の充実に努め、PMDAの業務及び薬事行政に対する理解の向上につなげる」と示される通り、情報交換を促進することによって患者参画の推進を図ることが、患者参画ガイダンスの基本的方針となっている。本文においても、情報収集、反映、提供に軸が置かれている。以降で、本文より概要を紹介する。
患者等からの情報の収集・反映について、PMDAにおける承認審査や安全対策等の業務は、科学的な議論を基本としており、患者等の声を収集・反映する場合においても、科学的な妥当性を意識して取り組む必要があると、方針を示している。患者等の声を収集する枠組みとして積極的に実施するとされる「患者団体との意見交換・勉強会の実施」に際しては、患者団体の規模や疾患領域等を踏まえ広く参加することが求められることから、一定の公平性・透明性を考慮し、また利益相反を適切に制御する必要があることも書かれている。患者からの情報への対応については、医薬品等の開発においては、医薬品等の対象者である患者のニーズや悩みを理解することが必要であり、治験等の実施に当たって、その立案段階から患者等の声を活かす取組みが活発になっていること、今後、患者等の声を基に開発した医薬品等や、患者報告アウトカム(Patient Reported Outcome:PRO)等を評価項目の一部とした治験の結果を含む承認申請が増加すると考えられることが記載される。また、対面助言等で相談者側に患者等が参加する場合を想定し、対象品目の科学的な評価等に資する情報を得ることを目的とするとスタンスを明らかにしている。
PROについて、「審査において患者のBenefitを評価するための有用なツールであり、これを活用することは、臨床的意義が患者に支持される医薬品等の効率的な開発に資すると考えられる。」とする一方で、「PRO尺度の使用にあたり、当該PRO尺度がガイドライン等で示された科学的な方法に基づき開発及び言語バリデーションされていることを確認することが重要であり、PRO尺度の結果解釈においては、当該尺度により評価することの臨床的意義も考慮する必要がある。そのため、承認申請資料の一部として当該データが提出される際には、言語バリデーションの実施状況や臨床評価ガイドラインへの記載を含む国内外での使用実績等の観点に留意しつつ、その取扱いについて検討する。」ことが示されている。
患者等向け情報提供について、患者等のPMDAの業務や薬事行政に対する基礎的な理解が前提となるため、患者等が理解を深める機会を提供する必要があるとし、その際には、収集した情報を適切にフィードバックできるよう検討を行うとされている。PMDAがこれまで患者団体等と直接的に関わった経験は限られている現状を踏まえ、通常業務として実施している情報提供活動の観点とは別に、一般向けに理解できる情報提供のあり方について考慮する必要があるとの記載もある。
「薬事行政に係る基礎的な情報発信」として、PMDAウェブサイトでの情報提供等、医薬品等の審査プロセスについて、透明性を確保し、適切な情報開示を行うこと、副作用や不具合に関する情報について分かりやすい情報提供を行うこと等に加え、患者等にとって有益な情報となるものについては、様々な媒体を利用して、広く情報提供することが記載される。また、最も重要な媒体のひとつとして「PMDAウェブサイト」を掲げ、患者視点でのユーザビリティ向上のために充実を図るとし、患者にとってアクセスのしやすい方法として、ソーシャルメディアの利用、メール・動画サイト、出版物を利用した配信等も検討するとのことである。
PMDAによる患者参画ガイダンスの発行は、医薬品開発及び承認審査並びに安全対策等市販後までの患者参画を推進することが期待され、創薬、育薬プロセスにおけるPPIの幅を大きく広げることとなり、日本のPPIの体制作り、風土醸成へも寄与することとなるだろう。また、PMDAだけでなく研究、開発者や患者等にもPPIの意義や実践方法についての情報を得る機会をもたらし、理解が進み、開発事例につながっていくことを今後期待したい。
3.3 その他各種活動の活発化
PPI Japan(患者・市民参画コンソーシアム)12)では、真の「産患官学」連携を実現する母体となることを目指し、様々な活動を行っている。患者・市民向けの医療・医薬品開発に関する教育の第一歩として、2020年11月にEUPATI13)とパートナーシップに関する基本合意書を締結し、EUPATIToolBox日本語版をホームページで公開14)している。EUPATI ToolBox日本語版では、医薬品の承認手続き等は欧州の仕組みを前提としているものの、研究開発や患者・市民参画に関する疑問を検索したり、必要な情報を得たりすることが可能となっている。また、医薬品開発のみならず、患者・市民参画の事例も多数紹介されている。
また、PPI Japanでは、これまで複数回の患者・市民参画(PPI)研究会や会員向けの対話会、セミナーシリーズ「日本におけるPPI活動を知ろう」等を開催し、企画を通じた対話の促進、患者・市民との連携に関心をもつ産業界と医療・医薬品の開発に興味を持っている患者や市民がコミュニケーションできる機会の創出、それらをコーディネートする人材の育成を確実に進めてきている。PPI発展普及に向けた共創・協奏の場(プラットフォーム)としての発展が一層期待される。
2020年6月に発足した一般社団法人 医療開発基盤研究所(Ji4pe)15)では、医薬品の開発と適正使用への理解を患者及び患者団体、患者支援団体、一般市民及び産官学と共有し、エビデンスと価値観に基づく医療評価を推進する事業を行うことを目的とし活動している。ウェブサイトからは、理解を普及啓発するための教育研修事業等が推進され、そのラインナップや受講対象者の裾野拡大がみえる。
また、一般社団法人 ディー・アイ・エー・ジャパン16)(以下、DIA)でも、産官学患者の4者で進めるため議論の場として、DIAペイシェント・エンゲージメントウェビナーが開催されている。
4回目のペイシェント・エンゲージメントウェビナー(2021年12月)では、規制当局や企業が持っているPPIの価値とメトリックス(評価指標)を企業・患者双方の多くの人に知ってもらう機会提供を目的として開催された。医薬品開発におけるPPIに取り組む企業数が増加している一方で、臨床試験計画や同意説明文書に対するPPIは試験の立ち上げ期に実施することも多く、その負担等から実施に踏み切りにくいという企業側の声や、PPI実施後のフィードバックが十分ではなく、その価値が見えにくいという患者側の声など、現状の課題をうかがい知ることが出来た。また、EMA(European Medicines Agency の略、欧州医薬品庁)のペイシェント・エンゲージメント担当者より、「ペイシェント・エンゲージメントの価値について、EMAの視点から」直接共有される場面もあった。欧州では、患者参画の機会が目に見えて増えていること、そして多様化してきていることが共有され、その成果として、患者の声が議論を深めたり、何らかの変更をもたらしたこと等が示されていた。そして、ペイシェント・エンゲージメントのもたらす価値として、疾患を抱えながら生活する人の日常的側面に配慮した規制等の議論ができること、アウトプット(研究、開発、規制上の成果)が患者のためになること等が示され、引き続きの認知、理解度、信頼性の向上に努めることが重要であるとされた。今後は、リアルワールドデータを含む新しいデータ収集への対応や患者データ収集範囲の拡大、トレーニングやサポート体制の充実などが、「皆が果たすべき役割」として掲げられていた。
民間等の各種活動の活発化により、特に患者・市民側への知らせる、広める、育てる活動が連続的に、また広範囲で開催されていることが確認でき、社会全体へも徐々に影響を大きくしていくことだろう。
3.4 国内におけるPPIの近年の取り組み(まとめ)
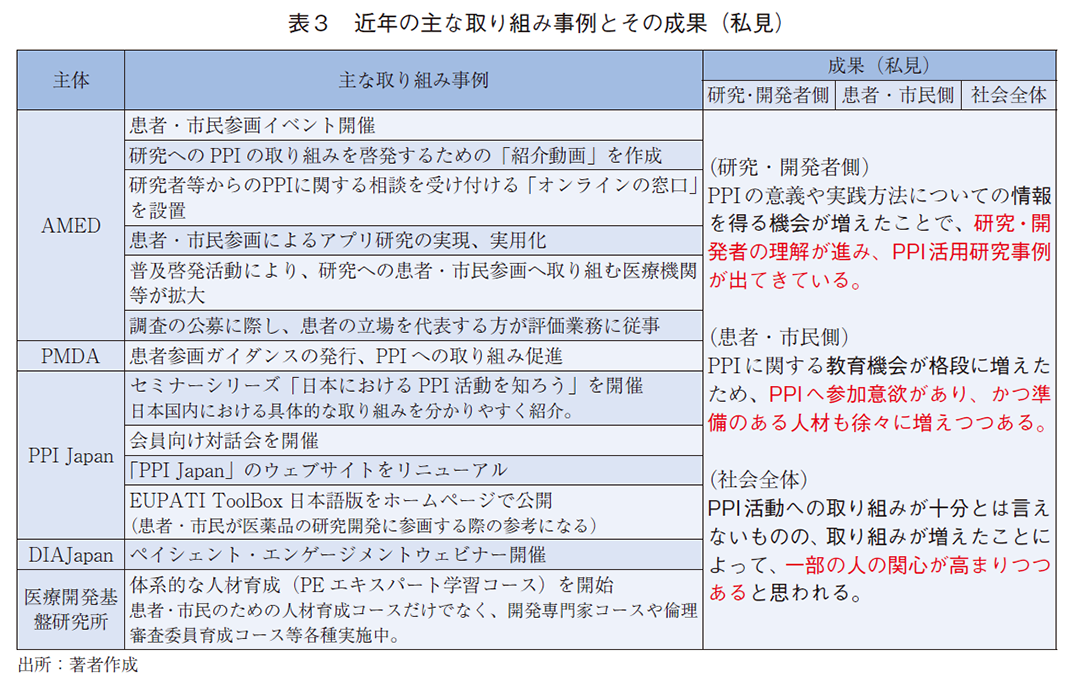
前述の通り、この数年で、非常に多くの取り組みがなされている現状を見てきた。近年の主な取り組み事例とその成果について、表3で整理している。近年のわが国の変化について、何らかの指標を用いて測れるものではないものの、列挙した主な取り組み事例をみても、取り組みそのものがこれまでなかったような新規性のあるものも多い。PPIの土台が整いつつあり、成長期であることが見て取れる。
情報を得る機会が少ないとされた研究者側では、AMEDを中心とした、知らせる、広める、育てる活動が実を結びつつある。また、情報を得る機会が少ないとされた開発者側では、本稿では触れていないが各企業による活動が活発化している17)ことに加え、PMDAによる患者参画ガイダンスが発行され、開発や上市後活動へのPPI体制づくり、風土醸成への期待が膨らむ。PPIに関する教育機会が少ないため、PPIへ参加意欲があり、かつ準備のある人材が少ないとされた患者・市民側では、産患官民による、知らせる、広める、育てる活動が活発化しており、総じて、PPI活動への関心や取り組みが不十分とされた社会全体にも、影響を与え始めている。
4 英国におけるPPIの近年の取り組み
続いて、英国でのPPIの近年の取り組みとして、英国の医薬品・医療製品規制庁であるMedicinesand Healthcare Products Regulatory Agency(以下、MHRA)が2021年5月24日に発行したProposedPatient and Public Involvement Strategy2020-25(以下、PPI戦略)18)を紹介する。
英国を始めとする欧州では、最初に患者参画が行われて以来、PPIの歴史は20年を超える。そのため、患者が規制上の決定に体系的に関与することは既に標準であった一方で、規制当局としての公式な枠組みに相当するものとしてはPPI戦略が初めてのものとなっている。そのPPI戦略では、患者や市民がMHRAの意思決定に参画できることを非常に重要と捉え、あらゆる機会において患者や市民の懸念や意見に耳を傾けたいとしている。その上で、MHRAは5つの目標を立て、いつまでに何をするかを明確に示している。その概要を図2に示し、以降でその要点を示す。
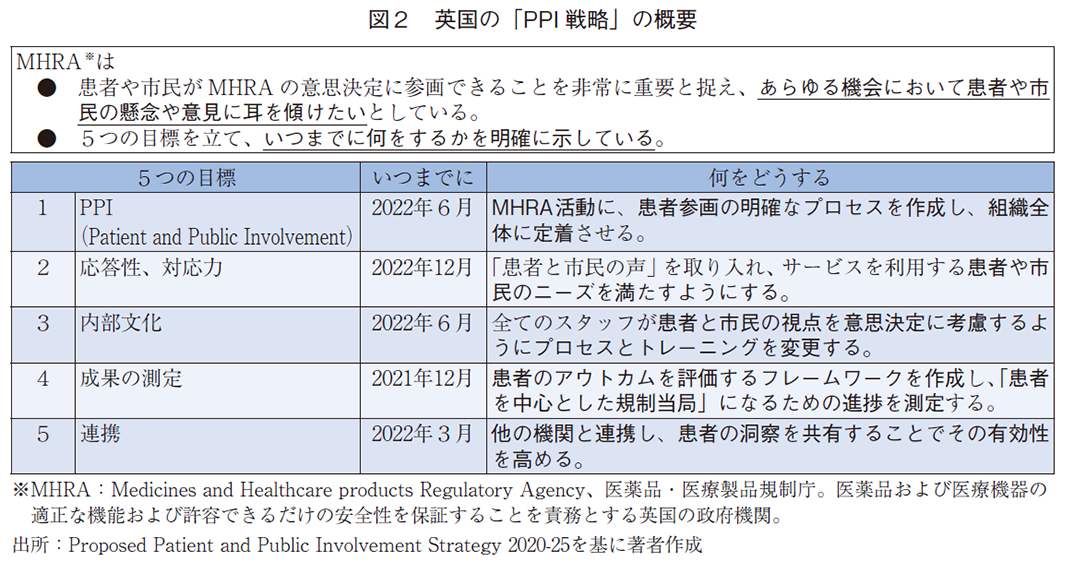
目標1:PPI
プロセス作成にあたり、期待される成果を測定することや、健康格差を念頭に置き、患者会に積極的に参加していないグループ(マイノリティ、高齢者、学習障害者、英語を母国語としない人等)でもMHRAと交流する機会を創出することで平等性を確保すること、他の規制当局と積極的に協力する意向や、患者グループに対しトレーニングやリソースを提供すること等、患者参画プロセスをどのように明確にするかが記載されている。
また、医療上の問題やその治療方法について、異なる認識を持つ可能性がある子供や若者の意見にも配慮することや、PPIの国際標準、優良事例を参考にし、取り入れる検討をするといった、今後の柔軟な姿勢も記されている。
具体的事例では、患者や市民が、より多くの情報を得て意思決定できる方法とすること、近年のCOVID-19流行後の市民の医薬品やワクチンに関するリスクの理解、リスクの最適な伝達方法に関する調査を行うこと、規制当局の意思決定プロセス、委員会、ガバナンスに患者と市民をよりシステマティックに参画させるプロセスを開発すること等が並ぶ。また、近年、一層使用が進むPROの使用を発展させ、すべての承認/許可の決定に組み込むようにすることも記載している。
患者団体への情報提供や収集という観点では、MHRAの執行委員会が患者団体協議会の活動に定期的に出席し、患者と市民の声がMHRAに伝えられる中心的なルートとすることや、MHRAの規制システム、意思決定プロセス、委員会、ガバナンスに透明性を持たせ、患者と市民の参画がどのような影響を与えたかを報告すること、意思決定プロセスの適切な時期に、コミュニケーションのコンセプトや素材について患者や市民の意見を求め、可能な限りニーズや好みに沿った形にすること、定期的(例:年2回)な公開ミーティングを導入することなどが記載されている。さらに、医薬品や医療機器について、MHRAが検討しているあるいは、患者や市民がMHRAに提起したい問題等について、患者や市民の意見を積極的に求めるとともに、MHRAの優先事項を決定する際に協力を求めていくとされる。
目標2:応答性、対応力
リスクの高い問題をより機動的かつ定期的に見直すことができるプロセスとすることや、患者団体のより一層の参画が必要な場合にフラグを立てるシステムを導入すること等、患者と市民のニーズを満たすようにサービスの設計、提供を行っていくことが記載されている。具体的事例としては、カスタマーサービスセンターの構築等が予定される。
目標3:内部文化
「私たちは、患者や市民に焦点を当て、私たちの考え方の中心に据える。(Our core focus will beon patients and public, placing them at the heartof our thinking.)」というモットーを掲げ、患者と市民が中心となって、新しいシステム、プロセス、トレーニングを開発・導入することで、内部文化の変革を行っていくとしている。
具体的事例として、入庁式の場で新入庁員に患者・市民参画について指導し、患者や市民がPPIの重要性について語ることや、MHRAスタッフの目標計画に反映させることも盛り込まれている。
目標4:成果の測定
ここでは、ビジョンを実現するために進捗、成果の測定を確実に行っていくことが明記されている。患者参画の成果を測定する際には、PPI戦略に含まれる範囲を超えた、最も広い意味での患者参加を考慮することが重要とした上で、MHRAに対する信頼と、医薬品等に対する信頼のための、3つの成果フレームワークを掲載している。
一点目は、シグナルマネジメント19)への患者の参画が増えているかどうか、二点目は、MHRAがPROを組み込むことを推奨した臨床試験プロトコルの数が増加しているかどうか、三点目は、MHRAが患者や市民から寄せられた意見を考慮しそれに基づいて行動しているか、そして、その行動が具体的かつ増加傾向にあるかどうかである。これらの達成度を測る手段としては、例えば、客観的なインタビューやアンケート調査の定期的実施と、その結果の公表、患者団体を介した患者団体とのパルスチェック実施等が挙げられている。そして、他の組織や英国外の規制当局での動向を参照し、取り入れていくことも掲げられている。
目標5:連携
患者や市民に最大の成果を還元するために、これまで以上に関係者が緊密な関係を築く連携計画を策定し、実現に向けて動くこととされ、これにより大きな価値を生み出すことができる二点に焦点を当てて取り組んでいくことが宣言されている。
一点目は、「洞察力の交換」である。ワークショップやフォーラム等、患者・市民の参画機会が増えたことで、豊富な情報等が集まっているが、それらを一つにまとめる必要があるとしている。つまり現状では、体系的な整理、活用が十分とは言えないと伺える。今後は、新しいプロジェクトにMHRA全体の情報等を集約することで、効率的かつ有効な活用を図っていく方針である。また、集約した情報等を、保健医療分野のパートナーと双方向に共有することで、患者・市民の声を最大限に活用していくとのことである。
二点目は、「患者参画の仕組み」である。これまでの患者グループ協議会を見直し、患者の代表性を高め、多様性を向上させることを掲げており、この点においても、保健医療分野のパートナーの保有する財産ともいえる情報等との連携が可能かどうかを検討していくとされる。
5.まとめ:日本におけるPPIへの課題と期待
日本のPPIは、患者参画ガイダンスの発行により、範囲を拡大しながら体制を整えつつある。また、徐々にPPIに活用し得る素材や経験、知見の蓄積もなされている。そして、患者、市民や規制当局、開発者等にとっての認知、学びの機会(多くはオンライン開催)が充実化しており、まさしく成長期であると言える。奇しくも、直近の約2年間はCOVID-19流行期であったが、オンライン化の加速によってイベントへの参加ハードルが下がる等、PPI成長が後押しされた可能性もある。そして、この成長は今後も続くことが期待される。
今後、わが国のPPIが益々の成長を遂げるためには、英国が掲げた「連携」は、参考になると考える。患者や市民、研究や開発をする製薬産業、規制当局等のステークホルダー(産患官民)の連携により、事例や経験を効率的かつ有効に活用すること、そして、患者の代表性を高め、多様性を向上させることが、PPIのさらなる成長を促すことと期待する。
6.おわりに
日本のPPIは、創薬、育薬プロセスを中心に広がり、深まりつつある。一方で、医薬品の価値の評価において、患者・市民参画は行われておらず、患者にしかわからない価値や、その重み等が十分に評価されず、見過ごされている可能性がある。
そのような状況を改善していくには、医薬品の価値の評価において、科学的な客観的評価と患者の主観的評価(患者の声も含む)の両輪に基づく検討がなされていくのが望ましいのではないだろうか。
-
1)医薬産業政策研究所「医療分野における「患者・市民参画」(Patient and Public Involvement)を考える」政策研ニュースNo.58(2019年11月)
-
2)英国National Institute for Health Research(NIHR)の助言機関「INVOLVE」によるPatient and Public Involvementの定義を参照。
-
3)AMEDホームページ、「患者・市民参画(PPI)に関する動向調査」(参照日2021/1/21)
-
4)対話のある研究_ 患者・市民参画(PPI)チーム、「研究への患者・市民参画」(参照日2021/1/21)
-
5)対話のある研究企画運営団体、「聞イテミル・考エテミル!?」(参照日2021/1/21)
-
6)学校法人順天堂(参照日2021/1/21)
-
7)アレルサーチウェブサイト(参照日2021/1/21)
-
8)順天堂大学医学部附属順天堂医院臨床研究・治験センター(参照日2021/1/21)
-
9)感染症研究開発ELSIプログラム 課題評価委員会(参照日:2022/2/2)
-
10)AMED ホームページ、難治性疾患実用化研究事業 課題評価委員一覧(参照日:2022/2/2)
-
11)PMDA患者参画検討ワーキンググループ、「独立行政法人医薬品医療機器総合機構 患者参画ガイダンス」(参照日2021/1/21)
-
12)医療・医薬品の開発に関心を寄せる患者・市民とアカデミア・製薬業界関係者が共に協議し、医療・医薬品開発に関する考え方やそのプロセス、また倫理性、透明性の高い関係者間の協業のあり方などに関する情報発信をするためのプラットフォームとして設立された。
-
13)European Patients' Academy on Therapeutic Innovation(参考:https://eupati.eu/about-us/)、欧州で官民患のパートナーシップのもとに発展してきたオランダを起点とする非営利財団。提供する教材やトレーニングは、患者・市民が医薬品の研究開発に参画する際の参考になるように開発され、欧州で広く用いられている。
-
14)PPI Japan、「EUPATI Toolbox(日本語・英語)」(参照日2021/1/21)
-
15)一般社団法人 医療開発基盤研究所(参照日2021/1/21)
-
16)一般社団法人 ディー・アイ・エー・ジャパン(参照日2021/1/21)
-
17)DIA ペイシェント・エンゲージメントウェビナー(2021年12月)でも、アステラス製薬やファイザーR&D 合同会社のPPI 取り組みによる価値と展望が共有されている。
-
18)
-
19)医薬品の潜在的な新しい安全性リスクを積極的かつ適時に特定するための重要なプロセスのこと。

