Opinion 日本と欧米の抗菌薬開発の状況と課題
日本製薬工業協会 国際委員会 湯淺 晃
医薬産業政策研究所 主任研究員 吉田昌生
日本製薬工業協会 国際委員会 俵木保典
2019年に発生した新型コロナウイルス感染症(COVID-19)1)のパンデミックによって、人々の感染症に対する意識は大きく変化したと言っても過言ではない。新型コロナウイルス感染症はSARSコロナウイルス2(SARS-CoV-2)がヒトに感染することによって発症するが2)、感染症はウイルス以外にも多様な微生物に感染することによって引き起こされる3)。感染症治療薬の中でも細菌感染症の治療を目的として用いられる抗菌薬(本稿では全身に作用する抗生物質、合成抗菌薬および抗菌作用を主目的として使用する医薬品を“抗菌薬”とする4))に関しては、特にその開発数の鈍化が近年になり国内外で議論されており、日本でも重要な課題であると認識されつつある。しかしながら、日本の抗菌薬の開発状況を広く調査した新しい報告は少ないのが現状である。
そこで本稿では日本の抗菌薬開発に関する状況を広く把握するために、1)過去20年間における日本の抗菌薬の承認数とその割合の推移およびドラッグ・ラグの状況、2)過去10年間に海外で承認された新規抗菌薬の日本における開発状況、3)日本と欧米における新規抗菌薬の開発状況の3点について調査し報告する。そして抗菌薬開発に関する課題も整理し提示したい。
1. 緒言
1-1. 感染症とAMR
感染症とは病原微生物が体に侵入して症状が出る疾患であり、病原微生物は大きさや構造によって細菌、ウイルス、真菌、寄生虫などに分類される3)。AMR(Antimicrobial Resistance)とは、これらの病原微生物を退治するために用いられる医薬品が効かなくなること、つまり耐性を獲得することを意味する5)。既存の抗菌薬に対する薬剤耐性率が上昇すると臨床効果の低下や治療が困難になる感染症の種類が増加することにつながる。
AMRは世界的に重要な公衆衛生上の危機であり、2016年には毎年世界で70万人がAMRによって死亡していると推計された6)。当推計による70万人にはヒト免疫不全ウイルス、マラリア等の細菌以外のAMRに起因する死亡者数も含まれているが、2022年に公表された論文7)では、2019年における細菌のAMRが直接的な原因の死亡者数は127万人であったと推定された。日本のAMRに起因する年間の全死亡者数は不明であるが、2020年に公表された論文ではメチシリン耐性黄色ブドウ球菌とフルオロキノロン耐性大腸菌による血流感染症に起因した死亡者数は年間8,000人を超えると推定された8)。
臨床に対してのみならずAMRが医療経済におよぼす影響についても報告されている。経済協力開発機構のレポートでは、AMRは分析対象国(33カ国)に合計で35億USドル(年間)の医療コストを発生させていると推定された9)。さらにEU/EEA(European Economic Area)諸国を対象とした2007年のデータと当レポートを比較すると10年余りでEU/EEA諸国の医療予算に与えるAMRの影響は60%増加したと推定された9)。日本からはAMRの上昇もしくは減少が国内の医療経済に及ぼす影響に関する研究結果が報告され、グラム陰性菌(分離頻度の高い主要3菌種)の薬剤耐性率を現在より50%減少させることにより、25億円から64億円(年間)の入院医療費が削減されると報告された10)。
このような世界的な危機感から、AMRの脅威に対処するための国際的な取り組みが進められている。2015年に世界保健機関(WHO)は「Global action plan on antimicrobial resistance」を公表し、世界規模で調和のとれた即時の行動を呼びかけている11)。日本政府は2016年に「薬剤耐性(AMR)対策アクションプラン」12)を発表し、その実行に取り組んできた。当アクションプランは対象期間が2020年までであったことから早期の改訂が期待される。
1-2. 国内外の抗菌薬開発に関する背景
AMRに対する脅威と対策の必要性は認識されつつあるにもかかわらず、新規抗菌薬の開発数の鈍化は世界的な課題である13)。
米国では2010年に「The 10x’20 Initiative14)」と称する取り組みが開始され、産学官一体となり2020年までに10品の新規抗菌薬を創出することを目標に掲げていた。1980年以降の新規有効成分(New Molecular Entity:NME)含有かつ全身に作用する抗菌薬のFDAにおける承認数の推移を示した2021年の論文によると、1980年から2009年までは減少の一途をたどっていたが、それらの期間と2010年から2019年の期間を比較すると十分ではないながらも増加していた15)。
一方で、2010年から2019年に日本で承認された抗菌薬の数は欧米と比較しても少なく、承認数は調査対象14か国の中でワースト2位タイであった16)。また、国内未承認薬の状況を調査した報告17)では、2020年12月末時点における国内未承認薬265品目を薬効分類別に整理したところ、その数は、抗悪性腫瘍剤52品(20%)に次いで消化管及び代謝用剤32品(12%)と全身性抗感染症薬32品(12%)が2位タイであった。
このように承認数が少ない理由の一つとして抗菌薬事業をとりまく環境の厳しさが原因の一つとして考えられる。その詳細は本稿の後半で考察していきたい。
2. 調査1(日本の抗菌薬の承認数とその割合の推移およびドラッグ・ラグの状況)
2-1. 調査1の方法
1990年から2019年に日本で承認されたNMEで薬効分類番号18)61(抗生物質製剤)と62(化学療法剤)に該当したものを対象とし、承認数と同期間の全てのNME(医薬品)の承認数に占める割合を調査した。検索には「新医薬品の承認品目一覧19)」、「薬務広報20)」、「明日の新薬21)」を使用した。細菌感染症に対する全身性の抗菌薬を調査の対象とするため、薬効分類番号617(主としてカビに作用するもの)、625(抗ウイルス剤)に該当するものおよび外用薬は対象から除外した。また、ドラッグ・ラグは、日米欧で最も早い承認日と日本の承認日との差として算出した。
2-2. 調査1の結果
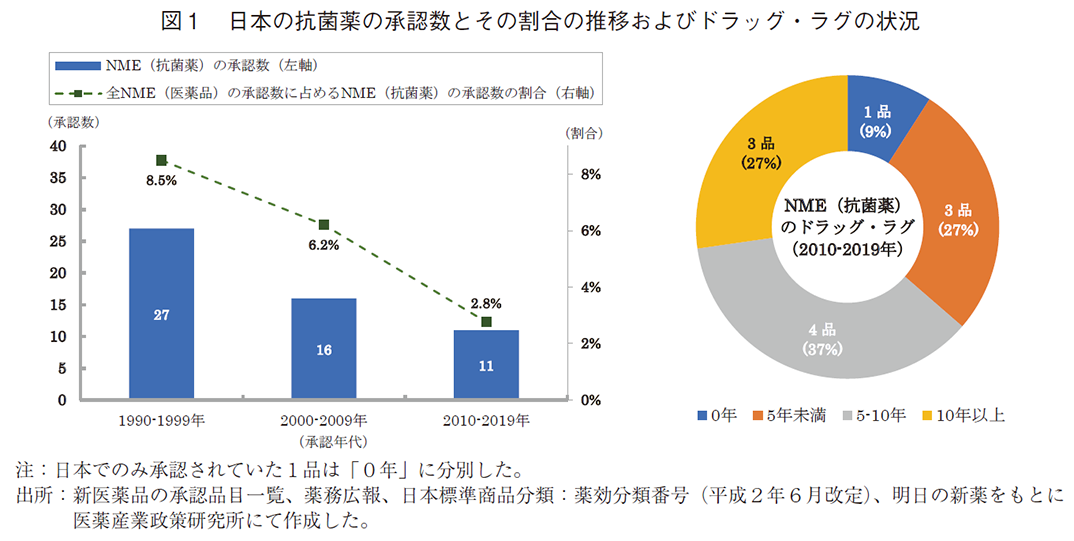
結果を図1に示す。日本のNME(抗菌薬)の承認数を1990年から1999年、2000年から2009年、2010年から2019年と年代ごとに3つに分別したところ、それぞれ、27品、16品、11品と減少していた。加えて、NME(抗菌薬)の全NME(医薬品)に占める割合についても、それぞれ8.5%、6.2%、2.8%と承認数と同様に減少していた(左図)。また、2010年から2019年に承認された11品について日米欧の承認時期を比較したところ、欧米で承認されてから遅れること5年以上のラグ(遅延)を有するものが7品(64%)あったことが確認された。(右図)。なお、対象年の括りを同数にするために2019年までの結果をとりまとめたが、2020年は対象となるものは承認されていなかったことを確認した。
3. 調査2(海外で承認された新規抗菌薬の日本における開発状況)
3-1. 調査2の方法
先行研究16)で特定された抗菌薬を調査の対象とし、それらの2021年12月時点の日本における開発状況を明日の新薬21)に掲載されている内容を用いて調査した。
先行研究で使用された新規抗菌薬の定義は次のとおりであった。1)WHOの解剖治療化学分類(ATC分類)でJ01(全身用抗菌薬)に該当するNMEであるもの、2)ジェネリック医薬品、外用薬、ATC分類で他の分類がされているもの、NMEを含まない配合剤、のいずれにも該当しないもの、3)米国食品医薬品局(FDA)、欧州医薬品庁(EMA)、カナダ保健省、厚生労働省のいずれかの最も早い承認日が2010年1月1日から2019年12月31日の期間であったもの。NMEに対応する用語としてEMAではNew Active Substance(NAS)を使用しているが本稿ではNMEを統一して使用する。
なお、先行研究ではJ01には該当しないながらもClostridioides difficile感染症治療薬であるBezlotoxumab(J06)とFidaxomicin(A07)は対象に含めていたため当調査でも同様に扱った。
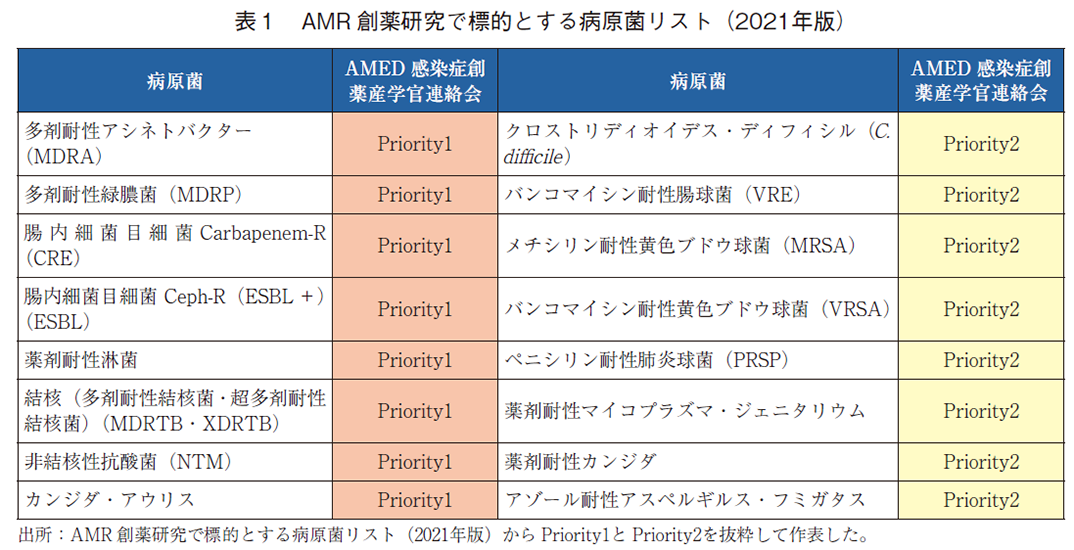
また、抜け漏れがないように同期間(2010年1月から2021年12月)を対象にFDA22)、EMA23)、独立行政法人医薬品医療機器総合機構(PMDA)19)のウェブサイトを追加で検索した。さらに、対象となった抗菌薬の抗菌スペクトルを調査し、国立研究開発法人日本医療研究開発機構(AMED)が取りまとめた「AMR創薬研究で標的とする病原菌リスト(2021年版)」24)(AMEDリスト)においてAMED感染症創薬産学官連絡会から示されたPriority1、Priority2に調査の対象とした抗菌薬を分別し、該当しないものは「該当しない」というカテゴリーを作成し分別した。AMEDリストを抜粋したものを表1に示す。
このような新規抗菌薬の開発を優先すべき病原微生物のリスト(Priority Pathogens List)はWHO25)や米国疾病管理センター(CDC)26)からも発出されているが、AMEDリストは作成にあたり、より日本の臨床現場での課題を考慮した内容となっている。また、AMEDリストでは、Priority1がよりAMR薬の創薬研究の開発優先順位が高いと考えられた病原菌であり、複数のPriorityに該当する病原菌に抗菌スペクトルを有する抗菌薬は上位のPriorityに分類した。国内未承認品が有すると推定した抗菌スペクトルは海外の承認情報等によって判断したため、今後承認を取得する適応菌種とは異なる可能性があることを留意されたい。
3-2. 調査2の結果
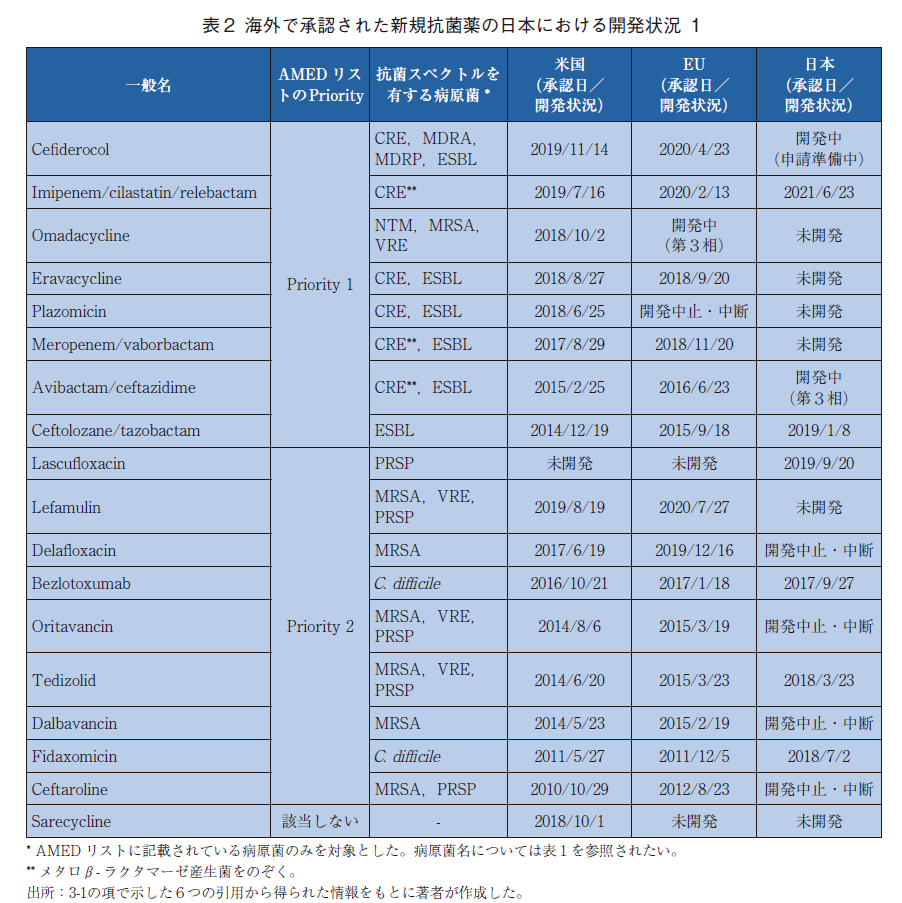
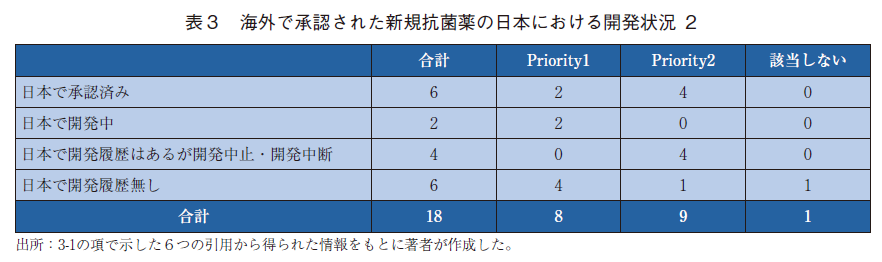
結果を表2と表3に示す。FDA、EMA、PMDAのウェブサイトを追加で検索した結果、先行研究と同様に18品を調査の対象とした。
18品のうち、2021年12月現在日本で承認済みのものは6品であり、2品は現在日本で開発中であった。日本で開発履歴は確認されたものの開発中断もしくは開発中止されたものは4品、日本で開発履歴が確認されなかったものは6品であった。開発中断もしくは開発中止された4品の中断もしくは中止の理由は公開情報からは確認することができなかった。日本で承認済みの6品と開発中の2品を除く日本で未開発の10品のうち、Priority1と2に該当していたものはそれぞれ4品と5品の計9品であった。
4. 調査3(日本と欧米における新規抗菌薬の開発状況)
4-1. 調査3の方法
国内外で現在開発中の抗菌薬を次の3つのリストまたはウェブサイトを用いて特定した。1)Antibiotics Currently in Global Clinical Development27)(全身に作用する低分子化合物でこれまでに承認されていない成分を少なくとも1つ含み、重症な感染症に対して用いられる可能性がある抗微生物薬のリスト)、2)Nontraditional Products for Bacterial Infections in Clinical Development28)(全身に作用する低分子化合物以外のモダリティ(抗体や核酸医薬品等)でこれまでに承認されていない成分を少なくとも1つ含む重症な感染症に対して用いられる可能性がある抗微生物作用を有する開発品のリスト)、3)明日の新薬21)。
明日の新薬の検索定義はNMEで薬効分類番号61(抗生物質製剤)と62(化学療法剤)に該当するものとし、細菌感染症に対する全身に作用するものを調査の対象とするため、薬効分類番号617(主としてカビに作用するもの)と625(抗ウイルス剤)に該当するものおよび外用薬は対象から除外した。なお、明日の新薬を用いた検索は2021年12月に実施したため、当調査に含まれる情報は2021年12月時点で当該ウェブサイトに掲載されていた内容であることを留意されたい。
そして、3つのリストを統合した後に次に該当するものは除外した。1)統合した際に重複していたもの、2)調査2で結果を示した「海外で承認された新規抗菌薬の日本における開発状況」に含まれていたものおよび含まれてはいなかったがすでに日本で承認済みのもの、3)主として真菌やウイルスに作用するもの、4)日米欧のいずれかで開発されていないもの。
さらに、開発品それぞれの開発状況および抗菌スペクトルを調査した。調査2と同様の方法で分別したが、調査3は開発中のものが対象であるため、「該当しない」に「不明」を加えた「該当しない/不明」という分類を作成した。なお、開発品が有すると判断した抗菌スペクトルは開発段階で得られる情報(基礎研究の結果を含む)で判断したため、今後承認を取得する適応菌種とは異なる可能性があることを留意されたい。
4-2. 調査3の結果
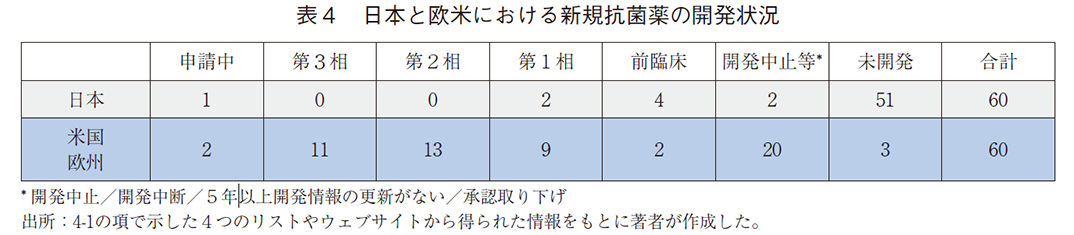
結果を表4に示す。方法に従い60の開発品を特定した。60の開発品のうち51品が日本での開発履歴が認められなかった。すでに開発中止等(開発中断/開発中止/承認取り下げ/5年以上開発情報の更新がない)に該当した2品をのぞく日本で開発履歴が認められた7品のうち、日本で申請中のものが1品(Solithromycin)特定されたが、2019年4月に日本で承認申請をした後の公開情報のステータスは更新されておらず、現在の状況は不明であった。なお、当品は欧米では申請後に中止や中断がされていた。また、同7品のうち日本で第1相試験を実施中のものが2品(Gepotidacin、Nacubactam)特定され、前者は米国において第3相試験を実施中であったが、後者は米国での開発は中止されていた。
60品のうち、欧米で申請中、第3相試験を実施中のものはそれぞれ2品と11品であった。その13品の日本の開発状況は、未開発、開発中止等、第1相試験実施中がそれぞれ、11品、1品、1品であった。
日本で開発履歴が確認できなかった51品の欧米における開発状況を表5に示す。17品は欧米においても開発中止等に該当した。残りの34品のうち24品は米国もしくは欧州で申請中(1品)、第3相試験実施中(10品)、第2相試験実施中(13品)に該当した。申請中の1品と第3相試験を実施中の10品の抗菌スペクトルを確認したところ、いずれもAMEDリストに該当する可能性があり、内訳はPriority1とPriority2がそれぞれ5品と6品であった。

5. 調査結果のまとめと抗菌薬開発に関する課題
本稿では日本の抗菌薬の承認数とその割合の推移およびドラッグ・ラグの状況(調査1)、海外で承認された新規抗菌薬の日本における開発状況(調査2)、日本と欧米の新規抗菌薬の開発状況(調査3)の調査結果を示した。
調査1では、日本の抗菌薬の承認数は経時的に減少しており、承認されたものについても欧米で承認されてから5年以上のラグ(遅延)を有するものが6割以上にのぼることを示した。調査2では、欧米のいずれかで使用可能な新規抗菌薬18品のうち、日本で使用可能な抗菌薬は2021年12月現在で6品のみであることを示した。ドラッグ・ラグには2つの側面があり、1つは他国では承認されているのに日本では承認されていない「未承認薬」、もう1つは日本においても承認されているものの承認までに要した期間が他国よりも長い「ラグ(遅延)」である17)。調査1と2の結果から日本における抗菌薬開発ではどちらのラグも存在することを示した。調査3では日米欧のすべてで承認されていない開発中のもの60品のうち、欧米で申請中、第3相試験を実施中のものはそれぞれ2品と11品であるが、日本では申請中が1品、第3相試験を実施中のものは確認できなかったことを示した。
新規抗菌薬の開発が困難な理由についてはこれまでにも多くの議論がなされてきた。新規作用機序を有する抗菌薬の創薬の難しさやAMR感染症症例を臨床試験に組み入れることの難しさなど多くの課題が挙げられており、それぞれの詳細は先行の多くの総説等が詳しいので参照されたい29、30、31、32)。本稿ではそれらの課題の中でも「抗菌薬の収益性の低さ」に焦点を当てて議論をすすめていきたい。その理由として、日本における抗菌薬の開発が欧米と比べて遅れている原因として重要な点だと考えられるからである。
通常抗菌薬、特に広域な抗菌スペクトルを有するものやAMRに効果が期待できるものは他の疾患領域の医薬品と比較してもより厳格な適正使用の推進が必要とされる。その理由の一つとして、抗菌薬の不適切な使用はAMRの増加を促す要因の一つとして知られていることが挙げられる33)。このようなAMRが発生・増加するメカニズムを踏まえると、AMR対策はAntimicrobial Stewardship(AS)という抗菌薬適正使用支援の概念34)を取り入れ、当該抗菌薬の投与対象患者や使用量・使用期間を適正に管理しつつ最大限の治療効果をもたらすことが肝要となる。つまり、製薬企業が広域スペクトルを有する新規抗菌薬の研究開発に成功したとしても、AMRに効果が期待できる抗菌薬はAMR感染症のためにリザーブしておくことが必要となり「使用量あるいは販売量」に応じた収益を期待しにくい状況にある35)。
抗菌薬の開発・販売を事業として成立させるためにはピーク時の全世界における年間販売額として19億USドルが必要であるという推定が2021年に報告された35)。ただ、2000年以降に発売された抗菌薬のうちピーク時の世界の販売額が10億USドルを超えたのは、Zyvox(2015年の販売額が13億5300万USドル;2000年4月発売35))、Cubicin(2016年の販売額が13億1200万USドル:2003年11月発売35))の2品のみであることからも19億USドルのピーク時の販売額を達成することは容易ではないことがわかる。
調査3で特定した60の開発品のうち51品(85%、欧米ですでに開発が中止もしくは中断されている20品を含む)が日本における開発履歴を確認することができず、この51品の開発企業を確認したところ、その大部分が日本で直接事業を展開していない、いわゆる「メガ・ファーマ」ではないバイオベンチャーもしくはそれに準ずる企業によって開発がすすめられていた。この点は過去の国内未承認薬に関する分析においても指摘しているが17)、このような開発品を海外の開発企業が直接日本で開発を開始する、または日本で事業展開する企業が日本に導入し開発を開始するためには、日本における抗菌薬事業の予見性を高める仕組みが求められる。
抗菌薬事業の予見性を高める経済支援の仕組みとしては、承認を取得するまでの「プッシュ型インセンティブ」と承認取得後に支援する「プル型インセンティブ」が代表的なものである35)。海外にはプッシュ型インセンティブに必要な資金を集め、抗菌薬の研究開発を促進するための活動に従事している多くの組織があり、主に大学研究機関やバイオベンチャーの抗菌薬研究および開発の支援が行われている。プッシュ型インセンティブの活動は日本よりも海外の方が活発であり、このことが日本と欧米の抗菌薬の開発数の差に少なからず影響を与えている可能性は考えられる。ただ、2020年7月には日本の製薬企業を含む20社以上の大手製薬企業によって「AMRアクションファンド」36)が設立され、その設立目的は2030年までに2~4品の新規抗菌薬を製品化し患者さんに届けることである。当ファンドは国際製薬団体連合会(IFPMA)のイニシアチブであり、日本製薬工業協会はIFPMA加盟団体として当ファンドの設立に寄与している。今後日本の製薬企業やバイオベンチャーも当ファンドを利用し、日本における抗菌薬の研究開発を推進することが期待される。
一方、プル型インセンティブの金額の規模についてはアジア・アフリカ医療イノベーションコンソーシアムのAMR部会が取りまとめた提言37)において言及されている。販売額による収益と切り離した定額を継続的に支払う制度である定期定額購買制度(Subscription Model;SM)」では、日本国内分として必要な金額は1品あたり年間20~80億円程度であると提言されており、支払い期間は上市後10年間継続することを想定している。また、別の方法として製造販売承認取得報償付与指定制度(Market Entry Reward;MER)がある。この制度では、製薬企業は抗菌薬の販売量に応じた収益を得られるが、それとは別に抗菌薬の研究開発の投資に対して一定の金額が保証される仕組みであり、その規模は1品あたり100億~300億円が必要だと提言されている。当金額はいずれも日本国内分として推計されたものであり、世界全体としては、SMで31~42億USドル(10年間の合計)、MERで16~22億USドル(1回払い)が必要であると前述の論文35)では報告されている。また、米国や英国ではそれぞれプル型インセンティブを含む抗菌薬開発を支援する法案の提出38、39)もしくは試行的な導入40)が開始されており、自国においてプル型インセンティブとして必要な金額に関する議論が政府も参画しすでに開始されている。米国と英国の取り組み状況を表6に示す。

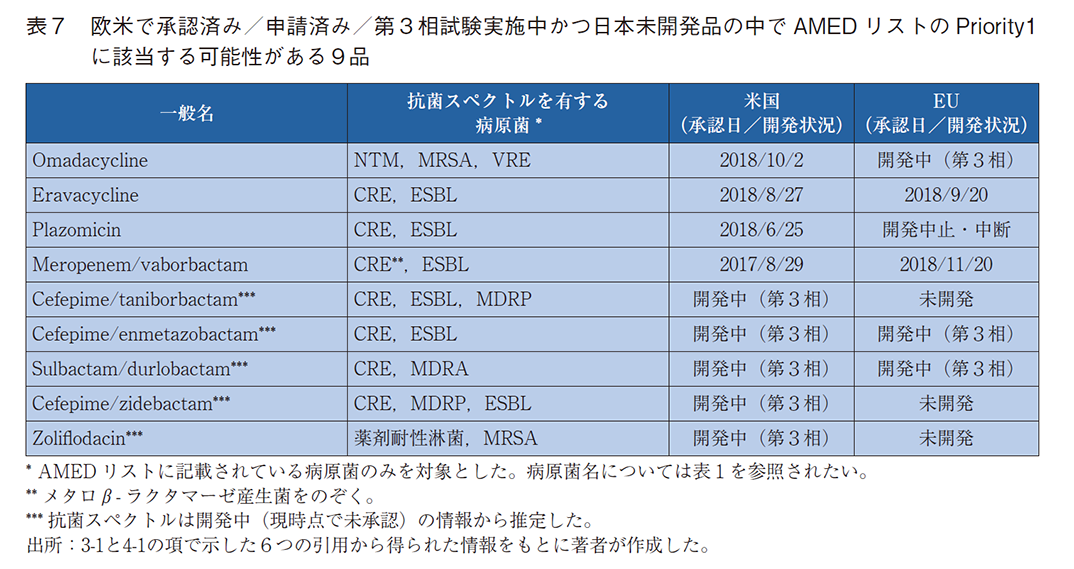
今後日本で開発される抗菌薬数を本稿の調査結果から推定することは困難であるが、少なくとも、調査2で示した欧米ですでに承認されていながら日本では開発されておらずかつAMEDリストのPriority1に該当する「4品」および調査3で示した欧米で申請中/第3相試験を実施中であるにもかかわらず、日本では未開発かつAMEDリストのPriority1に該当する可能性がある「5品」の計「9品」は、公衆衛生や安全保障の観点から日本で開発を開始することが急務であると考えられる。9品の詳細を表7に示す。さらに、AMEDリストには「AMRの領域は常にブレークスルーが求められるので、新たな視点からのアプローチはPriorityに関係なく支援していくこともAMR研究にとって必要と考える」と付記されていることからも、Priorityが高い病原菌に作用する抗菌薬に対する支援はもちろんのこと、従来にはない作用機序を有するなど革新的な抗菌薬に対する開発支援はPriorityに関わらず求められる。
なお、本稿で示した調査結果には次のリミテーションが含まれる。1点目として、国内外の開発情報は、公開情報そして公開情報を引用している明日の新薬を用いて調査したが、企業が公には情報を公開していない開発情報や開発品がある可能性がある。その結果として調査3において、前臨床試験や第1相試験を実施中のものよりも第2相試験や第3相試験を実施中のものが多くカウントされている。2点目として、本稿では日米欧における抗菌薬の開発状況を調査することが目的であるため、中国、インド、オーストラリア等でのみ承認されていたものおよび開発中であるものは調査の対象から除外した。3点目として、開発品がAMR治療薬やAMEDリストに該当するかどうかは開発段階の情報(基礎研究の結果を含む)で推定しており、仮に日本でそれらが開発され承認された際には適応症や適応菌種が異なる可能性がある。
6. おわりに
AMR感染症治療薬の開発は特に日本にとって喫緊の課題であり、抗菌薬の開発を喚起するための経済的なインセンティブの必要性に対する認識は日本でも広がりつつある。経済的なインセンティブには財源が必要となるが、その金額を感染症がもたらす経済的なインパクトや損害と比較した場合、前者の方が少額であることは明らかであり、事前に投資をして対策を講じることの重要性をCOVID-19によって我々は深く認識させられた。AMR感染症治療薬を含む抗菌薬開発にかかる費用や経済的なインセンティブに必要な財源は「コストではなく国の安全保障に関わる投資」として考える視点が求められる。一方で、AMRの中でも治療薬の開発を優先すべき病原菌は各国間で若干の差異があることから、日本も自国に合わせた備えをしておく必要がある。
日本においてもこのような経済的インセンティブ制度が導入されることで新規抗菌薬の研究開発・上市が促進され、サイレントパンデミックと呼ばれるAMRに対する備えが進むことを期待する。
7. 謝辞
本稿の執筆にあたり、日本製薬工業協会国際委員会の有吉 祐亮氏と山野 佳則氏から助言を頂戴した。ご協力に深謝いたします。
(2022年3月7日追記:調査2の結果を修正した。)
-
1)
-
2)
-
3)
-
4)厚生労働省健康局結核感染症課. 抗微生物薬適正使用の手引き 第二版. 2019年12月5日
-
5)
-
6)
-
7)Murray CJL, Ikuta KS, Sharara F, et al. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. The Lancet. 2022. DOI: 10.1016/s0140-6736(21)02724-0
-
8)Tsuzuki S, Matsunaga N, Yahara K, et al. National trend of blood-stream infection attributable deaths caused by Staphylococcus aureus and Escherichia coli in Japan. J Infect Chemother. 2020;26(4):367- 371.
-
9)
-
10)Matsumoto T, Yuasa A, et al. Estimating the Economic and Clinical Value of Reducing Antimicrobial Resistance to Three Gram-negative Pathogens in Japan. Journal of Health Economics and Outcomes Research. 2021; 8: 64-75.
-
11)
-
12)
-
13)Vickers RJ, Bassetti M, Clancy CJ, et al. Combating resistance while maintaining innovation: the future of antimicrobial stewardship. Future Microbiol. 2019;14(15):1331-1341.
-
14)Infectious Diseases Society of A. The 10 x '20 Initiative: pursuing a global commitment to develop 10 new antibacterial drugs by 2020. Clin Infect Dis. 2010; 50: 1081-3.
-
15)Dheman N, Mahoney N, Cox EM, et al. An Analysis of Antibacterial Drug Development Trends in the United States,1980-2019. Clin Infect Dis. 2021; 73: e4444-e50.
-
16)Outterson K, Orubu ESF, Rex J, et al. Patient access in fourteen high-income countries to new antibacterials approved by the FDA, EMA, PMDA, or Health Canada, 2010-2020. Clin Infect Dis. 2021.
-
17)医薬産業政策研究所.「ドラッグ・ラグ:国内未承認薬の状況とその特徴」. 政策研ニュースNo.63(2021年7月)
-
18)
-
19)
-
20)
-
21)
-
22)
-
23)
-
24)
-
25)WHO. Global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics. Prioritization of Pathogens to Guide Discovery, Research and Development of New Antibiotics for Drug Resistant Bacterial Infections, Including Tuberculosis. 2017.
-
26)CDC, ANTIBIOTIC RESISTANCE THREATS in the United States. 2019.
-
27)
-
28)
-
29)舘田一博. Ⅲ . 抗菌薬の諸問題. 1.抗菌薬開発停滞の打破へ向けて. 日本内科学会雑誌. 2013; 102.
-
30)松本哲哉. 教育講演. 9.新規抗菌薬の開発. 日本内科学会雑誌. 2014; 103.
-
31)八木澤守正. AMR 対策における抗菌薬の現状と今後. 医療関連感染. 2019; 12.
-
32)平井敬二. 日本発の抗菌薬開発の歴史と今後の展望について. 日本化学療法学会雑誌. 2020; 68.
-
33)Altarac D, Gutch M, Mueller J, et al. Challenges and opportunities in the discovery, development, and commercialization of pathogen-targeted antibiotics. Drug Discov Today. 2021; 26: 2084-89.
-
34)Barlam TF, Cosgrove SE, Abbo LM, et al. Implementing an Antibiotic Stewardship Program: Guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America, Clinical Infectious Diseases, Volume 62, Issue 10, 15 May 2016.
-
35)Outterson K. Estimating The Appropriate Size Of Global Pull Incentives For Antibacterial Medicines. Health Affairs. 2021; 40: 1758-65.
-
36)
-
37)
-
38)
-
39)
-
40)

