目で見る製薬産業 日米欧の新薬承認状況と審査期間の比較 COVID-19ワクチンの事例も踏まえた日本の課題
医薬産業政策研究所 主任研究員 吉田昌生
医薬産業政策研究所では、日本、米国、及び欧州の医薬品の承認情報及び審査期間に関して、独立行政法人医薬品医療機器総合機構(PMDA)、U.S. Food and Drug Administration(FDA)、及びEuropean Medicines Agency(EMA)がそれぞれホームページ等で公表している情報をもとに、継続的に収集、分析している1)。政策研ニュース第61号2)では2019年の承認実績を中心に日米欧の新薬承認状況と審査期間の比較を、政策研ニュース第62号3)では2020年に日本で承認された医薬品情報に関する分析結果を、第63号4)では本継続調査を基盤とし、ドラッグ・ラグの現状を報告した。今回のニュースでは、2020年に日米欧で承認された新薬の承認品目数、審査期間等に関して調査した。併せて、2020年より猛威を振るっているCOVID-19に対するワクチンの認可について、日米欧にて用いられた制度および審査期間情報を調査し、日本における緊急時の医薬品承認制度の課題を提起する。
調査方法
PMDA、FDA及びEMAのそれぞれのホームページに公表されている情報をもとに、標準的な統計解析ソフトStata/IC 14.0 for Windows(Stata Corp LP, College Station, TX, USA)を使用し、審査期間は承認申請日から承認日までの期間として算出した。期間が著しく長い品目や特例により短い品目が存在することから、主たる基本統計量は中央値とし、サンプル数、平均値、標準偏差を併記した。
日本は、政策研ニュース第62号と同様、対象はPMDAホームページの「新医薬品の承認品目一覧」5)に掲載されている医薬品とし、品目数は審査報告書ごとにカウントすることを基本に、同一成分の品目を複数企業が同時申請した場合や併用薬物療法にて複数成分が承認された場合は1品目として集計した。New Molecular Entity(NME)の集計は、申請区分が新有効成分含有医薬品に該当するものを対象とした。
米国は、FDA Center for Drug Evaluation Research(CDER)が承認した「CDER Drug and Biologic Approvals for Calendar Year」6)に掲載されているNew Drug Application(NDA)及びBiologic License Application(BLA)に該当する医薬品を対象とした。NMEの集計は、「New Molecular Entity(NME)Drug & Original BLA Calendar Year Approvals」に掲載されている医薬品を対象とした。
欧州は、EMAが中央審査方式にて承認し、「European Medicines Agency Annual Reports」7)に掲載された医薬品を対象とした。NMEの集計は、「New active substance」に分類されている医薬品を対象とした。
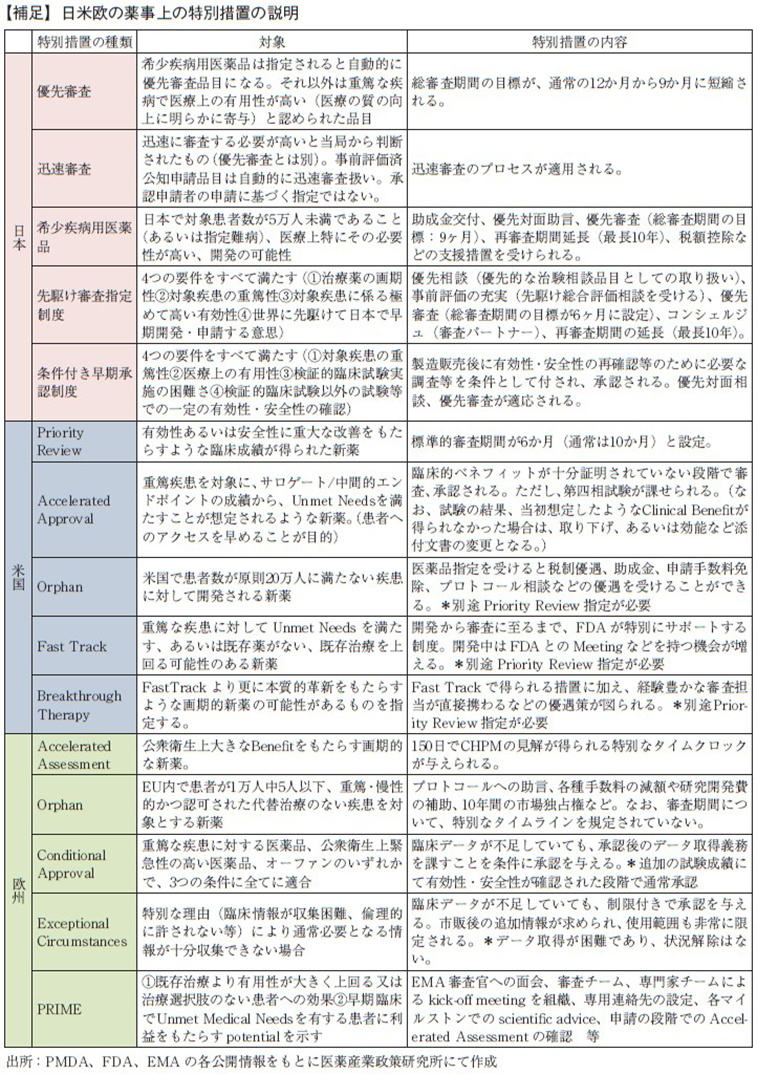
また、薬事上の特別措置として、日本では優先審査、迅速審査、希少疾病用医薬品、先駆け審査指定制度、条件付き早期承認制度を、米国ではPriority Review、Accelerated Approval、Orphan、Fast Track、Breakthrough Therapyを、欧州ではAccelerated Assessment、Orphan、Conditional Approval、Exceptional Circumstances、Priority Medicine(PRIME)を対象に集計した。各薬事上の特別措置の内容は巻末の補足にまとめた。
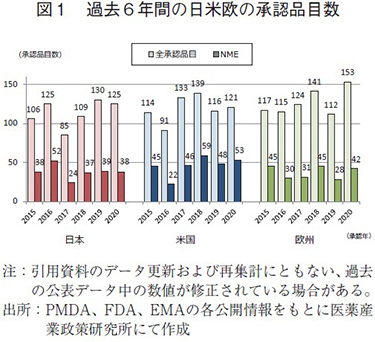
新医薬品の承認品目数の日米欧比較
過去6年間(2015~2020年)の日米欧で承認された新医薬品の承認品目数を図1に示した。日本で2020年に承認された新医薬品の品目数は125品目、NMEは38品目であり、2019年と比較して、それぞれ5品目、1品目減少したものの、過去6年間で2番目の承認数であった。それに対し、米国では承認品目数が121品目、NMEが53品目と、2019年よりいずれも増加した。NMEについては弊所が記録している2000年以降で2018年に次ぐ過去2番目に多い承認数であった。欧州は2020年の承認品目数が153品目、NMEが42品目であり、2019年と比較して大幅に増加しており、承認品目数については過去6年間で最多であった。
薬事上の特別措置を受けた承認品目数(NME)
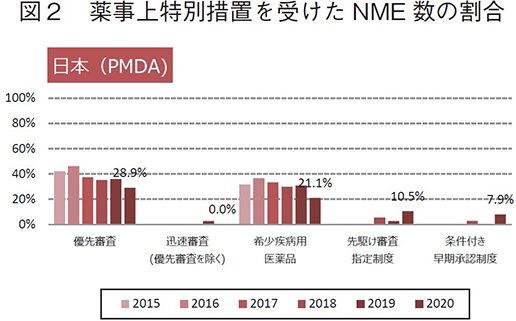
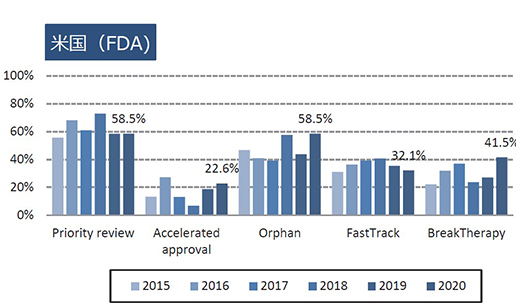
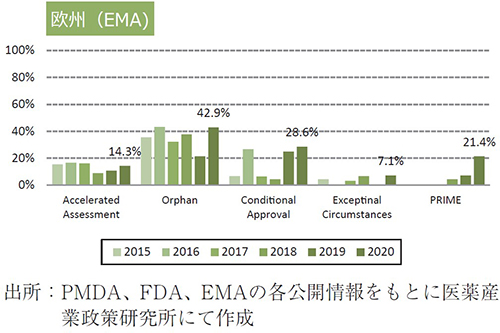
日米欧で過去6年間(2015~2020年)に承認されたNMEのうち、各地域の薬事上の特別措置を受けた品目数とその割合について調査した(図2)。
2020年に日本で承認されたNME 38品目中、優先審査(希少疾病用医薬品を含む)は11品目(28.9%)、迅速審査(優先審査を除く)は0品目、希少疾病用医薬品は8品目(21.1%)、先駆け審査指定制度の指定品目は4品目(10.5%)、条件付き早期承認制度の適用対象品目は3品目(7.9%)であった。優先審査、希少疾病用医薬品のNME数の割合は、2016年以降、減少傾向であった。一方、先駆け審査指定制度、条件付き早期承認制度の対象として2020年に承認されたNME数とその割合は、過去最高であった。
米国では、2020年承認されたNME 53品目中、Accelerated approvalを受けた品目が12品目(22.6%)と2011年以降で最多の品目数であり、割合としても2016年に次ぐ高い水準であった。また、Priority reviewは31品目(58.5%)、Orphan指定品目は31品目(58.5%)、Fast Track指定品目は17品目(32.1%)、Breakthrough Therapy指定品目は22品目(41.5%)であった。Breakthrough Therapy指定品目として承認されたNME数とその割合は、過去最高であった。
欧州については、2020年に承認されたNME 42品目中、Accelerated Assessmentは6品目(14.3%)と2019年より増加し、Orphan指定品目は18品目(42.9%)、Conditional approvalを受けた品目は12品目(28.6%)、Exceptional Circumstancesは3品目(7.1%)、PRIME指定品目は9品目(21.4%)と、それぞれ過去6年間で最多であった。
新医薬品の審査期間の日米欧比較
日米欧で2020年に承認された新医薬品の審査期間(月数)を表1に示した。2020年承認品目のそれぞれの審査期間(中央値)は日本10.7ヶ月、米国10.0ヶ月、欧州12.2ヶ月であり、2019年と比較して日本と米国の審査期間の差が拡大した。NMEに関しては、2020年承認品目の審査期間(中央値)は、日本10.6ヶ月、米国8.0ヶ月、欧州13.8ヶ月であった。2019年と比較すると、日本のみ審査期間(中央値)が長くなっていた。
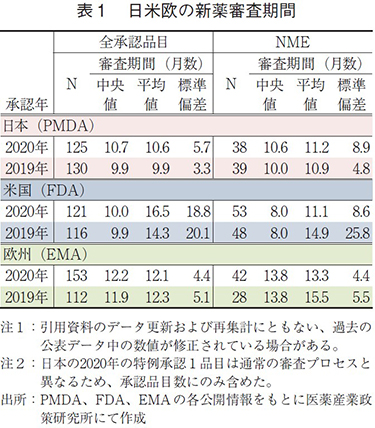
薬事上の特別措置を受けた品目の審査期間
2020年承認品目のうち、審査期間の短縮を目的とした薬事上の特別措置(日本:優先審査、先駆け審査指定制度、米国:Priority review、Breakthrough Therapy、欧州:Accelerated Assessment、PRIME)を受けた品目について表2に示した。特に、先駆け審査指定制度、Breakthrough Therapy、PRIMEの枠組みは、重篤な疾患に対して高い有効性が期待される医薬品について、開発段階における助言の実施や五月雨的な審査(Rolling review)あるいは優先審査など、優先的な取り扱いを行うことで更なる迅速な実用化を図り、アンメット・メディカル・ニーズの早期解決を目指すものである8)。
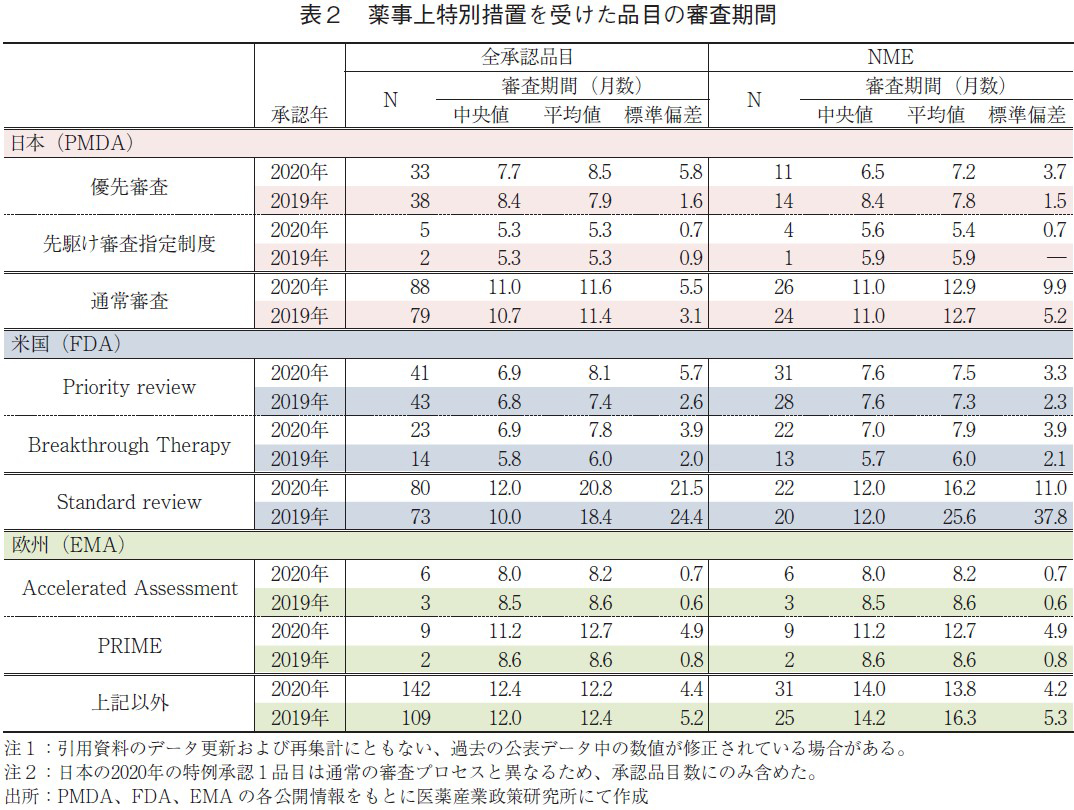
日本での2020年の優先審査品目承認数は、全承認品目(33品目)、NME(11品目)ともに2019年より若干減少したが、審査期間(中央値)はそれぞれ7.7ヶ月、6.5ヶ月であり、2019年と比較して大幅に短縮した。また、先駆け審査指定制度の指定品目として5品目(そのうちNME 4品目)承認されたが、それらの審査期間はPMDAが目標とする6ヶ月より短いことを確認した。一方、通常審査品目承認数は2019年と比べて増加、審査期間(中央値)は2019年と比較して長くなっていた。このことから、表1で見られた日本の審査期間(中央値)が2019年と比較して長くなった原因は、優先審査品目数が減少し、通常審査品目数が増加したためであることがわかる。
米国での2020年のPriority review指定品目の承認数については、全承認品目(41品目)が2019年より減少、NME(31品目)は増加となった。審査期間(中央値)はそれぞれ6.9ヶ月、7.6ヶ月と2019年と同様であった。また、審査期間のばらつき(標準偏差)については、Priority review指定品目ではPMDAの優先審査同様に小さく安定していた。Breakthrough Therapy指定品目については、23品目が承認されており、そのうちのNME(22品目)の審査期間(中央値)はPriority reviewより短くなっていた。日本の先駆け審査指定品目と比較すると審査期間(中央値)は1ヶ月以上長いものの、指定品目数が約5倍多いことは特筆に値する。
欧州では、日本や米国と比較して優先的に審査を受けた品目の割合は少なかったが、2020年のAccelerated Assessment指定品目の審査期間(中央値)は8.0ヶ月と、指定を受けていない品目と比較して4ヶ月以上短かった。また、PRIMEの指定品目については、2019年より大幅に増加し、9品目が承認された。一方、審査期間(中央値)については、2019年より2ヶ月以上長くなったが、特別措置を受けていない品目と比較すると短期間で承認されており、本薬事制度がアンメット・メディカル・ニーズの早期解決に一役買っていることが確認できた。
審査期間の中央値の年次推移(日米欧)
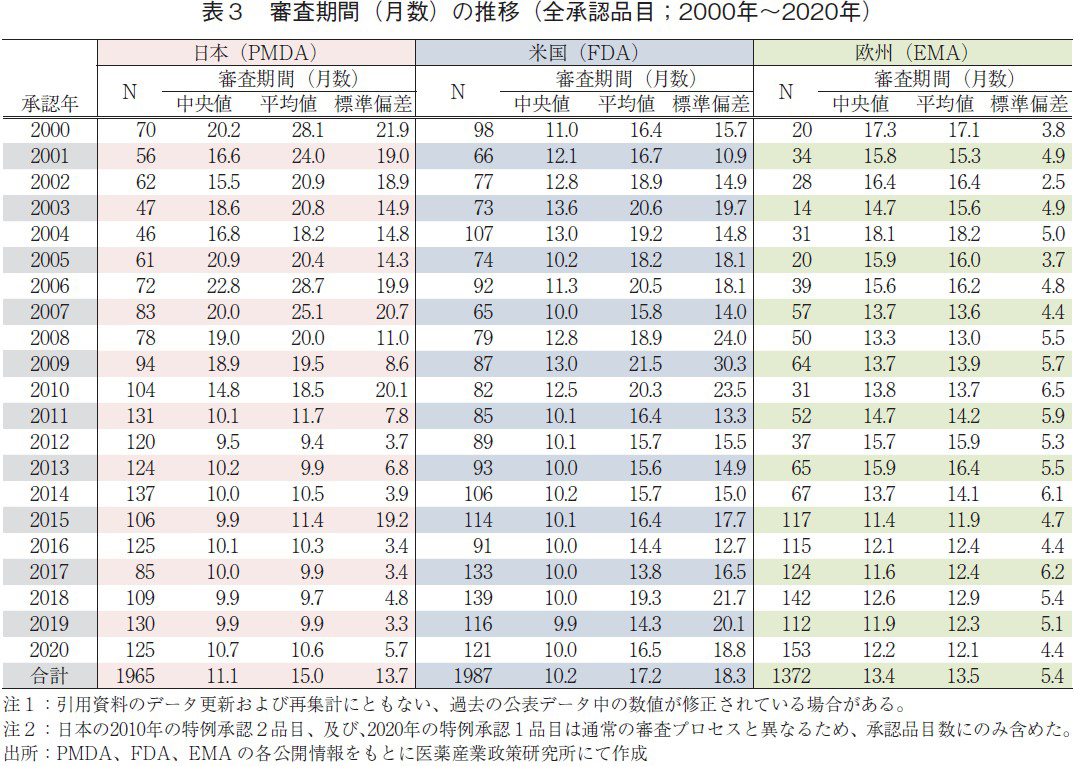
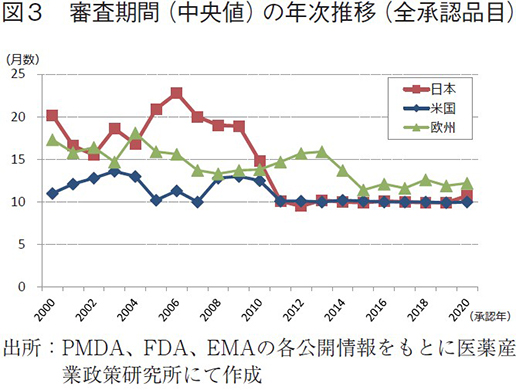
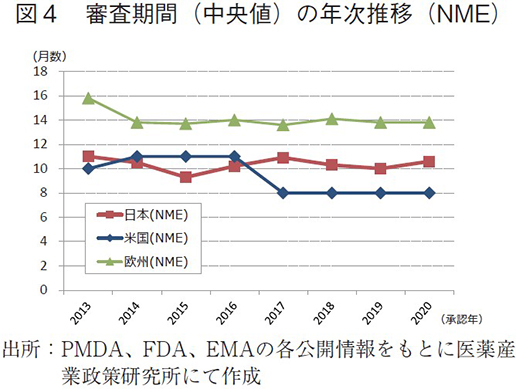
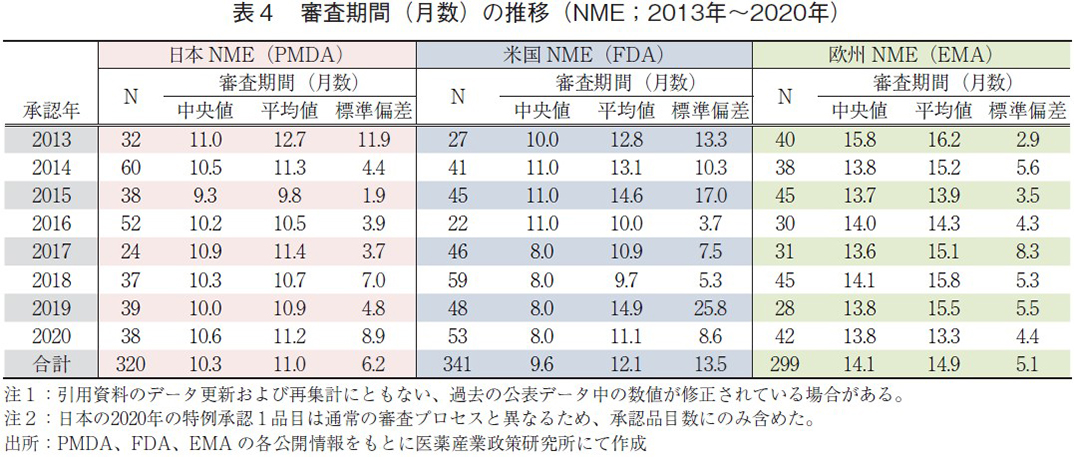
日米欧で承認された医薬品の承認年毎(2000~2020年)の審査期間(月数)を表3に、審査期間の中央値の年次推移を図3に示した。また、NMEについては日本の審査期間が大幅に短縮した後の2013年から2020年の期間を調査対象とし、承認年毎の審査期間(月数)を表4に、審査期間の中央値の年次推移を図4に示した。
調査対象の全期間における審査期間の中央値は、日本11.1ヶ月、米国10.2ヶ月、欧州13.4ヶ月であった(表3)。年次推移(図3)を見てみると、2000~2010年までの期間は概ね米国、欧州、日本の順に審査期間が長い傾向であったが、2011年に日本では大幅な審査期間の短縮を認め、それ以降、日本と米国の審査期間の中央値は同様(約10ヶ月)、続いて欧州の順に審査期間が長くなっていた。欧州も2015年からは審査期間の短縮を認め(約12ヶ月)、以降、2020年まで同様の審査期間で推移していた。
一方、NMEについて調査対象の全期間における審査期間(中央値)は、日本10.3ヶ月、米国9.6ヶ月、欧州14.1ヶ月であった(表4)。2014~2016年の期間については、日本におけるNMEの審査期間(約10ヶ月)は米国よりも短く推移していたが、2017年に米国におけるNMEの審査期間が3ヶ月短縮し、以降は米国、日本、欧州の順で現在まで推移していた(図4)。
COVID-19ワクチンの審査期間の日米欧比較
本稿での調査の最後として、現在も世界中で感染拡大が続く「新型コロナウイルス(SARS-CoV-2)による感染症の予防」を効能・効果とするCOVID-19ワクチンに関する日米欧の承認・緊急使用許可状況、審査期間、日本の対応の問題点や米欧でのワクチン審査への対応について取り上げる。
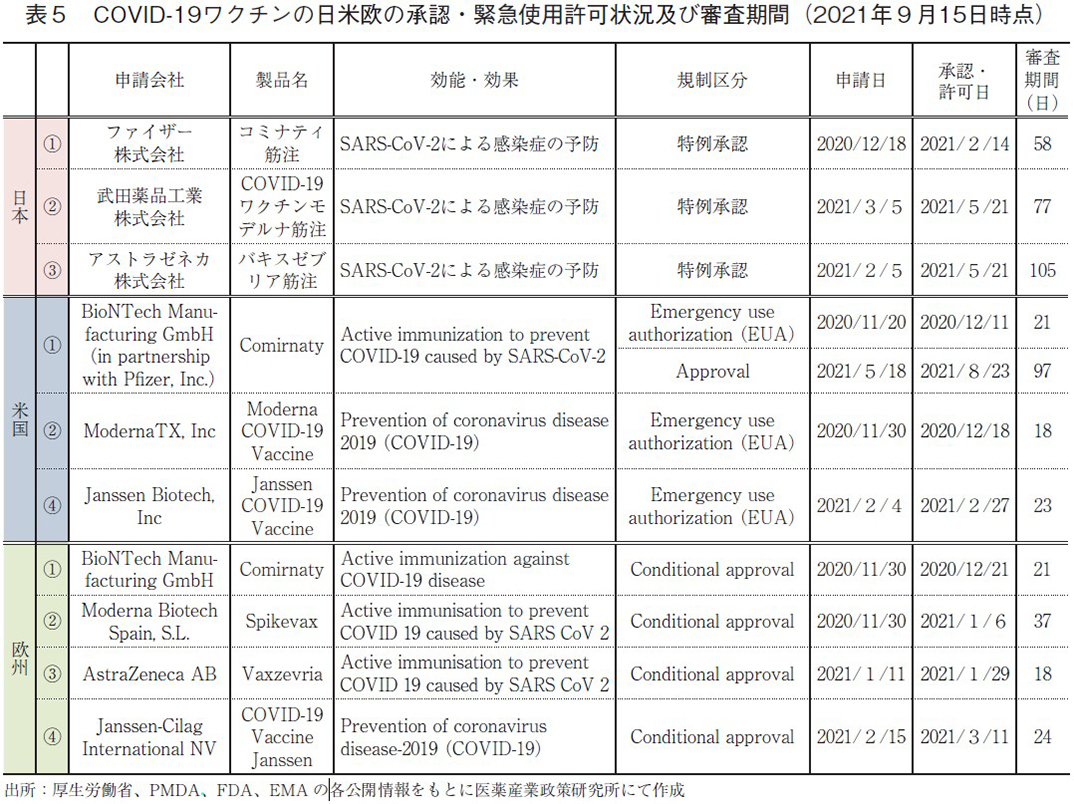
2021年9月時点で日米欧にて使用が認められているCOVID-19ワクチンは全部で4種類(表5、①から④)あり、欧州ではそれら4種類全てが条件付きの特別措置であるConditional approvalにて承認されていた。日本では医薬品医療機器等法14条の3に基づく特例承認3)を受け、①、②、③の3種類のワクチンが利用されており、④のワクチンについては2021年5月24日に国内製造販売承認申請されたことが発表されていた9)。他方、米国では法制上の承認を受けているワクチンは①の1種類のみであり、②、③の2種類は未だ緊急使用許可(Emergency use authorization, EUA)10)として一時的に利用が認められている段階であった。
次に、各極間での承認時期および審査期間を比較する。日米欧3極それぞれにて最も早く利用が可能となった①のワクチンについては、米国と欧州では2020年11月中旬から末にかけて申請がなされ、わずか21日後の2020年12月中に使用の許可が出されていた。一方、日本では2020年12月中旬に申請され58日後の2021年2月に特例承認を受けているが、これは米国や欧州から遅れること約2ヶ月での承認となっていた。また、②のワクチンについては米国や欧州より遅れること4か月以上のラグ(=遅延)、③のワクチンについても欧州より4ヶ月程度遅れての認可となっており、承認時期に加えてそれぞれのワクチンの審査も、日本のほうが遅かったことがわかった。
問題点として、日本の特例承認は、①疾病のまん延防止等のために緊急の使用が必要、②当該医薬品の使用以外に適切な方法がない、③日本と同等の水準にある承認制度を持つ国で販売等が認められている、という要件を満たす必要があり3、11)、特に③がある限り、他国での承認より日本での承認申請時期が早くなりえなく、日本において先行して承認審査が開始されることはないことがわかる。言い換えると、特例承認は、国民の生命・健康を脅かす疾患について自国で治療薬・開発が困難な際に、海外製品を迅速に調達するためのルールとなっており、臨床研究などで国内使用実績がある医薬品でも、海外販売実績がなければ対象外となる。つまり、緊急時に日本の規制当局が自からの判断でリスクベネフィットを評価し、緊急事態下での規制判断を行い、世界に先駆けて緊急使用を認める薬事制度は存在しない状況であることが露呈した11)。
また、ワクチンの国内承認に関して、国が国内での臨床試験結果を求めた点も海外から遅れた原因の一つと考えられる。令和2年9月にPMDAから公表された「新型コロナウイルス(SARS-CoV-2)ワクチンの評価に関する考え方」12)によると、「海外で発症予防効果を評価するための大規模な検証的臨床試験が実施される場合においても、国内で臨床試験を実施し、日本人被験者において、ワクチンの有効性及び安全性を検討することは、必要性が高いと考える。」と明記されており、表5の①、②、③のワクチンについては、①では2020年10月、②では2021年1月、③では2020年8月より、国内第I/II相試験を実施していたことが各審議結果報告書に記載されている13)。つまり、COVID-19ワクチンの有効性について、海外の検証的試験の成績に基づき評価し、それに加えて、国内臨床試験成績から日本人の免疫原性及び安全性を確認することで、日本人における本剤の有効性及び安全性を評価したのが、今回の日本におけるワクチン承認の対応であった。この日本での臨床試験を求めること自体はPMDAの医薬品承認審査からすると通常どおりのことであるが、パンデミックのような緊急時の薬事承認プロセスとして必要であるかどうかは、今後議論が必要であろう。
もう一点、COVID-19ワクチンの日本での審査期間自体が米欧と比較して倍以上要した点も、緊急時であることを考えると重要な差であったと考える。この点に関しては原因を突き止めるのは難儀であるが、例えば③のワクチンについては、審議結果報告書13)によると、海外製造販売後に報告された血栓症、血栓塞栓症及び神経欠陥性イベントに関連した安全性についての記載に多くのページが割かれており、承認日の約1.5ヶ月前の2021年4月7日には、EMAが本剤接種後に血小板減少を伴う血栓が極めてまれに起きる可能性があり本剤の副反応とすべきと公表するなど14)、この安全性に関する事象への確認対応に時間がかかっていたのではないかと想像できる。また、前述の国内第I/II相試験に基づく日本人における有効性と安全性の確認や海外臨床試験とのブリッジングに時間がかかっていたのかもしれない。2020年5月7日にSARS-CoV-2による感染症を効能・効果として特例承認されたベクルリー(一般名:レムデシビル)については、承認審査時の主な臨床試験等の試験成績として取り扱われた国際共同第III相試験に日本も参画していたことが審議結果報告書13)から確認できており、承認審査の迅速化に寄与したと考えられる。ただし、ワクチン開発当時の日本でのCOVID-19の流行状況を踏まえると、日本を含めた国際共同治験は実施困難であった可能性がある。また、詳細は後述するが、欧州ではすべてのCOVID-19ワクチンに対して承認申請前から審査(Rolling review)をおこなう等の対応をしていた。日本については承認申請前に審査が開始されていたかどうかの正確な情報は得られていなく、この辺りも承認審査期間の差につながった可能性がある。
他方、米国のEUAは緊急時の対応として機能し、早い段階からのCOVID-19ワクチン接種を可能とした。ただし、EUAについても問題は生じており、ワクチンのケースではないが、COVID-19治療のために一度は認めた抗マラリア治療薬ヒドロキシクロロキンとリン酸クロロキンについて、COVID-19への有効な可能性は低く、深刻な副作用を伴う恐れもあるとの判断でEUA付与を数ヶ月後には撤回するなど、社会の混乱に拍車をかける状況も生まれた15)。本事案は、医薬品の適正な審査をする期間が確保できなかったために生じた事例であろう。
欧州についてはConditional approvalにて対応をおこなっていたが、通常の審査時では行われていない以下のような措置を講じていたことがわかった。欧州でのCOVID-19ワクチンの審査報告書(European public assessment reports, EPAR)によると、例えば、表5の①のワクチン16)については申請日より50日以上前の2020年10月6日から欧州医薬品委員会(Committee for Medicinal Products for Human Use, CHMP)による審査(Rolling review)が始まっていたとの記載があった。このことは表5の②、③、④のワクチン17)についても同様であり、それぞれのワクチンの承認申請日より前にCHMPにより審査が始まっていたことが確認できた。これらワクチンの例以外に、申請日より前に審査を開始していた例があるか、2015年~2020年の期間においてEMAにてConditional approvalにて承認された全品目について調査した結果、申請日より前に審査を開始していたこれらワクチンへの対応は特殊な対応であることがわかった。公衆衛生上の課題であるCOVID-19パンデミックへの対応として、審査を実施するための期間を確保するため、そしてワクチンへのアクセスをできるだけ早めるため、Conditional approvalの承認申請前から審査を開始するという、審査当局と製薬企業との協力関係により成し得る特別な措置を講じていたと考えられる。
考察とまとめ
本稿では、2020年に日米欧で承認された新医薬品の承認品目数および審査期間について、それぞれの規制当局の公表情報を元に集計、比較調査した。併せて、2020年より猛威を振るっているCOVID-19に対するワクチンへ、日米欧各極にて用いられた制度および審査期間情報を調査し、日本における緊急時の医薬品承認制度の課題を提起した。
2020年の承認品目数は、日本は過去6年間で2番目の承認数、米国では2019年より増加し、かつ、NME数については2000年以降で2番目に多い承認数であり、欧州においても過去6年間で最多の承認数であった。2020年はCOVID-19流行による様々な制限の中、日米欧各極ともに活発に新薬の承認審査がおこなわれていたことが確認でき、患者さんの健康や公衆衛生上の課題に貢献をするため、各審査当局と製薬業界との協力体制がうまく構築されていたことを示す事案であるかと思われた。ただし、COVID-19の流行により医療従事者の負担が増え、被験者の感染リスクが高まったことで、臨床開発に影響が出ているとの分析もあるため、2021年以降の新薬承認状況を注視する必要があるだろう18)。
NMEの承認品目数と薬事上の特別措置品目についての調査からは2つの特徴が見られた。1つ目の特徴は、日本の優先審査、希少疾病用医薬品のNME数の割合が2016年より右肩下がりに減少していることである。対して、米国のPriority reviewやOrphanの品目、欧州のAccelerated AssessmentやOrphanの品目では、そのような傾向は見られず、米国と欧州のNMEにおけるOrphan指定品目の承認数の割合については過去6年間で最も高くなっていた。本件については、2021年以降の状況を注視していく必要があるのと同時に、この辺りの差異の原因究明が必要であるが、日本の希少疾病の定義と海外のオーファンの定義が異なるなど様々な要因が絡むと想定されるため、今後の検討課題としたい。
一方、2つ目の特徴としては、重篤な疾患に対して高い有効性が期待される医薬品について、患者へのアクセスを早めるために審査期間の短縮を目的とした薬事上の特別措置である先駆け審査指定制度、Breakthrough Therapy、PRIMEや、条件付き早期承認制度、Accelerated approval、Conditional approvalに該当するNMEの承認割合が軒並み増加していた点である。本稿の補足にまとめたように、これら薬事上の特別措置を受けるには、重篤な疾患に対する高い有効性等が求められており、それら条件を満たした医薬品群ということになる。また、その中でも条件付き承認が増えていることは、検証的な臨床試験実施が困難な難治性疾患へのチャレンジが増加しているとも言える。つまり、世界の各企業がアンメット・メディカル・ニーズの高い医薬品の開発に対して引き続き積極的に投資しており、着実に成果を積み上げていると考えられた。
新医薬品の審査期間について、日本の審査期間(中央値)は、2020年に米国と比べて0.7ヶ月長くなったものの欧州より短い傾向を示し、2011年以降続くこの傾向は2020年も持続していた。NMEに限定した場合、米国の審査期間(中央値)が最も短く、日本、欧州の順となっており、2017年よりこの傾向が続いていることがわかった。この差を詳細に理解するために、日本のNMEに占める優先審査指定品目の割合や審査期間を米国や欧州と比べると、日本では優先審査品目の割合が減少傾向にある中、米国ではNMEに占めるPriorityreviewやBreakthrough Therapy指定品目の割合が日本の優先審査や先駆け審査指定品目の割合と比べて圧倒的に高くなっていた。一方、欧州のNMEではAccelerated Assessment指定品目の審査期間自体は日本の優先審査と遜色ないものの指定品目の割合が大幅に低く、かつ、Accelerated Assessment以外のNME審査品目についてはPRIME指定品目でさえも日本の通常審査と同程度の審査期間(中央値)であり、それ以外の品目の審査期間が大幅に長かった。以上のことから、各極のNMEの審査期間(中央値)の差が出ていることがわかる。
COVID-19ワクチンの承認状況や審査期間の比較からは、各極ともにそれぞれの制度にてCOVID-19の急速な感染拡大という難局に対応しており、日本の場合は特例承認、米国の場合は緊急使用許可(EUA)、欧州はConditional approvalという制度を用いていた。そのような状況下、米国や欧州と比べて日本でのワクチン承認時期が遅かったのに加え、審査期間自体も米欧の倍以上要していたことがわかった。また、日本においては特例承認の問題点も露呈した。今回のパンデミックをきっかけに、有事に緊急対応するための審査や承認の枠組みづくりを議論し方策を立てることが必要であろう。その際、日本と米欧のCOVID-19ワクチンに関する承認時期や審査期間を比べた際の差(=承認時期のラグ、及び、審査期間のラグ)についての原因調査が行われることを期待したい。厚生労働省は2021年9月に策定した「医薬品産業ビジョン2021」19)において、「緊急時の薬事承認プロセスの迅速化と基準整備」をおこなうことを明記しており、近い将来の改善を期待する。
現況、日本(PMDA)、米国(FDA)、及び欧州(EMA)ともに、患者さんへの革新的な医薬品のアクセスを早めることを主眼に審査期間の短縮を目的とした特別措置を整備し、企業がそれら制度を戦略的に活用し投資を継続することでその目的を果たし、患者さんの健康や公衆衛生上の課題に貢献をするというサイクルがうまく回っていると考える。ただし、COVID-19パンデミックの経験から、日本における緊急時の制度の弱点も露呈した。医薬品の研究開発が多様化・高度化する中、そして、将来おこりうる新たなパンデミックに備え、その時代に見合った制度がさらに整備されていくことを期待する。
-
1)医薬産業政策研究所.「日本における新薬の臨床開発と承認審査の実績」リサーチペーパー・シリーズ No.69(2016年11月)
-
2)医薬産業政策研究所.「日米欧の新薬承認状況と審査期間の比較 2019年承認実績を中心に」政策研ニュース No.61(2020年11月)
-
3)医薬産業政策研究所.「日本で承認された新医薬品とその審査期間 2020年承認実績と過去10年の動向調査」政策研ニュース No.62(2021年3月)
-
4)医薬産業政策研究所.「ドラッグ・ラグ:国内未承認薬の状況とその特徴」政策研ニュース No.63(2021年7月)
-
5)
-
6)
-
7)
-
8)
-
9)
-
10)
-
11)
-
12)
-
13)
-
14)
-
15)
-
16)
-
17)European Medicines Agency(EMA): EPAR - Public assessment reports for Spikevax(previously COVID-19 VaccineModerna), Vaxzevria(previously COVID-19 Vaccine AstraZeneca), COVID-19 Vaccine Janssen
-
18)医薬産業政策研究所.「医薬品産業におけるCOVID-19パンデミックへの対応と今後」政策研ニュース No.61(2020年11月)
-
19)

