目で見る製薬産業 世界売上高上位医薬品の創出企業国籍調査を振り返る 品目数の動的推移や創薬の担い手の観点から
医薬産業政策研究所 主任研究員 澁口朋之
はじめに
本政策研ニュースにおいて中尾が2020年の動向を報告した1)ように、政策研では医薬品世界売上高上位品目の創出企業国籍を2013年の動向から継続的に調査・報告している2)。これまで本調査結果は様々な政策関連資料に活用されており、特に本年9月に厚生労働省から発表された医薬品産業ビジョン20213)では参考資料として用いられただけでなく、医薬品産業政策のフォローアップのためのKPI案の1つに「グローバル売上高上位100品目に占める日本起源医薬品の数」が挙げられるなど、本調査結果への関心が高いことが分かる。
今回、2013年から最新の2020年の定点調査結果を振り返り、本調査の特徴を把握するとともに、日本の新薬創出力について考察を試みた。
研究方法
2013~2020年の結果1、2)を用い、本稿では創出企業国籍を「親企業国籍」および「出願人国籍」の2種類の観点から分析を行った。
-
親企業国籍
これまで報告してきた分析手法であり、各品目の基本特許に記載されている出願人/譲受人の国籍において、出願時点に海外親会社がある場合には親会社の国籍とした。これは鍵となる物質・用途・技術などの要素を発明する過程において人材や資金といったリソースに親会社の寄与があると考えたためである。将来性のある企業を早期に傘下に収めるなど、親企業の目利き力も影響すると考えられる。
-
出願人国籍
各品目の基本特許に記載されている出願人/譲受人の国籍をそのまま採用した。当該医薬品の鍵となる要素を見出した企業の国籍を調べることは実際の「創薬の場」がいずれの国にあるかを知る上で参考になると考えられる。
2013~2020年に売上高上位100品目にランクインした製品(178品目)
2013~2020年の8年間において、IQVIA World Review Analystをもととした売上高上位100品目(以下、売上高上位品目)に1度でもランクインした品目は全体で178品目であった。毎年10品目前後の入れ替えはあるものの、複数年継続してランクインする品目が多く、8年間の継続調査においてその品目数は限定的になっているものと思われる。その178品目について親企業国籍および出願人国籍で分類した結果を図1に示す。図1左の親企業国籍分類では国籍数は全体で13か国あり、品目数ではアメリカ(87品目)、スイス(22品目)に次いで第3位に日本(17品目)であった。品目数は第2位のスイスに比べ5品目少なく、例年品目数で肉薄している状況と異なる結果であった。これは2013年の調査開始時点において日本がスイスに比べ7品目少ない結果であったことが影響していると思われる。
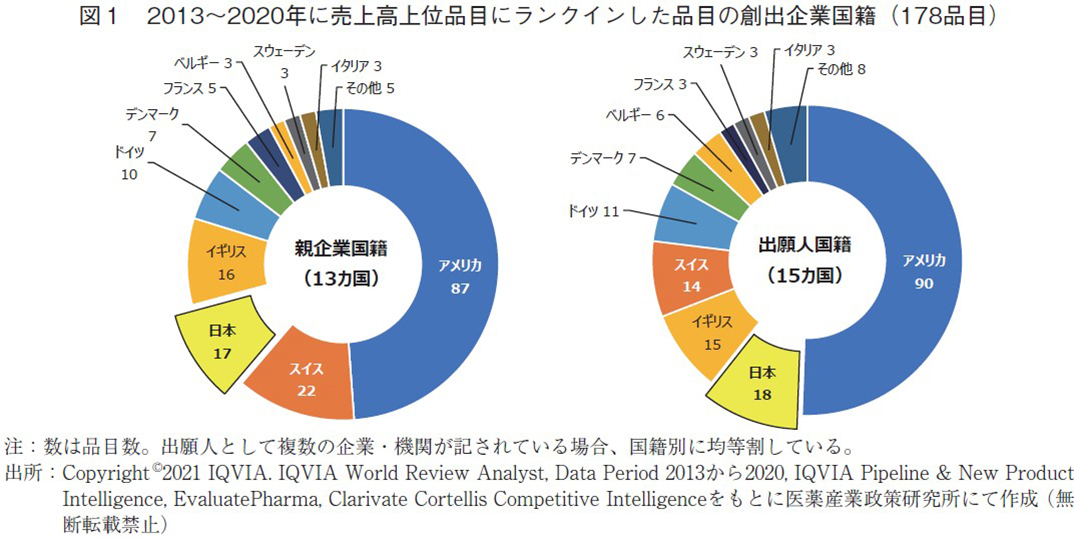
図1右の出願人国籍分類では国籍数は全体で15か国であり、親企業国籍分類より2か国多かった。本分類ではアメリカ(90品目)に次いで2位に日本(18品目)、3位にイギリス(15品目)となった。スイスはイギリスに次ぎ第4位(14品目)であり、傾向としては親企業国籍分類と同様であるものの、スイスなど一部品目数と順位に違いが生じている。これは本社を置く国とは異なる国の子会社や傘下企業で製品の鍵となる要素を見出した結果であり、実際の「創薬の場」としては国外にあったと考えられる。日本が本分類において2位に位置したことは「創薬の場」としても世界で存在感を発揮していると考えられた。
なお、両分類において近年その市場規模や研究開発投資額の大きさに注目が集まる中国は本調査において確認できず、アジア地域では日本が唯一ランクインする結果であった。以前報告した4)ように中国においては中国製薬企業による臨床開発品目数は急増しているものの、その多くは中国国内のみで開発が行われており、グローバルでの開発は限られているためと思われる。一方、グローバル開発品目も増加していることは確かであり、今後もその動向は注視すべきである。
2014年以降にランクインした品目の創出企業国籍
前節で述べたように売上高上位品目では複数年継続してランクインする品目があり、承認や上市から時間の経った品目も存在する。そこで、2013年を基準として2014年以降、新たにランクインした品目に着目した。新たにランクインした品目は承認日や上市日が比較的新しい品目となりやすいため、それらの創出企業国籍と推移を追うことで近年の「新薬創出力」を測ることができるのではないかと考えた。
2014年以降の7年間において売上高上位品目にランクインした品目は76品目存在5)し、毎年平均11品目程度新たにランクインする形であった。まず、その創出企業国籍の割合は図2の通りに示す。図2左の親企業国籍分類では全体の国籍数が11か国となり、図1左の結果に比べ少なかった。一方、品目数では同図と異なり、アメリカ(38品目)に次いで日本が単独で第2位(9品目)となり、第4位のスイス(7品目)より多い結果となった。前節で述べた通り、2013年の結果において日本がスイスに比べ品目数が少なかったことが影響していると思われる。図2右の出願人国籍分類でも国籍数は11か国と図1右より少なくなり、売上高上位品目にランクインする品目を創出できる企業国籍は限定的であった。品目数に関しては図1右と同様の傾向であり、アメリカ(41品目)に次いで日本が単独で第2位(10品目)となり、イギリス(6品目)、スイスおよびドイツ(4品目)と続く結果となった。親企業国籍分類に比べスイス、イギリスの品目数は減少する結果となった。
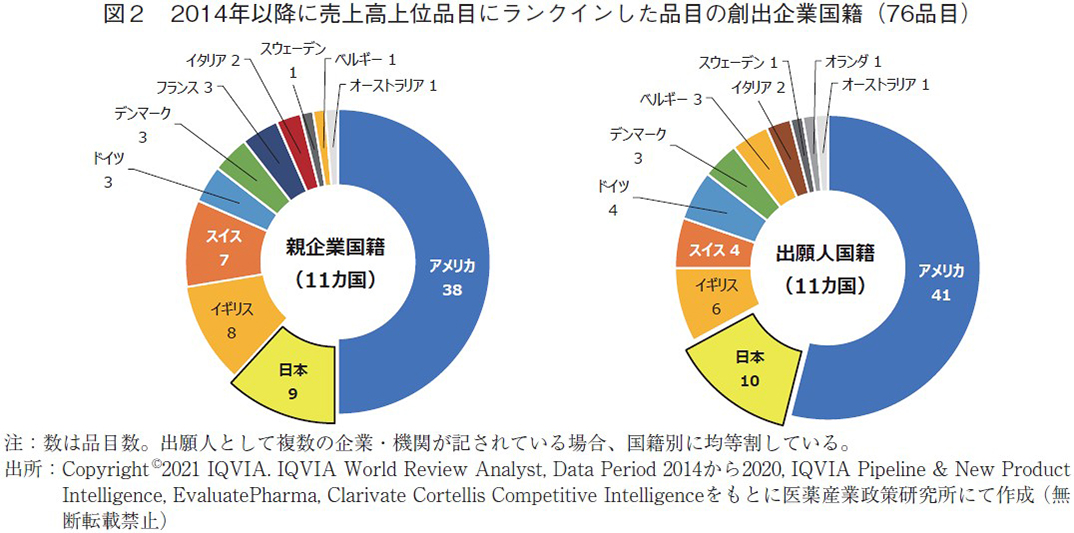
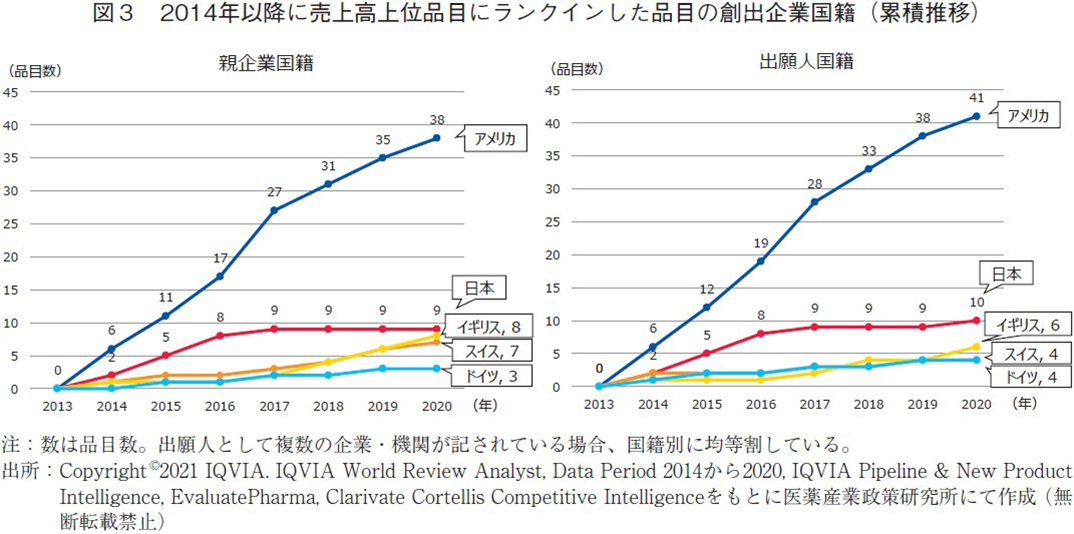
図2の結果は2020年時点での合計であるが、その動的推移を見たものが図3である。なお、グラフの見やすさの観点から品目数の多かったアメリカ、日本、イギリス、スイス、ドイツの5か国に限定した。どちらの分類においてもアメリカは毎年平均5~6品目程度コンスタントに追加させていることが分かる。日本は両分類でその推移は変わらず、2017年までは毎年に追加させてきたものの、2018年以降は停滞気味であった。ドイツも同様に両分類で大きな差は無く、日本・ドイツにおいてはそれらの国内で各品目の鍵となる要素の発明が行われていたことが分かる。一方、スイス、イギリスにおいては親企業国籍分類(図3左)で見た場合、2017年以降定期的に品目が追加されており、2020年時点で日本と1~2品目差にまで迫っていた。一方、出願人国籍分類(図3右)でみると左図ほどの上昇幅は見られず、両国においてはそれぞれの国以外で各品目の鍵となる要素の発明が行われていたと考えられる。
グローバル承認品目の創出企業国籍
前節では2014年以降新たにランクインした品目に絞ってその創出企業国籍を集計し、親企業国籍、出願人国籍のいずれの分類でも日本が第2位となる品目数を創出していることが分かった。一方、その年次推移を見ると近年停滞気味であることも見えてきた。これは日本の新薬創出力が落ちてきているということを示すものであろうか。その点を検証するため、近年のグローバルで承認された品目の推移を見ることとした。
政策研ニュースNo.62にて、日米欧NME(New Molecular Entity)承認品目の創出企業の国籍について報告した。その中で日米欧2極以上にて2010年以降に初承認されたNMEの創出企業国籍について報告している6)。そのデータを累積年次推移に書き直し、また同時に出願人国籍についても改めて解析を行ったものが図4である。補足に示すように売上高上位品目にランクインするまで、初承認日から3~4年程度の期間を要する。そのため2010年から2019年の状況を把握することはこれまでの状況だけでなく、今後の見通しを計る上でも有用であると思われる。
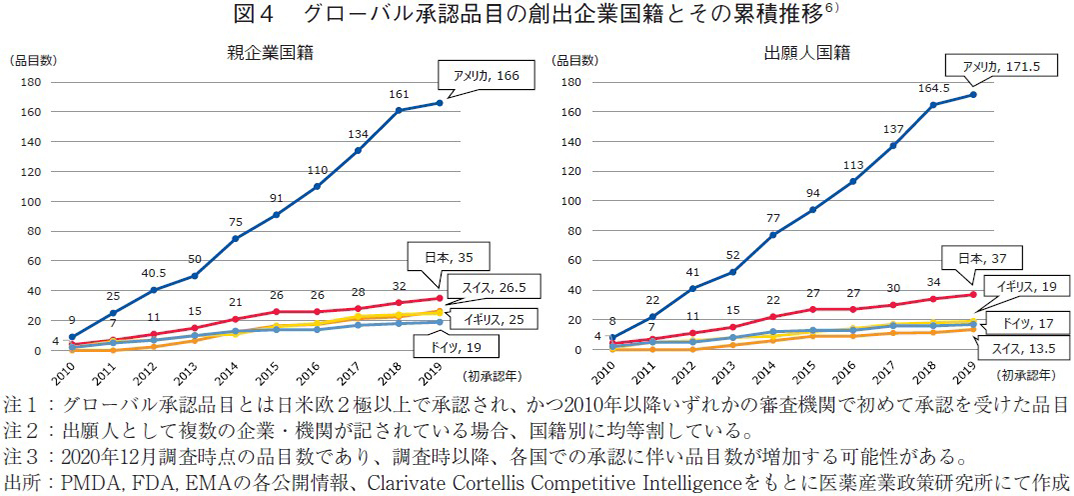
親企業国籍分類(図4左)で見た場合、アメリカ(166品目)に続いて第2位に日本(35品目)であるが、その推移を見ると2015年以降はそれ以前に比べると増加速度は緩やかな傾向であった(26品目→35品目)。一方、第3位のスイス(16.5品目→26.5品目)、第4位のイギリス(16品目→25品目)と比べてもその増加品目数に大きな違いは見られなかった。出願人国籍においても同様であり、2015年以降で見ても日本(27品目→37品目)と毎年一定数創出し続けていることが分かった。このように承認品目数の観点から見た場合、日本起源の品目数が落ちているとは考えられなかった。また、図4の結果が図3の結果と類似していることはグローバルでの承認品目数自体も売上高上位品目にランクインする要素の1つとも考えられる。
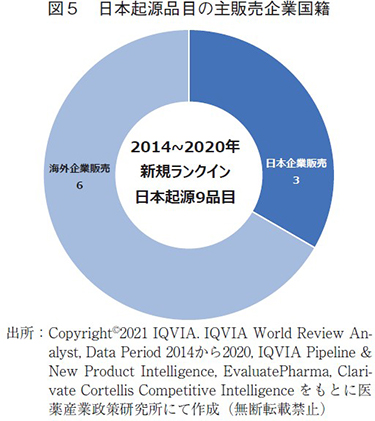
主販売企業国籍調査からの考察
グローバル承認品目という観点からは日本起源の品目数減少は確認出来なかったが、売上高上位品目へのランクイン数の停滞傾向について少し考察を続けたい。本集計は「売上高」を基準としているため、各社の販売戦略も少なからず影響を及ぼしていると思われる。各企業の販売戦略に関しては本ニュースの主眼ではないため、深く考察することは避けたいが、これまでの収集データの中から「主販売企業国籍」に着目した。ここで言う主販売企業国籍とは、IQVIA社のデータにおいて1製品を複数の企業が販売している場合、製品の販売額が最も多い企業の国籍のことである。図5にその内訳を示す。2014~2020年にランクインした日本起源9品目の内、6品目は世界において海外企業から主に販売されており、売上高の大型化には海外企業との連携の必要性が考えられた。中尾のニュース1)で指摘されている通り、売上高上位100位の品目売上高は年々高くなり、ランクインするハードルは高くなっている。グローバル承認品目は増加しているものの、売上高上位ランクインを果たせていないということは製品の大型化という点にも課題があると思われる。新薬創出という観点からは今後も日本起源品目を創出し続けるために「創薬の場」としての魅力を高めていく必要があるが、売上高上位品目の観点からは海外展開の強化も同時に必要と思われた7)。
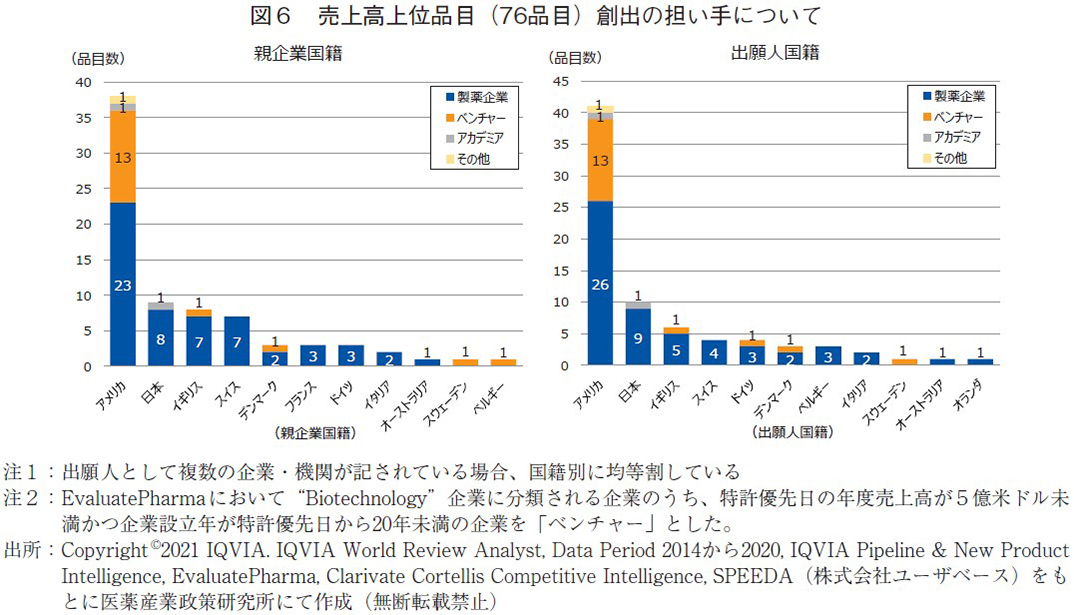
売上高上位品目創出の担い手について
昨今では創薬ベンチャーのような新興企業が新薬創出の主な担い手と言われており、臨床開発品目の80%は新興企業起源によるものとも言われている8)。日本起源新薬を創出し続けていくための方策を考える上で、これら新薬創出の担い手について調査した。売上高上位品目の調査に関しては村上によって解析が行われており、新規創薬基盤技術をベースに創薬を行うバイオテックによる創薬活動の貢献度が確実に高まっていることを報告している9)。村上のニュースを参考に76品目の創出企業を国籍別に分類を行った(図6)。創出企業の分類に関してはEvaluatePharmaの会社分類に基づいて、"Biotechnology"に分類される企業のうち、特許優先日の年度売上高が5億米ドル未満かつ企業設立年が特許優先日から20年未満の企業を「ベンチャー」とした。それ以外に分類(Global Major, Regional Major, Specialtyなど)される企業は「製薬企業」、大学等は「アカデミア」、いずれにも属さないものは「その他」としている。
図6に結果を示すが、親企業国籍(左図)ではアメリカにおいて38品目中13品目(34%)がベンチャー起源であり、売上高上位品目という限られた条件の中でもアメリカにおいてはベンチャーが新薬創出の一翼をすでに担っていることが分かる。一方、日本では9品目中8品目(89%)が製薬企業起源であり、アカデミア起源の品目が1品目ランクインしていたが、ベンチャー起源の品目は無かった。欧州各国についても日本と同様に製薬企業起源が主体であるが、ベンチャー起源の品目も数品あった。出願人国籍(右図)においても親企業国籍と同様の傾向であったが、アメリカの製薬企業由来の品目数が多くなった。これはアメリカに本社を持たない製薬企業においては、アメリカに研究拠点をもつ関連企業から新薬が創出されていることを示唆しており、ベンチャーだけでなく製薬企業においてもアメリカにおける新薬創出力の高さがうかがえる。
なお、ベンチャー企業を買収することで製薬企業自身の創薬力を上げている側面も考えられ、図6に示した結果よりもベンチャー企業による新薬創出への貢献は高いのではないかと思われた。
日本の新薬創出力について
前節の結果から日本における新薬創出力を維持・向上していくためには新薬創出の新しい担い手としての創薬ベンチャー育成の必要性が示唆される。また、アメリカのように製薬企業における新薬創出力の高さも見逃せず、「創薬の場」としての魅力を高めていく必要があるように思われる。
図6にあるように日本ではアカデミア起源の品目も存在しており、アカデミアとの産学連携を通じて新薬創出につながった例も多い。表1に日本における産学連携により新薬創出につながった代表的な例をまとめる。連携の内容は創薬の探索段階から臨床研究推進まで多岐にわたるが、アカデミアによる基礎研究が新薬創出に大きく貢献していることが分かる。これらの中には売上が大型化する品目もあり、アカデミアの高度な基礎研究力を維持・向上させ、「創薬の場」としての魅力を高めていくことが今後の日本の新薬創出力の鍵の1つになると思われた。
アカデミアによる基礎研究への支援、特に疾患メカニズムの解明など根本治療につながる研究の支援には資金的リソースだけでなく、疾患を研究する上で必須となる医療健康分野のデータ基盤整備とその利活用促進も挙げられる。ヒトの疾患を研究する上ではヒトの情報が必須であり、ゲノムを含めたオミックスデータや実診療情報は疾患解明に向けた基礎データとなるため、利活用促進に向けた環境整備は喫緊の課題と思われた。
アカデミアによる基礎研究が強化され、その研究成果が充実することが創薬ベンチャー起業を促進する重要な要素の1つであり、国内外問わず製薬企業を含めたヘルスケア産業との連携、オープンイノベーションが日本において進んでいくことが期待される。

まとめ
政策研では2013年から毎年医薬品世界売上高上位100品目の創出企業国籍調査を継続的に実施しており、その中で日本は毎年第2位もしくは3位となる品目数であった。今回、これまでの定点調査をもとにその品目数・動的推移・担い手などについて調査を行った。「新薬創出力」を測る目的で2014年以降新たにランクインした品目を中心に調査を行ったところ、日本は品目数でアメリカに次ぐ第2位となった。アジア地域においても唯一の創薬国となり、世界で創薬ができる限られた国の1つとして日本はその存在感を示していると思われる。
一方、創薬を取り巻く環境は新規モダリティの広がりや創薬ベンチャーによる新薬創出への貢献度増加9)など変化し続けている。日本においては創薬ベンチャーの育成・支援と同時に、疾患メカニズムの解明などアカデミアの基礎研究力強化も今後の創薬力向上の鍵と考えられた。また、その疾患メカニズム解明にはヒトの疾患データが必須であり、医療健康分野のデータ基盤整備とその利活用促進が望まれる。
新薬の創出には基礎研究から始めて9~16年かかる11)とされているが、補足に示した通り、新薬が世界で広く使われるためには特許出願から15~16年程度かかることが分かる。新薬の創出は一朝一夕にできるものではなく、地道なサイエンスの積み重ねが必要である。日本が創薬において世界をリードする立場であり続けるためには長期的視点に立った産業育成のための環境整備を期待したい。
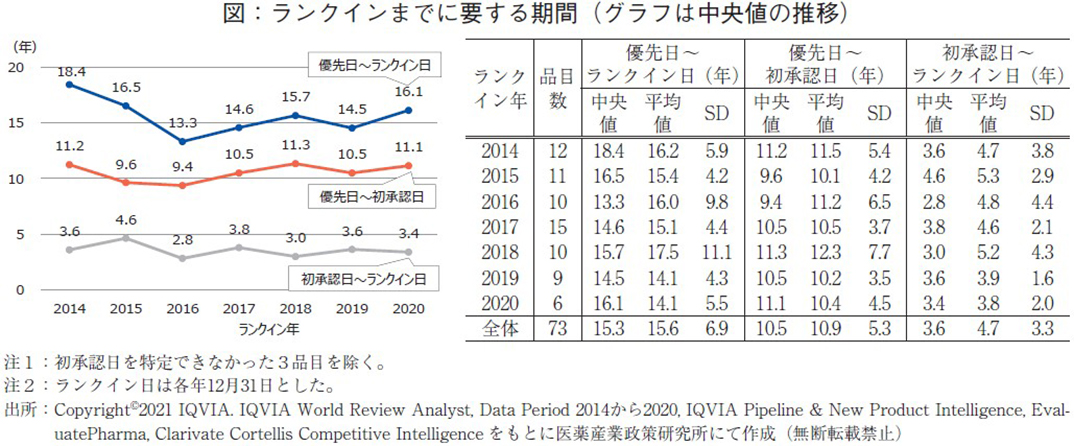
補足:世界売上高上位品目にランクインまでに要する期間
本集計は各年の世界売上高上位品目を対象としているが、それら品目が本ランキングに登場するまでにどの程度の期間が必要なのか、2014年以降にランクインした品目の世界初承認日(日米欧内で最も早く承認された日)および基本特許に記載された優先日からの期間について調査した(下図)。なお、ランクイン日については各年の12月31日としている。それぞれの期間についてランクイン年別に中央値、平均値、標準偏差(SD)を算出した表(右)と、中央値を結んだグラフ(左)を示す。75品目全体を中央値で見ると、基本特許に記された優先日からランクイン日までは15.3年、優先日から初承認日までは10.5年、初承認日からランクイン日までは3.6年程度それぞれ必要であることが分かった。左図のグラフから分かるようにいずれの指標においても、概ね横ばいという結果であった。なお、初承認日からランクイン日までの年数についてはばらつきが大きいため参考値と考えられる。
-
1)医薬産業政策研究所「世界売上高上位医薬品の創出企業の国籍 2020年の動向」政策研ニュースNo.64(2021年11月)
-
2)医薬産業政策研究所「国・企業国籍からみた医薬品の創出と権利帰属」政策研ニュースNo.42(2014年07月)、以降、政策研ニュースNo.47(2016年3月)、No.50(2017年3月)、No.52(2017年11月)、No.55(2018年11月)、No.58(2019年11月)、No.61(2020年11月)
-
3)
-
4)医薬産業政策研究所「中国製薬企業による新薬臨床開発動向」政策研ニュースNo.60(2020年7月)
-
5)2014年以降にランクインした品目の内、2012年以前にランクインした品目を除いた。
-
6)医薬産業政策研究所「日米欧NME承認品目の創出企業の国籍 2010~2019年の承認品目を中心に」政策研ニュースNo.62(2021年3月)
-
7)医薬産業政策研究所「技術輸出からみる国内創製新薬の収益」政策研ニュースNo.64(2021年11月)
-
8)IQVIA Emerging Biopharma's Contribution to Innovation: Assessing the Impact(2019年6月)
-
9)医薬産業政策研究所「革新的医薬品創出の担い手に関する調査 世界売上上位医薬品の起源分析より」政策研ニュースNo.55(2018年11月)
-
10)
-
11)

