Points of View 新薬の薬価収載状況 2018年度薬価制度抜本改革の収載時薬価への影響
医薬産業政策研究所 主任研究員 吉田晃子
1.はじめに
2018年度の抜本改革など近年の薬価制度改革は、「国民皆保険の持続性」と「イノベーションの推進」を両立し、国民が恩恵を受ける「国民負担の軽減」と「医療の質の向上」を実現1)する観点から実施されている。概ね、前年末頃、明らかとなる制度改革骨子を基に1月中旬には新たなルールが確定し、それを受けて、4月以降の新たな値付け(収載時薬価の決定)や薬価改定がすみやかに実施される仕組みとなっている。
2018年4月以降2021年9月までに収載された新薬については、2018年度の抜本改革の内容が明らかとなった時点では、すでに開発の後期段階もしくは承認、薬価収載が近い状況であったことが推測され、収載時薬価も何らかの影響を受けている可能性がある。
そこで本稿では、公開情報を用いて、新薬の薬価収載状況を見つつ、収載時の薬価などにおいてみられる抜本改革の影響を調査、考察することにした。
2.抜本改革における着眼点
収載時の薬価などにおいてみられる抜本改革の影響を調査、考察する上で鍵となる、新薬創出・適応外薬解消等促進加算(以降、新薬創出加算)の抜本的見直し、新薬のイノベーション評価の見直し、外国平均価格調整の見直しについて、「平成30年度 薬価制度の抜本改革の概要」2)を参照し、改定概要を示しておく。
2.1.新薬創出加算の抜本的見直し
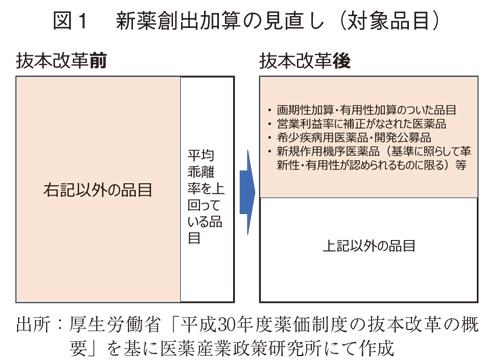
抜本改革では、新薬創出加算は、「乖離率(市場実勢価格と薬価の差)が平均以下という従来の品目要件を撤廃し、対象品目を希少疾病用医薬品、収載時に有用性加算などを取得した医薬品、新規作用機序の医薬品などに限定することになった。3)(図1)これにより、画期性加算や有用性加算の取得など、新薬のイノベーション評価がなされるかどうかは、収載時薬価のみならず収載後の薬価にも影響することとなった。
2.2.新薬のイノベーション評価の見直し
抜本改革前は、類似薬効比較方式では、薬価全体に対して、革新性、有用性などの観点から必要に応じて補正加算を適用していたが、原価計算方式では、営業利益部分に対して、革新性、有用性などの程度に応じて-50%~+100%の範囲で補正を行っていた。原価計算方式が適用される医薬品は、革新的な医薬品も含まれるにもかかわらず、そのイノベーションに関する評価は、類似薬効比較方式と比較して、薬価全体に対して限定的であった。そのため、革新的医薬品のイノベーションの適正な評価を確保するため、類似薬効比較方式と同様に原価計算方式においても、価格全体(加算前の算定薬価)に加算が行われることになった。ただし、薬価算定の透明性を向上させる観点から、原価計算方式において、製品総原価のうち、薬価算定組織での開示が可能な部分の割合(開示度)に応じて、加算率に差(加算係数)を設ける変更もなされた。加算額は、価格全体(加算前薬価)、加算率(0~120%)、加算係数(0.2~1)の積で算出されるが、開示度が80%以上であれば加算係数は1となり、加算率満額が適用されるが、開示度50%以上80%未満で0.6、50%未満で0.2となり、加算率は6割、2割に低下する。以降、加算係数を乗じた加算率を実質加算率と記載する。加算の要件については、類似薬効比較方式における加算要件を準用(ポイント制4)も準用)することになった。
2.3.外国平均価格調整の見直し
外国で既に販売されているものについて、外国価格との差が大きいものについては、一定の割合でその差を縮めるよう調整することとされている。
その際、参照する外国価格は、日本と同様の新薬創出力・市場規模のある国として、米国、英国、フランス、ドイツの4か国の平均価格としている。
抜本改革では、参照している米国価格表をメーカー希望小売価格であるRED BOOK から、公的医療保険制度メディケア・メディケイドにおいて採用されている価格表であるASP 及びNADAC5)に変更した。また、原価計算方式、類似薬効比較方式のいずれの算定においても外国平均価格調整を適用することとしていたのに対し、類似薬効比較方式においては、公正な市場競争を確保する観点から、外国平均価格調整を適用しないこととし、原価計算方式により算定される新薬、薬理作用類似薬が存在せずに、類似薬効比較方式により算定される新薬について、外国平均価格調整を適用することになった。さらに、外国価格のうち、最高価格が最低価格の3倍を上回る場合、最高価格を除外することとしていたのに対し、最高価格が最低価格の2.5倍を上回る場合には、最高価格を除外する変更がなされた。

3.調査方法および分析の切り口
2018年4月に行われた抜本改革を起点に前後3.5年ずつ、2014年10月以降2021年9月までの7年間に新薬として収載された新薬(再生医療等製品を除く全365成分)について、抜本改革前(171成分)と抜本改革後(194成分)に分けて、調査・分析した。6)2014年10月から2018年3月まで収載分を抜本改革前、2018年4月から2021年9月まで収載分を抜本改革後として、承認、収載時薬価に関する情報(薬価算定方式、有用性系加算および補正加算、外国平均価格調整、不服申し立ておよび収載遅れ)について、審査報告書、中央社会保険医療協議会(以降、中医協)資料7)などからデータを取得した。
なお、薬価制度改革は2年に1度行われており、その都度多くの変更がなされる。そのため、一概に比較できない点もあるが、本調査は抜本改革を中心に収載時薬価に注目して調査・分析するものであることは事前に提示しておく。(表1)
次に、分析の切り口を3.1から3.4で示す。
3.1.薬価算定方式
日本では、効能・効果や薬理作用、組成及び化学構造、投与形態などが最も似ている最類似薬を基準に、類似薬との比較に基づく類似薬効比較方式Ⅰ、もしくは類似薬効比較方式Ⅱ(新規性に乏しい場合)が適用される。また、類似薬がない場合は原価計算方式が適用される。
本稿では、薬価算定方式について、最近の傾向と抜本改革の影響があったかどうかを見ていく。
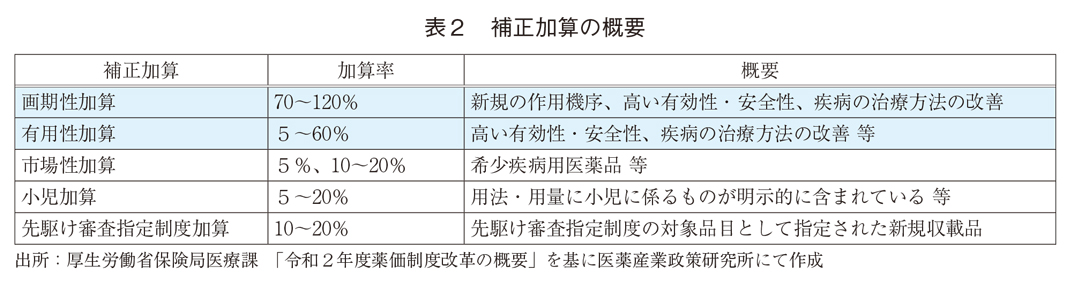
3.2.有用性系加算および補正加算
類似薬に比較し高い有用性などが認められる場合には、補正加算(画期性加算、有用性加算、市場性加算、小児加算及び先駆け審査指定制度加算)が適用される。(表2)本稿では、有用性系加算(本稿では、画期性加算および有用性加算をまとめて有用性系加算と記載)の適用状況、補正加算の加算率および適用数の状況を把握することで、抜本改革前後および最近の新薬のイノベーションとその評価の変化についてみていく。抜本改革前後で、加算要件には大きな変更がなかったので、その適用件数は主として有用性の高い新薬の創出頻度の動向を示すと考えられる。他方で、加算率の変化は原価計算方式対象の新薬については、平均的な有用性の変化とその評価制度の変化の両方を反映している。
3.3.外国平均価格調整
本稿では、抜本改革前後および最近の外国平均価格調整適用状況と収載時薬価の対外国平均価格の変化についてみていく。
抜本改革によって、米国の参照価格変更やそれに伴う最高価格の除外基準の引下げ、薬理作用類似薬が存在する類似薬効比較方式の場合、調整対象としないこととするなどの変更がなされた。その結果、外国平均価格調整の対象となる新薬数が減少、収載時薬価は外国価格に比べて低下している可能性があるのではないかと推測される。
3.4.不服申し立て及び収載遅れ
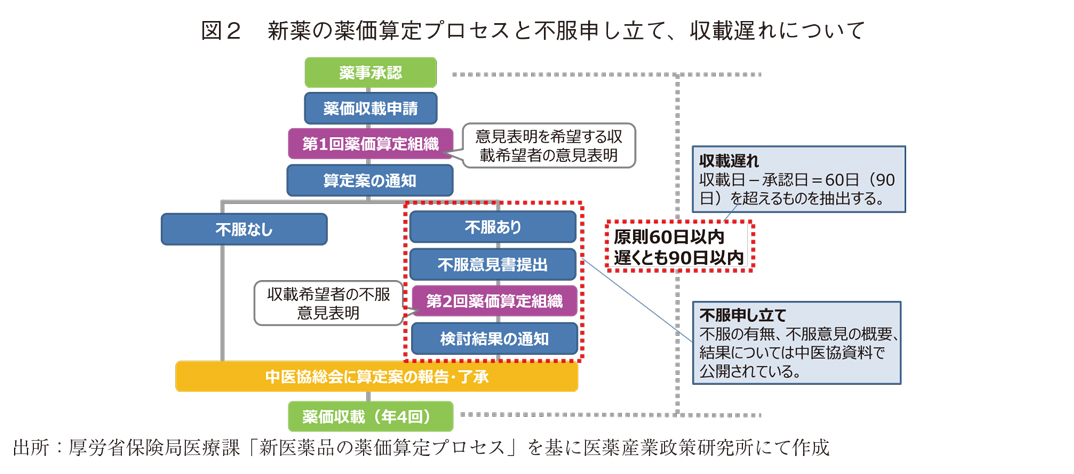
新薬の薬価算定プロセスや不服申し立て、収載遅れについては図2を参照されたい。
新薬の薬価を決める際、製薬企業は「薬価基準収載希望書」を厚生労働省(以降、厚労省)に提出する。その後、厚労省が薬価の原案を作成し、有識者で構成する薬価算定組織で算定案を決めて、企業に内示薬価の通知がなされる。製薬企業の不服がない場合、厚生労働大臣の諮問機関である中医協で了承されれば、薬価収載となるが、不服がある場合は不服申し立ても可能となっている。これが提出されると、再び薬価算定組織が開かれ、製薬企業から意見を聞いた上で原案の修正を検討する。その後は、検討結果を企業に通知し、中医協で了承されれば薬価収載される。不服意見に対する検討結果も受入れられない場合、製薬企業は薬価収載を見送って厚労省と交渉を続けたり、薬価収載希望書を取り下げることも可能となっている。多くの場合は、標準的な事務処理期間とされる承認から原則60日以内、遅くとも90日以内に収載されるが、遅れる事例(収載遅れ)も一定数存在する。
本稿では、抜本改革前後および最近の不服申し立てや収載遅れ状況についてみていく。
4.調査結果の概要
4.1.薬価算定方式
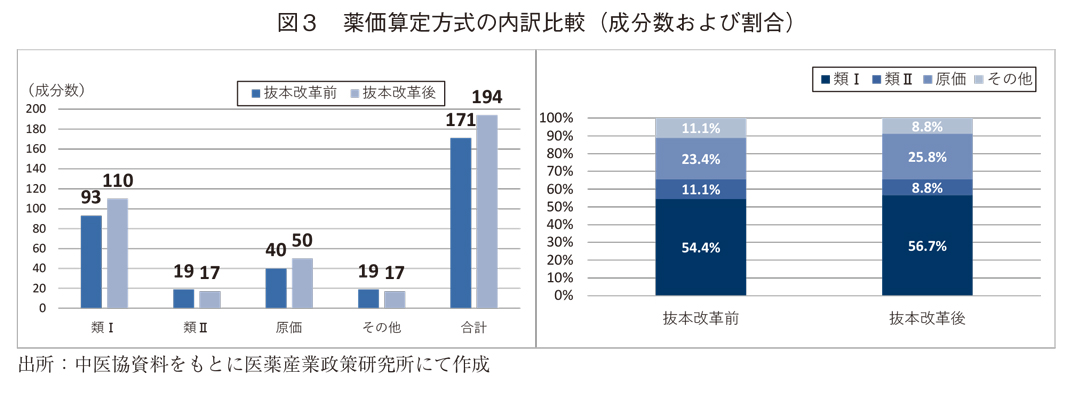
類似薬効比較方式Ⅰが54.4%(抜本改革前)から56.7%(抜本改革後)、原価計算方式が23.4%(抜本改革前)から25.8%(抜本改革後)と上昇したのに対し、新規性の低い薬剤が対象となる類似薬効比較方式Ⅱおよびその他の算定方式はいずれも11.1%(抜本改革前)から8.8%(抜本改革後)とわずかに低下していた(図3)。薬価算定方式の内訳については、抜本改革前後で大きな違いは見られず、また過去に示された傾向8)とも類似していたことから、近年での大きな変化はない。
4.2.有用性系加算および補正加算
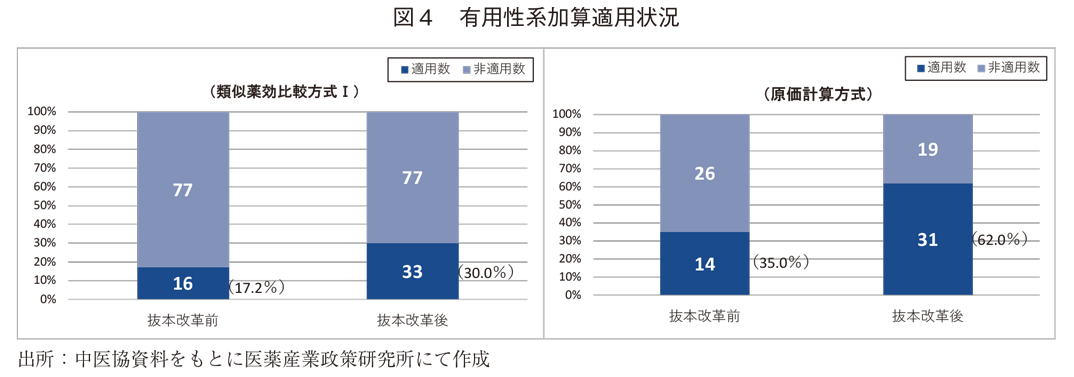
まず、有用性系加算の適用状況(図4)は、類似薬効比較方式Ⅰでは17.2%(抜本改革前)から30.0%(抜本改革後)、原価計算方式では35.0%(抜本改革前)から62.0%(抜本改革後)に、いずれも上昇していた。抜本改革前は、営業利益部分に対して、革新性、有用性などの程度に応じて-50%~+100%の範囲で補正を行っていた原価計算方式については、加算的補正がなされたものを適用有として含めている。
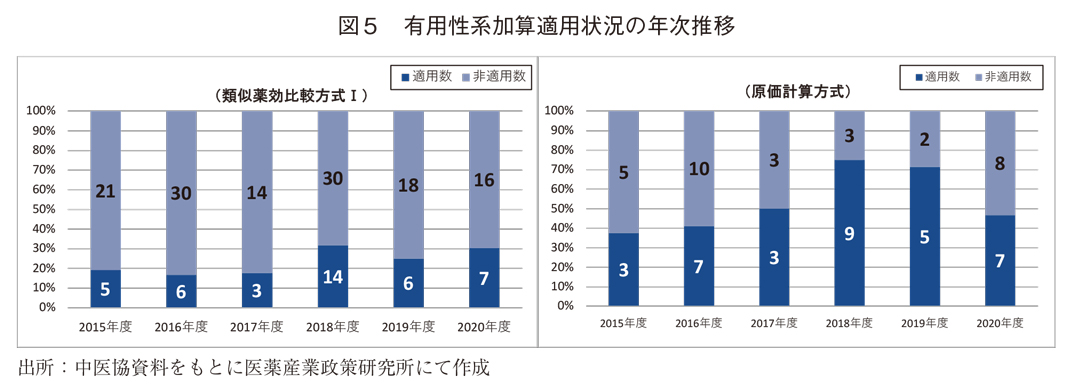
また、年度全ての収載分を網羅する2015年度から2020年度までの年度ごと有用性系加算適用状況の推移(図5)をみると、年度ごとの高低はあるものの、類似薬効比較方式Ⅰ、原価計算方式ともに上昇傾向がみられた。
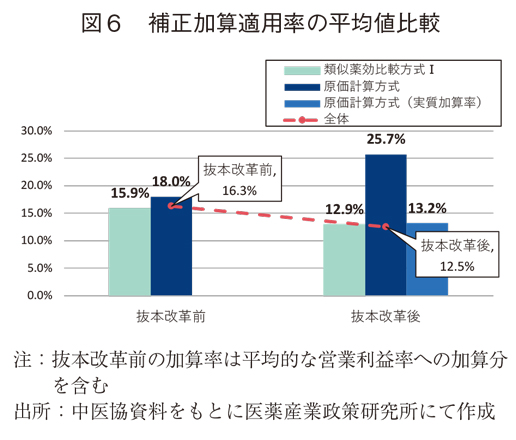
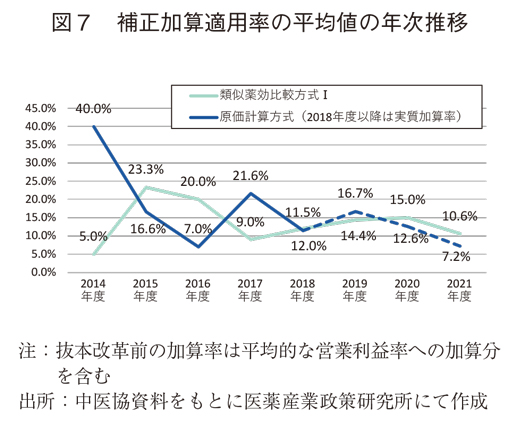
次に、補正加算の適用状況を、平均値の比較でみていく(図6)。類似薬効比較方式Ⅰでは15.9%(抜本改革前)から12.9%(抜本改革後)に3.0%低下していた。原価計算方式では18.0%(抜本改革前)から25.7%(抜本改革後)に上昇していたものの、実質加算率は13.2%と抜本改革前に比べて4.8%低下していた。また、補正加算の適用状況を平均値の年次推移(図7)で見ても、抜本改革後では平均値が低下傾向であった。
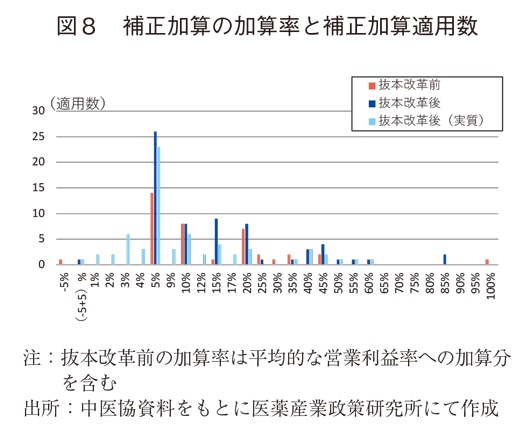
図8では、補正加算の加算率と補正加算適用数の関係を示しているが、抜本改革前後のいずれも加算率としては最も低い5%に多くが集中しており、抜本改革後の実質加算率は低下していた。
4.3.外国平均価格調整
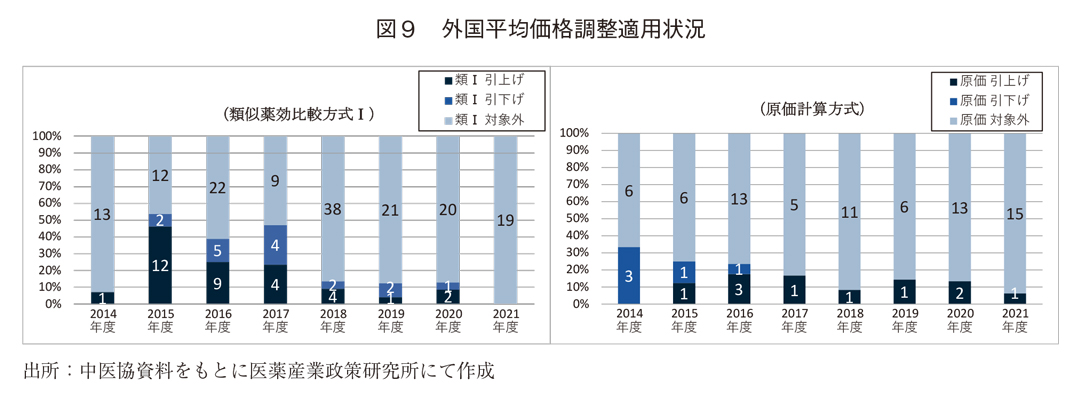
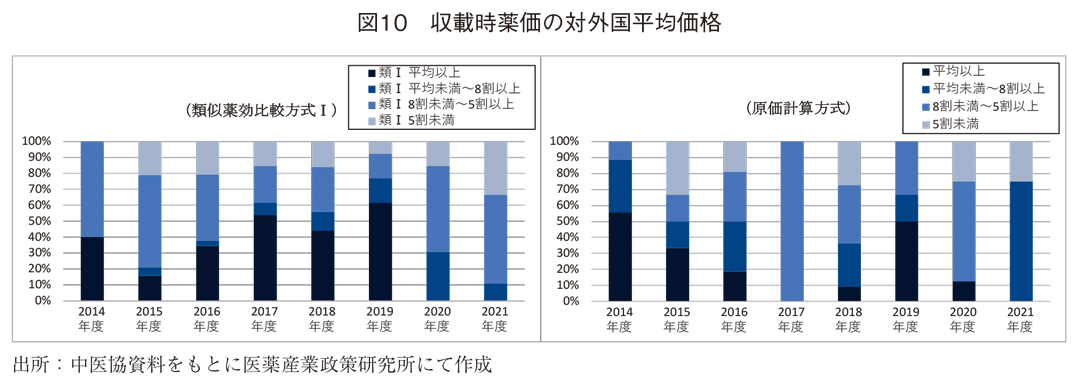
図9では、外国平均価格調整の適用状況を示している。引上げ、引下げ共に継続的に低下傾向にあり、抜本改革後も低下していた。また、図10に示す通り、収載時の薬価が外国価格(参考価格として記載される薬価を含む)と比べて低い傾向があり、その傾向は特に2020年度以降で高まっていた。
4.4.不服申し立ておよび収載遅れ
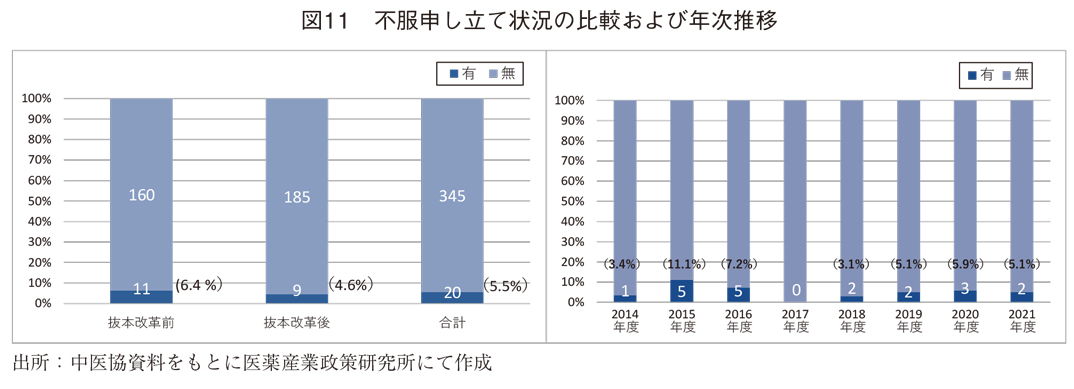
当初算定案に対する不服申し立てを行った新薬は6.4%(抜本改革前)から4.6%(抜本改革後)に低下したが、いずれも11成分および9成分と少ないことから、その間の年次推移を見てみた。(図11)いずれの年度においても事例は少なく、近年の低下および上昇傾向も見られなかった。
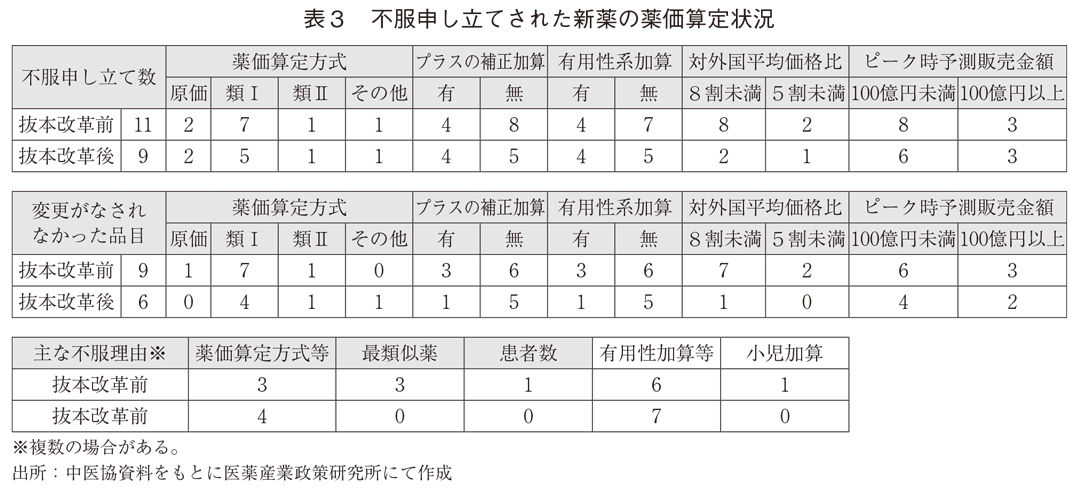
不服申し立てを行った新薬をいくつかの切り口からみると、表3のとおりであった。内訳を見ると、当初算定案から何らかの変更がなされたものは抜本改革前で2成分、抜本改革後で3成分の計5成分(25%)であり、不服申し立てを行ったものの多くは収載時薬価の変更がなされずに薬価収載されている。
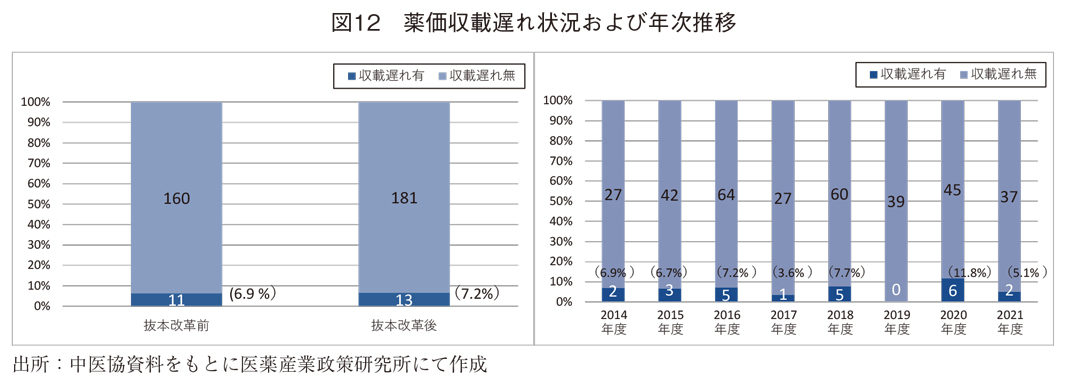
収載遅れは、6.9%(抜本改革前)から7.2%(抜本改革後)とわずかに上昇していたが、いずれも11成分および13成分と少ないことから、その間の年次推移を見てみた。(図12)いずれの年度においても事例は少なく、近年の上昇および低下傾向も見られなかった。
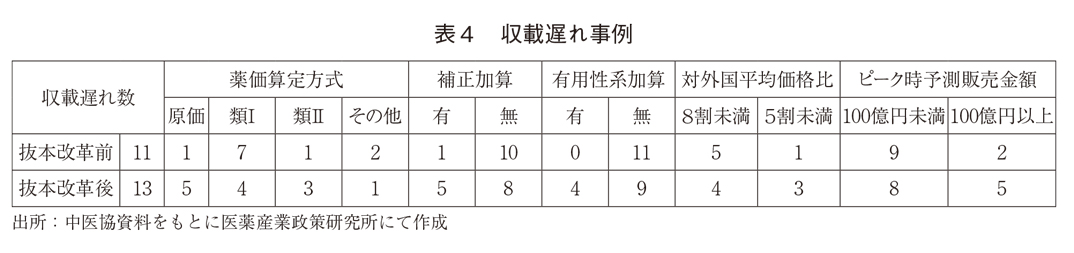
不服申し立てされた新薬をいくつかの切り口からみると、表4のとおりであった。
5.考察
革新的な新薬のイノベーションとその評価
有用性系加算適用数は、原価計算方式、類似薬効比較方式Ⅰのいずれにおいても、抜本改革前に比べて抜本改革後で上昇していた。補正加算のつけ方や加算要件に大きな変更がない類似薬効比較方式Ⅰでも、原価計算方式でも抜本改革後に適用数が上昇していたことや、年度ごとの有用性系加算適用医薬品数の推移において特に類似薬効比較方式Ⅰでは明確な上昇傾向が見られたことを踏まえると、類似薬と比較して有用性の高い新薬へシフトしてきていると考えられ、近年の革新的新薬創出への取り組みが一定の成果を上げていることが確認された。
一方で、抜本改革前後で原価計算方式の新薬について加算率を比較すると、実質加算率の低下が起きており、これは、イノベーションを評価する加算よりも、透明化する要素で導入された開示度に応じた加算係数の加算率低下への影響が大きく寄与した結果だと推測される。抜本改革によって目指されたイノベーションの薬価による適正な評価は、更なる改善の余地があるのではないか。
製薬企業の予見性、納得性と患者アクセス
原価計算方式において、製品総原価のうち、薬価算定組織での開示が可能な部分の割合(開示度)に応じて、加算率に差を設ける変更がなされたことにより、実質の補正加算率は約4%低下していた。抜本改革前の営業利益率への加算相当分と抜本改革後の加算率相当分を単純に比較することはできないものの、加算適用率が低下していることは、開示度が80%未満である、つまり、開示が難しい事例が一定数あることを意味している。医薬品産業ビジョン2021に記載される通り、製薬企業は原価の算定根拠などを厚労省に示し、算定の透明性に協力する責務がある。一方で、医薬品の研究開発・製造のグローバル化が進んだなかでは、他企業が海外で製造した新薬について、国内の自社製造と同水準の原価内容の開示を求めることは、基準や考え方の違いなどから理解が得がたい場合があることにも留意が必要である。
外国平均価格調整に関しては、抜本改革によって調整対象となる新薬が減っており、収載時薬価が外国に比べてより安くなっている傾向がある。これらは諸外国から見た日本市場の魅力に影響し、ひいては、アクセスラグにもつながりかねない問題である。
不服申し立ておよび収載遅れのいずれにおいても事例が少なく、抜本改革前後および近年での上昇、低下傾向があったとは言えない。
しかし、不服申し立て事例の多くは薬価などの変更が一切なされておらず製薬企業にとっては納得性が低い状況で薬価収載に至っていると言える。
収載遅れ事例については、その理由を公開資料から確認することはできない。薬価交渉に起因する場合もそうでない場合もある。また、最終的な収載時薬価などへの製薬企業の納得性もわからない。
しかし、抜本改革後の収載遅れ事例では、原価計算方式で算定された新薬に多く、有用性系加算が適用されたものが多い、外国平均価格に比べて安いなどの傾向がみられた。革新的新薬の有用性の程度や、原価計算方式の開示度、外国価格との乖離に関して、企業側の予測と行政側の認識のずれに起因している可能性がある。
日刊薬業を用いた著者の調べでは、2016年収載のトルツ以降、薬価交渉が原因でいくつかの収載遅れが生じ始めており、抜本改革後は3成分(イストダックス、パルモディア、バクスミー)について、企業自らが薬価交渉に起因することを公表していた。イストダックスは、「希少疾患であるPTCL(再発・難治性末梢性T 細胞リンパ腫)に対するこの薬の価値を理解していただくためには行政側との対話が必要と考え収載を見送った」9)とされるが、収載までの間、早期使用に対する医療現場からの要望に応えることを目的とし、倫理的観点から無償にて薬剤を供給するプログラムを実施するなどしてアクセスに配慮した対応をしている。10)
今後も、革新的な新薬を早期に確実に患者に届けるためには、企業側と行政側の価値のすり合わせと予見性の向上が重要である。
6.おわりに
本稿では、新薬の薬価収載状況を見つつ、新薬の薬価収載時点においてみられる抜本改革の影響を、公開情報を用いて調査・考察した。
本調査を実施し、国民に見える薬価に関する情報が極めて限定的であるということを、あらためて感じた。その医薬品の価値の評価において重要な要素の一つである薬価情報だが、よりどころとなる公開情報は中医協資料しかない。11)「医薬品は、国民の健康に関する商品である以上、その価値は価格だけではなく、今後は患者や医療現場に信頼され選ばれるという視点がより一層重要となる。」12)なかで、算定薬価や有用性加算の程度の大小だけでなく、薬価の根拠となる価値や評価の具体的内容を明らかにし、国民に理解してもらうべきではないだろうか。
また、近年の革新的な新薬の創出が見られる中で、イノベーションがもたらす価値は変わりうるため、その価値の評価は制度と共に変わって当然である。しかし、製品総原価のうち開示が可能な部分の割合が低ければ、加算率を小さくする仕組みは正しいのかどうか、国民的な議論が必要ではないか。
製薬企業にとって予見性のない制度改革は、事業の予見性を揺るがすこととなり、一定数の不服申し立てや収載遅れにつながっている。このような制度改革が続けば、患者アクセスにも影響しうる。日本は世界に誇る患者アクセスの早さと保険償還カバー率13)であることを忘れてはならない。
我が国における医療に革新的な新薬が早期に確実に導入されるよう、建設的な薬価制度改革議論がなされ、日本市場の魅力がより一層高められる薬価制度となることを期待する。
-
1)
-
2)
-
3)加えて、「企業指標」として新薬開発などの取り組みを企業ごとに点数化し、それに応じて加算率に差をつける仕組みも導入された。
-
4)
-
5)ASP:Medicare Part B Drug Average Sales Price、NADAC:National Average Drug Acquisition Cost
-
6)同一投与形態、同一効能効果は1として、中央社会保険医療協議会総会「新医薬品一覧表」に基づきカウント。
-
7)中央社会保険医療協議会総会「新医薬品一覧表」(第286回~第485回)、厚生労働省
-
8)内閣府政策統括官、「【第13回】調剤・薬剤費の費用構造や動向等に関する分析-薬剤費と医薬品開発-(平成29年8月25日)」、内閣府
薬価算定方式別に成分数の年次変化をみると、ばらつくものの、類似薬効比較方式Ⅰが全体の50~60%前後、原価計算方式がおおむね20~30%前後で推移しており、収載成分の算定方式別割合にはあまり大きな変化はみられないと報告されている。 -
9)「薬価収載見送り、大型化期待「パルモディア」交渉折り合わず、発売は3カ月以上延期」、日刊薬業(参照:2021/10/01)
-
10)「イストダックス点滴静注用10mg 薬価基準収載前の薬剤供給プログラムに関するお知らせ」を参照
-
11)中央社会保険医療協議会は2020年12月、薬価算定組織などの委員名簿や議事録などを公開することを決定し、名簿は2021年1月より、議事録などは2021年9月より厚生労働省ホームページで公開されている。
-
12)
-
13)Millson.B,et al." Access to New Medicines in Public Drug Plans: Annual Report 2016"、主要18か国の中で日本はアクセスが最も早く、保険償還カバー率も最も高いことが示されている。(参照:2021/10/01)

