Points of View 新薬における創薬モダリティのトレンド 多様化/高分子化の流れと、進化する低分子医薬
医薬産業政策研究所 主任研究員 高橋洋介
はじめに
ここ数年、医薬品の分野では「創薬モダリティ/医薬モダリティ」という言葉を頻繁に見聞きするようになってきた。モダリティとは元来「様式」「様相」などを意味する用語であり、医療機器の分野においてはMRI(磁気共鳴診断装置)やCT(コンピュータ断層撮影装置)などの機器の種別を表す用語として以前より用いられていた。近年、多様な創薬基盤技術を用いた研究開発により、低分子医薬だけでなく、抗体医薬をはじめ、核酸医薬や遺伝子治療薬のような様々な分子(中分子~高分子)が医薬品として実用化されはじめた。このような状況下、これら医薬品の創薬基盤技術の方法・手段の分類を表す用語として「創薬モダリティ/医薬モダリティ」が用いられるようになってきた。本稿においては、特に断らずに「モダリティ」とのみ記述することとする。
昨今、世界中で大流行している新型コロナウイルス感染症(COVID-19)においては、その終息を目指して、世界中の様々な製薬企業や研究機関が、最新の科学技術を駆使して革新的な治療薬やワクチンの研究開発を行っている。アストラゼネカ社/オックスフォード大学やジョンソン・エンド・ジョンソン社はウイルスベクターを用いたワクチンを、ノババック社は組換えタンパクを用いたワクチンを開発した。ファイザー/ビオンテック社やモデルナ社が開発したmRNAワクチンは、他の医薬品での実用化例のなかった新規モダリティが活用されたものであり、これらは極めて短期間で実用化に至ったことも含めて注目を集めている。これらワクチンは、従来型ワクチンとは異なり、新たな創薬基盤技術により開発した新規のモダリティとも言え、創薬基盤技術の重要性を改めて認識する事例である。
このような背景の中、令和3年6月に「ワクチン開発・生産体制強化戦略」1)が閣議決定されている。ここでは、新型コロナウイルスワクチンの国内での研究開発が欧米諸国に比べて後塵を拝している現状を踏まえ、課題の整理と解決策に関して議論が行われており、新規モダリティの研究開発を一層推進する必要性が確認された。つまり、がんワクチンや遺伝子治療、核酸医薬等の新規モダリティを活用した研究開発を推進し、多様なモダリティを育成・保持しておき、有事の際にはこれら技術を転用し、迅速な医薬品やワクチン開発を可能とする体制構築が重要であると指摘されている。
ワクチンなど感染症領域以外の医薬品においても、近年は抗体医薬をはじめとした、核酸医薬、遺伝子治療薬、細胞治療などの新規モダリティを用いた医薬品開発が世界的なトレンドとなってきている2)。これは従来の低分子医薬では狙うことが困難であった創薬標的に対し、それらに作用できる分子として新規モダリティが見出され、実際に医薬品として利活用されるようになった実状を反映していると考えられる。
令和3年9月13日に厚生労働省より発出された「医薬品産業ビジョン2021」3)では、日本の医薬品産業が感染症対応も含めたアンメットメディカルニーズに応えられるだけの創薬力を維持・強化し、革新的医薬品を含めたあらゆる医薬品を国民に安定的に供給し続ける状態を、目指すべき姿として記載されている。そして、このビジョンを実現するための一つの要素として、多様化・複雑化するモダリティの研究開発が重要であるとしている。
このように、多様な新規モダリティが加速度的に実用化されていく状況のもとで、本稿においては承認薬におけるトレンドをモダリティの観点から概観するとともに、従来型のモダリティである低分子医薬も含めて今後の展望について考えてみたい。
新規承認医薬品におけるモダリティの動向
新規承認医薬品におけるモダリティのトレンド分析として、EvaluatePharmaを用いて、日米それぞれにおけるNME(新規有効成分)の承認品目数を調査し、モダリティ別に評価した。NMEのモダリティの分類区分はEvaluatePharmaにおける技術分類をもとにモダリティを分類し4)、FDA Approval Date及びJapan Approval Date(indication)より抽出した日付を用いて、承認品目数の年次推移を分析した。なお、ここでは近年注目を集めるCOVID-19ワクチンなどはワクチン類に優先的に分類されており、組換えタンパクや遺伝子治療などに分類されていない点に留意されたい。
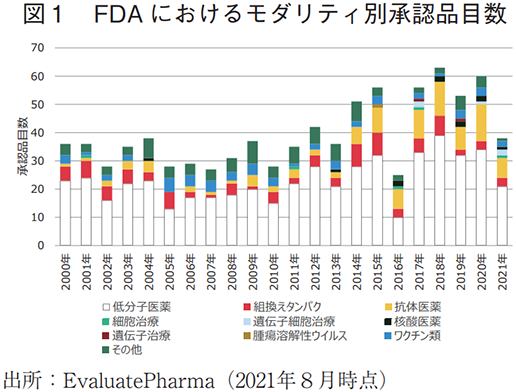
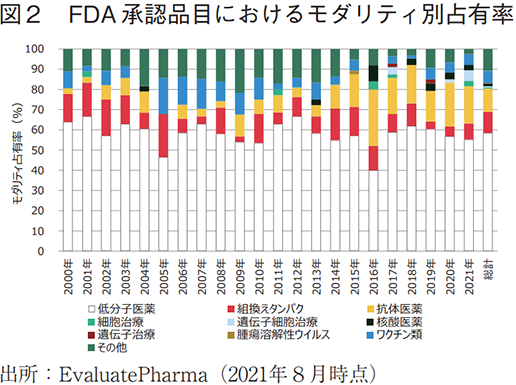
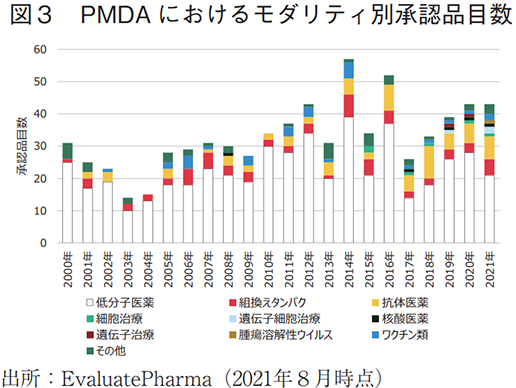
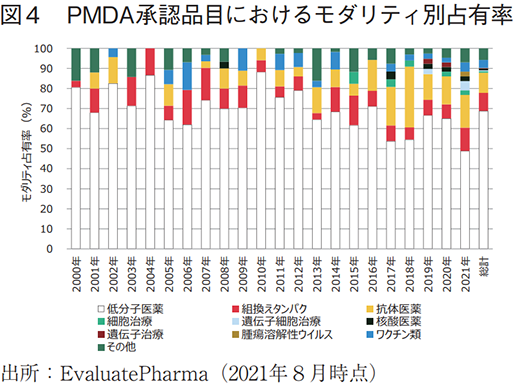
2000年以降の米国におけるモダリティ別承認品目数を図1に、当該年度の承認品目におけるモダリティ別占有率を図2に示した。また同様に日本における承認状況を図3及び図4に示した。
米国での全承認品目数は、2000年代には30品目前後で推移しているが、その後徐々に増加傾向にあり、近年では年50~60品目程度の推移で承認されている。2000年以降では、いずれの年においても低分子医薬が最大の割合を占めるモダリティで、常時60%前後で推移しており、依然として中心的なモダリティであることが確認できる。なお、鍵井のリサーチペーパーでは、医薬品の販売額の指標では低分子医薬の割合が減少傾向にあることが報告されている2)。承認品目数と販売額におけるギャップについては、バイオ医薬品でブロックバスターが増加していることが一つの要因であろうと考察しており、このデータについては本ニュースにおいて中尾が詳細に紹介・考察しているため5)、そちらを参照いただきたい。
低分子医薬に次ぐモダリティは、2000年代初頭は組換えタンパクであったが、その後徐々に抗体医薬の承認品目数が増加し、2015年頃より抗体医薬が低分子医薬に次ぐ割合の大きなモダリティへと成長している。核酸医薬、遺伝子治療、遺伝子細胞治療などの新規モダリティの承認品目数は増加傾向にあり、2015年までにそれぞれ2、0、0品目の承認実績だったのが、2016年以降にはそれぞれ9、2、5品目が承認されており、モダリティの多様化が確認できる。
日本では、2000年代初頭には低分子医薬の占める割合が80%前後であり、米国に比して大きな数値であった。日米差の主たる要因は、組換えタンパクの日本での承認件数が少ないことに起因しており、この当時バイオ医薬品におけるドラッグラグ3~5年程度存在していたこと6)が本データからも見て取れる。直近5年間で見ると、日米ともにほぼ同様のモダリティ占有率となっており、低分子医薬が60%前後であり、それに次いで抗体医薬の割合が大きい。
モダリティ毎の作用機序のトレンド
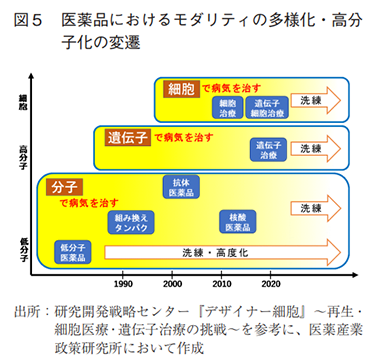
従来は低分子医薬が医薬品の中心的な位置づけであったが、そこから組換えタンパクや抗体医薬など新規モダリティの実用化研究が進んだ背景には、従来型の低分子医薬ではアプローチ困難であった創薬ターゲットに対しても、ターゲットを拡大出来たからであろう(図5参考)。様々な新規モダリティが実用化され始めている流れは確認できたが、新規モダリティには医薬品として開発する上での不確実性(特に、安全性、品質管理、レギュレーションなどにおける不確実性)があり、また新規モダリティを含むバイオ医薬品群には製造コストの高さなどにも課題がある。本稿では、近年実用化された新規モダリティを、医薬品としての実績の多い低分子医薬などのより小さな分子に基づく医薬品で置き換えるような事例や兆候がないか調査を行った。
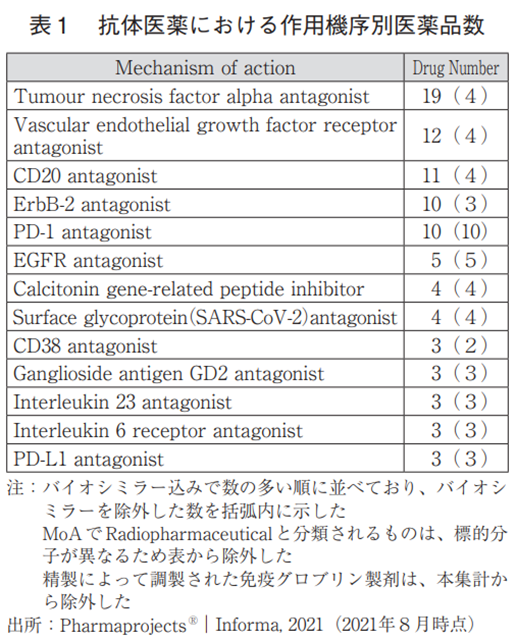
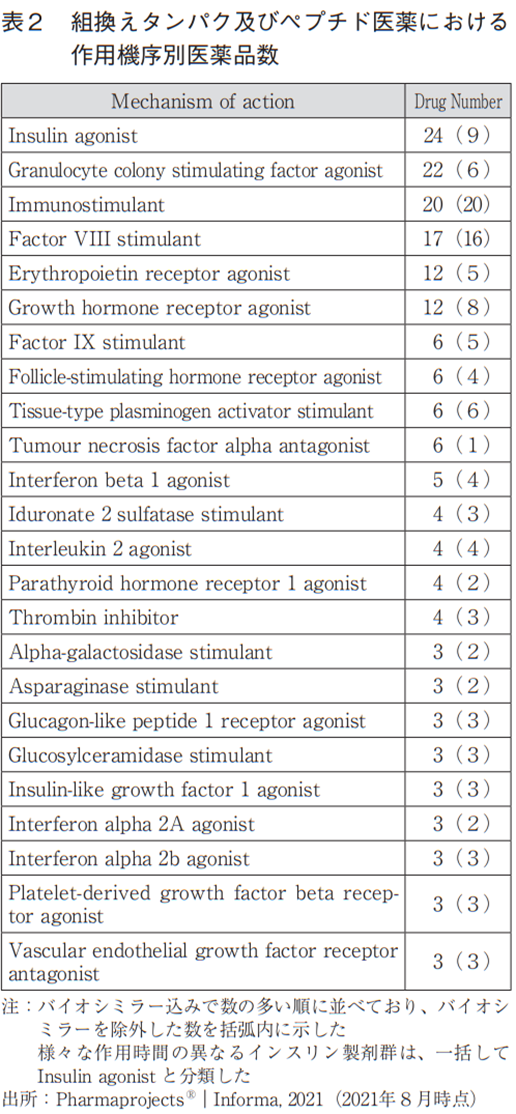
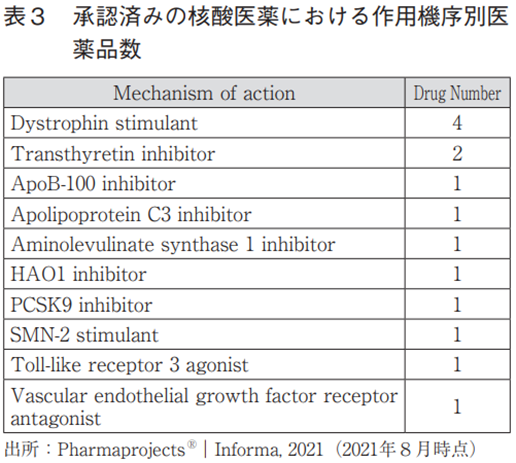
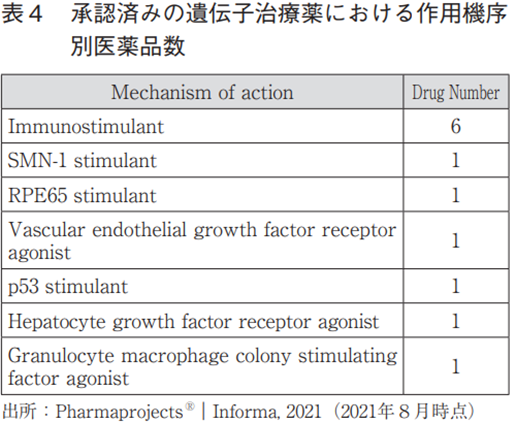
まず、Pharmaprojectsを用い、実用化例の比較的多いモダリティとして⑴抗体医薬、⑵組換えタンパク及びペプチド医薬、⑶核酸医薬、⑷遺伝子治療の4つを取り上げ、承認済みの医薬品のMoA(Mechanism of Action)を調査した。なお、本データベースの収載国のいずれかで承認されている医薬品を抽出し、⑴及び⑵については少なくとも日米のいずれかで開発されたもの(開発中のものも含む)に限定した。⑴~⑷に関して、承認品目におけるMoAのランキングを作成し表1~表4に示した。なお⑴及び⑵については、バイオシミラーに該当する医薬品が多数存在するため、バイオシミラーを除いた数も調査した。
抗体医薬
抗体医薬は現在では100を超える新薬が承認されており7)、8)、その中ではTumour necrosis factoralpha antagonist、Vascular endothelial growthfactor receptor antagonist、CD20 antagonist、ErbB-2 antagonistなどのMoAが上位を占めているが(表1)、これらの大半はバイオシミラーであった。これらはいずれも2000年前後にファーストインクラスの薬剤が承認されたMoAであり、医療上の必要性・重要性が高いことから複数のバイオシミラーが登場してきていると考えられる。バイオシミラーを除いた場合、もっともNMEが多いのがPD-1 antagonistであり合計10品目ある。このうち日米いずれかで承認されているのは4品目のみであり、その他6品目は中国でのみ承認されている状況である。ただし、これら6品目はいずれも米国で申請中もしくは臨床試験実施中であるため、将来的には多くのPD-1阻害剤が上市されるものと想定される。また、MoAとして個々に異なるために表中には出てこないが、複数の抗原に結合能を持つバイスペシフィック抗体が計5品目、機能性の分子(主に低分子化合物)を結合させた抗体薬物複合体(ADC:Antibody-drug conjugate)が多数存在しており、ADCの中には殺細胞作用を有する化合物を結合させたもの、放射性物質を結合させたものなどが複数例存在している。
組換えタンパク・ペプチド医薬
このカテゴリーに属するバイオ医薬品の歴史は古く、1980年代からinsulin agonist、growth hormone receptor agonist、erythropoietin receptoragonist、interferon agonistなど複数のMoAにおいて承認された医薬品が存在しており、表2にあるように、これらに共通する性質としてアゴニスト様に働く生理活性タンパク質という特徴がある。疾患のメカニズムが解明され、生理活性物質の量的欠損によって生じることが明らかになった場合には、当該タンパク質を補充するというMoAは非常に理にかなっている。またNME数として最も多いのがImmunostimulantであり、これは組換えタンパクとして作製した抗原を用いワクチンとして活用している例であり、B型肝炎やインフルエンザなどのワクチンとして実用化されている。次にNME数として多いのはFactor VIII stimulantであり、血友病Aに治療薬として承認されているものである。
またこのカテゴリーで特徴的なのは、天然の生理活性物質から様々な改良が施された医薬品が多数存在していることであり、他のモダリティに先駆けて改良がなされてきている。アミノ酸配列を改良し天然型に比べて機能を向上させたもの、PEGを始めたとした機能性分子を付加されたもの、抗体医薬の一部もとに創製されたもの(特に抗原結合部位など)など、モダリティとして発展を遂げている。抗体医薬との境界に位置すると考えられるようなモダリティや組換えタンパクと抗体医薬を結合させたモダリティなども登場してきており、モダリティの多様化が進んでいる。
核酸医薬
これまでに承認された核酸医薬は計14品目(表3)ある。MoAに注目すると、Dystrophin stimulantが4品目存在している点が目立っており、Transthyretin inhibitorも2品目存在している。Dystrophin stimulantというMoAを有する核酸医薬は、2016年にFDAで承認されたEteplirsenなどが存在している。このMoAは、アンチセンス核酸による標的遺伝子に対するエクソンスキッピング作用に基づき、機能を有する遺伝子発現量を高め、ひいては欠失していたタンパク発現量(この例ではDystrophinタンパク発現量)を補充することによって達成されるものであり、標的pre-mRNAに対する高い特異性と親和性を有する核酸医薬の特徴をうまく活かして創薬につなげた事例と言える。またTransthyretin inhibitorについては、変異型Transthyretinによって生じるアミロイドニューロパチーの治療薬であり、疾患の原因となる変異型タンパク質の生成を抑えるものである。これらに共通するのは、このMoAとしては核酸医薬が最初に実用化されたモダリティであるという点である。従来の低分子医薬ではアプローチ困難と想定されるターゲットであったが故に、最も適したモダリティとして核酸医薬が選択され、成功を収めたと事例であると言える。
遺伝子治療
ここの調査においては、ウイルスベクターやプラスミドベクター、もしくはmRNAを直接生体内に投与し、目的とする遺伝子を発現させるものを遺伝子治療をとして広く定義しているが9)、表4の通り実用化された数は多くはない。MoAで分類すると、COVID-19のワクチンとして実用化されたものが複数存在していることが分かる。それらについては、mRNAワクチン、ウイルスベクターワクチンと異なるタイプのモダリティを活用した例が複数存在する。ここでは示していないが、開発段階の品目も複数存在しており、COVID-19のみならず今後の新興感染症のワクチン開発において、このような遺伝子治療を活用する戦略は主流となるだろう。
COVID-19ワクチン以外では、現時点でMoAが共通している上市品は存在していない。既に一定程度の市場を築いているゾルゲンスマ(SMN-1stimulant)およびLuxturna(RPE65 stimulant、日本ではPhase3段階)を見ても分かる通り、先天性の単一遺伝子異常で発症する希少疾患をターゲットとしたものが上市されている。これらの医薬品の成功例を受けてか、Phase3段階ではMoAを同一とする開発パイプラインが複数存在している状況であり、今後さらに遺伝子治療というモダリティは拡大していくであろう。
同一MoAにおけるモダリティ間の競合調査
今回調査した4つのモダリティ毎にMoAのトレンドを見ていくと、同一のMoAに複数のモダリティが適応されている例が存在している。このような事例を詳細に調査するため、表1~表4に記載のすべてのMoAに関してPharmaProjectsで承認薬及び開発品の状況(他モダリティの有無や開発ステージ等)を対象に検索を行い、モダリティ間での競合の状況を検討した。紙面の都合から、特に興味深いと考えられた事例に関して以下に2例紹介する。
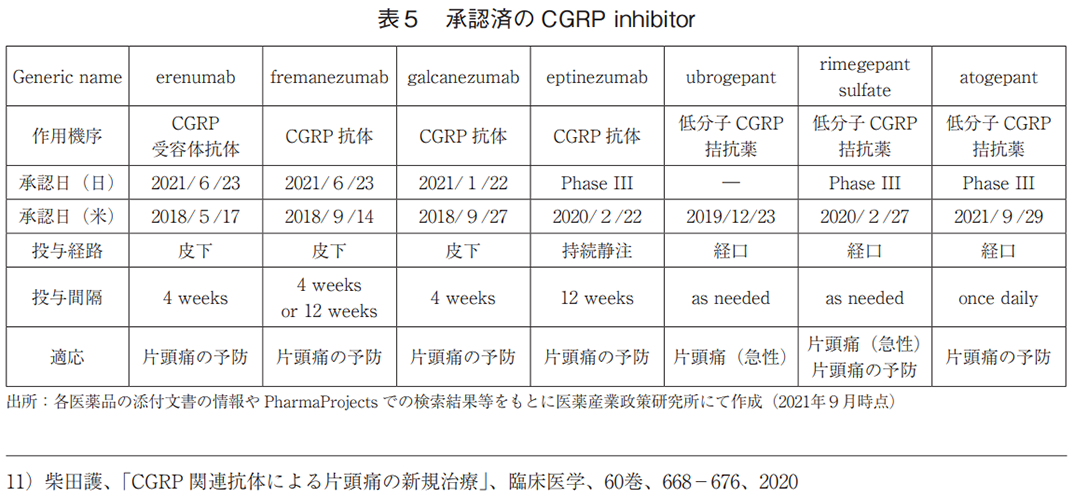
Calcitonin gene-related peptide inhibitor(CGRPinhibitor)での事例
抗体医薬においてCalcitonin gene-related peptide inhibitorには4つのNME(galcanezumab、eptinezumab、fremanezumab、erenumab)が存在しているが、これらはCGRP自体を中和してシグナルを抑制するもの、CGRPレセプターに結合してシグナルを抑制するものを含んでいる。このMoAを有する医薬品は、抗体医薬以外では低分子医薬が臨床段階以降に計5品目存在しており(2021年9月時点)、開発の進んでいる米国ではrimegepant sulfate、ubrogepant及びatogepantが承認されており、他ではzavegepant hydrochlorideがPhase3実施中という状況である。なお、これら低分子医薬はいずれも日本においては未承認である(表5)。
このMoAを有する医薬品の研究開発の歴史は古く、1999年に低分子医薬であるOlcegepantの臨床試験が行われ、片頭痛に対する発作頓挫作用が示されている10)。ただし本薬は静脈内投与で臨床試験が行われており、筆者の推測にはなるが、分子量が約870と大きいことに起因する薬物動態学的な特徴より、経口投与を選択出来なかったのではないだろうか。本薬は最終的には開発が中断されているが、その後複数の経口投与可能な低分子医薬が見出され、研究開発が行われていた。しかしこれら化合物についても、共通して肝毒性などに起因する安全性上の課題が生じ、研究開発は中断されている11)。その後、抗体医薬によるCGRPをターゲットにした研究開発が開始され、2018年にerenumabが承認されて以降、2020年までに計4品目の抗体医薬が承認されている。これらは、抗体医薬の標的選択性の高さに基づく安全性や長半減期という特徴を活かして、片頭痛に対して予防的に用いられており、用法は皮下投与または静脈内投与により一か月に一回または三か月の一回の投与となっているのが特徴である。抗体医薬に実用化で先を越されたものの、低分子医薬の研究開発も進行しており、2019年に前述の課題を克服したubrogepantが低分子薬として初めて承認された(日本ではいずれの低分子薬も未承認)。こちらは低分子医薬の特徴を活かした経口投与可能な薬剤であり、急性的な片頭痛の発作に対して頓服的に用いることが可能となっている。また、低分子薬として2番目に承認されたrimegepant sulfateは頓服的にも予防的にも使うことが可能であり、抗体医薬と同様の適応を持って使うことが可能となっている。
CGRP阻害薬が市場に登場したのはごく最近であり、今後各々の薬剤が片頭痛の治療や予防においてどのような位置づけの薬剤となっていくのかはまだ不透明である。同じモダリティ間においては比較的似た薬剤プロファイルを有している一方で、抗体医薬と低分子という異なるモダリティ間では大きくプロファイルの異なる薬剤となっている。薬効や安全性はもちろんのこと、用法用量や薬剤コストの差など、医薬品の持つ価値が総合的に判断され、片頭痛領域でモダリティの特性を活かした医療ニーズの充足が期待される。
SMA治療薬での事例
脊髄性筋萎縮症(SMA:spinal muscular atrophy)は、survival motor neuron(SMN)タンパク質の欠乏・欠失によって生じる、常染色体劣性遺伝の神経筋疾患である。生後まもなく進行性の筋萎縮や呼吸障害を伴い、重篤な症例では早期に死に至る疾患であった。近年、本疾患を適応に持つ画期的な新規医薬品が3剤上市されており、これら医薬品によって患者さんに福音がもたらされた。この3剤の作用機序は厳密には異なるものの、SMNタンパク質の機能を補充するという点で共通したものである。
スピンラザ髄注(以下、スピンラザ)は核酸医薬に分類され、SMN2遺伝子の発現を増強させSMNタンパク質の機能を補充することで、SMAの治療効果を有する薬剤12)で、日本では2017年に承認された。スピンラザは腰椎穿刺により髄腔内に投与され、乳児型の脊髄性筋萎縮症の場合には初回投与後、2週、4週及び9週に投与し、以降は4か月の間隔で投与が行われる。薬価収載時の中央社会保険医療協議会(以下、中医協)資料をもとに、市場規模を患者数で除することによって年間薬剤費を算出すると、約2,870万円(負荷投与終了後の通常投与時の価格)となる。
ゾルゲンスマ点滴静注(以下、ゾルゲンスマ)は遺伝子治療に分類される薬剤であり、AAVベクターにSMN1遺伝子を搭載しており、スピンラザ同様にSMNタンパク質の機能を補充することで、SMAの治療効果を有する薬剤である13)。ゾルゲンスマは静脈内から全身投与される薬剤として日本では2020年に承認された。ゾルゲンスマの薬価は、スピンラザを比較薬とする類似薬効比較方式Iで算定され、ここに先駆け審査指定制度加算及び有用性加算Iが付与され、1億6,707万7,222円となった。ただし、本薬は1回のみの投与で長期間効果が持続する薬剤である。
そして2021年には、エブリスディドライシロップ(以下、エブリスディ)という低分子医薬がSMA治療薬として日本で承認された。エブリスディはSMN2スプライシング修飾という作用機序により、SMNタンパク質を増加させることでSMAを治療するよう設計されている14)。低分子医薬においても、新規モダリティと同様のMoAが達成されており、注目に値する事例である。エブリスディは経口投与が可能であり、ドライシロップとして一日一回投与される。薬価収載時の中医協資料を基にスピンラザ同様に年間薬剤費を推定すると、約2,450万円となる。
このように、SMA治療薬として近年承認された3剤は、それぞれ異なるモダリティに基づく薬剤であり、いずれも臨床試験において有用性が確認されている。この3剤はモダリティの違いに基づく用法用量の違い、薬剤費の違いなどそれぞれに特徴がある。将来的には、有効性や安全性のデータが蓄積・アップデートされていくとともに、有効性・安全性以外の様々な特徴も考慮され、アンメットニーズの充足など医療貢献していくものと考えられる。この事例のように、特徴の異なる画期的な薬剤が複数実用化されることは、患者さん目線では非常に好ましい状況ではないだろうか。また、これら薬剤間の併用や切り替え効果を検証する試験も進行中であり、試験結果に期待が持たれるところである15)、16)。様々なモダリティを駆使して特徴ある新薬を創製し、患者さんに選択肢を与えることも製薬企業の使命ではないだろうか。

まとめと今後の見通し
ここまでに述べた通り、近年では各モダリティの研究・開発が進み、複数のモダリティの組み合わせや中間に位置するようなものが増え始め、モダリティ間の境界を明確に引くことは困難になってきている。モダリティが多様化、さらには高分子化することで、医薬品に様々な機能を持たせることが可能になってきている。しかしこのような流れの中で、低分子医薬や中分子医薬17)の存在感も高まっている。SMA治療薬の領域で見られたように、バイオ医薬品の機能をより小さな分子で代替することは、今後の創薬研究の一つの潮流になる可能性がある。一般的には低分子医薬には経口吸収性の高さが特徴の一つとしてあり、疾患や患者さん毎の症状によって異なるものの、投与の利便性に優れる場合がある。また一般論として、低分子医薬はバイオ医薬品に比して製造コストを安価に抑えられると言われており18)、医療経済的にも恩恵をもたらす可能性がある。従来の低分子医薬ではアクセス出来なかった創薬ターゲットに対しても、科学技術の発展(疾患メカニズムの解明、AIの活用やin silico技術の発展、iPS細胞やゲノム編集技術などの実験系・評価系の拡充、超ハイスループットスクリーニングの実用化、クライオ電子顕微鏡など分析機器の高性能化、Protein degraderなどの低分子医薬に基づく新技術の開発、製剤化技術の進化など)に伴い、医薬品として有望なプロファイルを有するシーズを得られるようになってきている。また"Lipinski's rule of five"に該当するような分子量500以下の分子が低分子医薬の主体であったが、近年では分子量が1,000に迫るような比較的大きな低分子医薬(Evaluate社の定義では低分子医薬品に分類されるが、これらを中分子医薬と呼ぶこともある)も散見されるようになってきた。このような状況については、政策研リサーチペーパー72(戸邊)でも詳細に考察されているので、そちらを参照いただきたい19)。
バイオ医薬品は分子の多様化・複雑化を経ながら新規モダリティとして進化しており、今後の医薬品において非常に重要な役割を担っていくと考えられるが、一方で低分子医薬や中分子医薬にも再度脚光が当たりはじめており、モダリティの低分子量化という流れも見て取れる。医薬品にとって重要なのは、有効性や安全性はもちろんのこと、投与の利便性や価格なども含めた、医薬品の価値そのものであり、モダリティが何であるかは大きな問題ではない。将来的には、多様化するニーズに対して多様なモダリティに基づく特長ある医薬品が複数創製され、患者さん自身が自分にとって最も価値の高い医薬品を選択可能になる、そのような未来が訪れるのが好ましいのではないだろうか。
-
1)健康・医療戦略推進専門調査会(第28回)、「ワクチン開発・生産体制強化戦略」、健康・医療戦略推進本部(参照:2021/9/30)
-
2)医薬産業政策研究所、「次世代創薬基盤技術の導入と構築に関する研究」、リサーチペーパー・シリーズNo.77(2021年6月)
-
3)厚生労働省、「医薬品産業ビジョン2021」(参照:2021/9/30)
-
4)EvaluatePharmaにおける技術分類(括弧内に記載)をもとに、著者にて以下のカテゴリーに再分類した。
低分子医薬(Small molecule chemistry及びChiral chemistry)、組換えタンパク(Recombinant product)、抗体医薬(Monoclonal antibody及びMonoclonal antibody(conjugated))、細胞治療(Cell therapy)、遺伝子細胞治療(Genemodified cell therapy)、核酸医薬(DNA&RNA therapeutics)、遺伝子治療(Gene therapy)、腫瘍溶解性ウイルス(Oncolytic virus)、ワクチン類(Bioengineered vaccine及びVaccine) -
5)医薬産業政策研究所、「世界売上高上位医薬品の創出企業の国籍-2020年の動向-」、政策研ニュースNo.64(2021年11月)
-
6)医薬産業政策研究所、「バイオ医薬品のドラッグラグに関する一考察」、政策研ニュースNo.60(2020年7月)
-
7)医薬産業政策研究所、「バイオ医薬産業の課題と更なる発展に向けた提言」、リサーチペーパー・シリーズNo.71(2018年3月)
-
8)国立医薬品食品衛生研究所、「承認されたバイオ医薬品」(参照:2021/9/30)
-
9)PharmaProjectsにおいて、Origin:Biological,nucleic acidとして検索した結果を示した
-
10)Olesen J,Diener HC,Husstedt IW,et al.Calcitonin gene-related peptide receptor antagonist BIBN 4096 BS for the acute treatment of migraine.N Engl J Med.2004 Mar 11;350(11):1104-10
-
11)柴田護、「CGRP関連抗体による片頭痛の新規治療」、臨床医学、60巻、668-676、2020
-
12)
-
13)
-
14)
-
15)Harada Y,Rao VK,Arya K,et al.Combination molecular therapies for type 1 spinal muscular atrophy.Muscle Nerve.2020 Oct;62(4):550-554
-
16)Oechsel KF,Cartwright MS.Combination therapy with onasemnogene and risdiplam in spinal muscular atrophy type
1.Muscle Nerve.2021 Oct;64(4):487-490. -
17)ここでは、中分子を化学合成可能な医薬品で分子量が500~2,000程度のものとする
-
18)厚生労働省主催「バイオ医薬品及びバイオシミラー普及啓発等事業」講習会、「バイオ医薬品とバイオシミラーの基礎知識」(参照:2021/9/30)
-
19)医薬産業政策研究所、「創薬化学の側面から見た低分子医薬の将来像」、リサーチペーパー・シリーズNo.72(2018年5月)

