Opinion 製薬産業の規制改革に対する取り組み強化に向けて
医薬産業政策研究所 主任研究員 髙砂祐二
現在、日本国内の規制改革に対する取り組みは以前にも増して強力に推進されている。昨今の規制改革を志向する政府の動向、社会を一変させた新型コロナウイルス(SARS-CoV-2)による感染症(COVID-19)の影響、あらゆる分野におけるデジタル化の進展等により、その重要性が少しずつ社会全体に認識されつつあることが要因と考えられる。中でも、COVID-19が蔓延する状況下、内閣府規制改革推進会議で議論された法令に基づくあらゆる書面・押印・対面の見直しや、ヘルスケア分野におけるオンライン診療の推進等は、互いに顔を突き合わせた種々の活動が制限されることにより執拗に変革を迫られた規制改革の事例として記憶に新しいところである。このように社会構造が大きく変化しているなか、製薬産業においても、革新的な新薬を始めとする様々な医療ソリューションをより迅速に国民および患者の皆様に提供するため、政府はもとより他産業とも連携しつつ、規制改革の取り組みをより一層強化する必要があるのではないだろうか。
はじめに
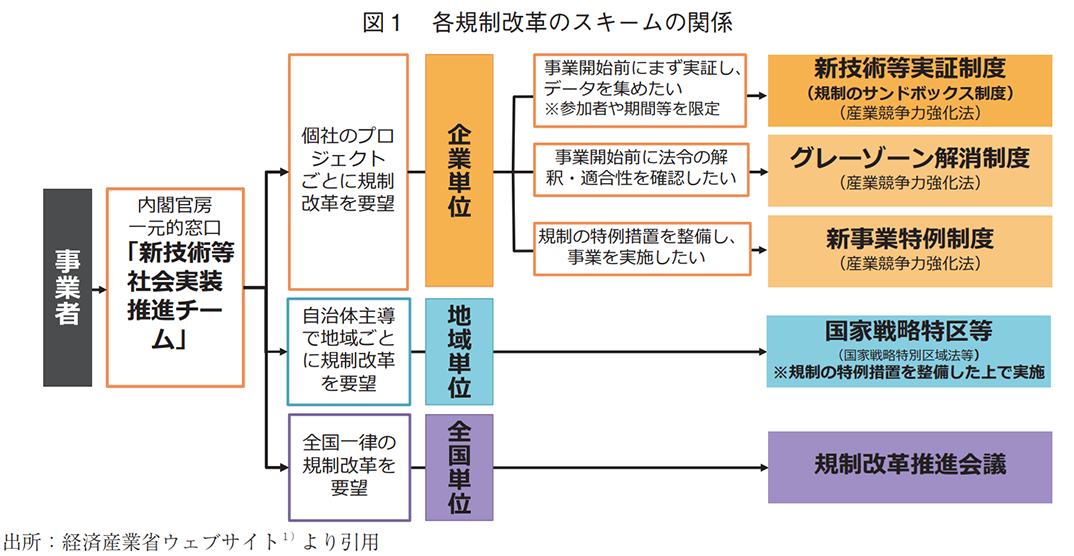
医薬産業政策研究所ではこれまでにも、図1に示すような日本国内の規制改革制度全般に着目し、ヘルスケア分野に特化した規制改革の動向等を報告してきたが2)、本稿では、全国一律の規制改革を要望できる規制改革推進会議にフォーカスを当て、その事務局である内閣府規制改革推進室と内閣官房行政改革推進本部事務局が共同で設置する「規制改革・行政改革ホットライン(縦割り110番)」3)に寄せられた規制改革提案を調査するとともに、その結果から、製薬産業が業界として規制改革の取り組みを推進するうえでの課題と考察を示す。
規制改革推進会議を通じた規制改革要望のスキーム
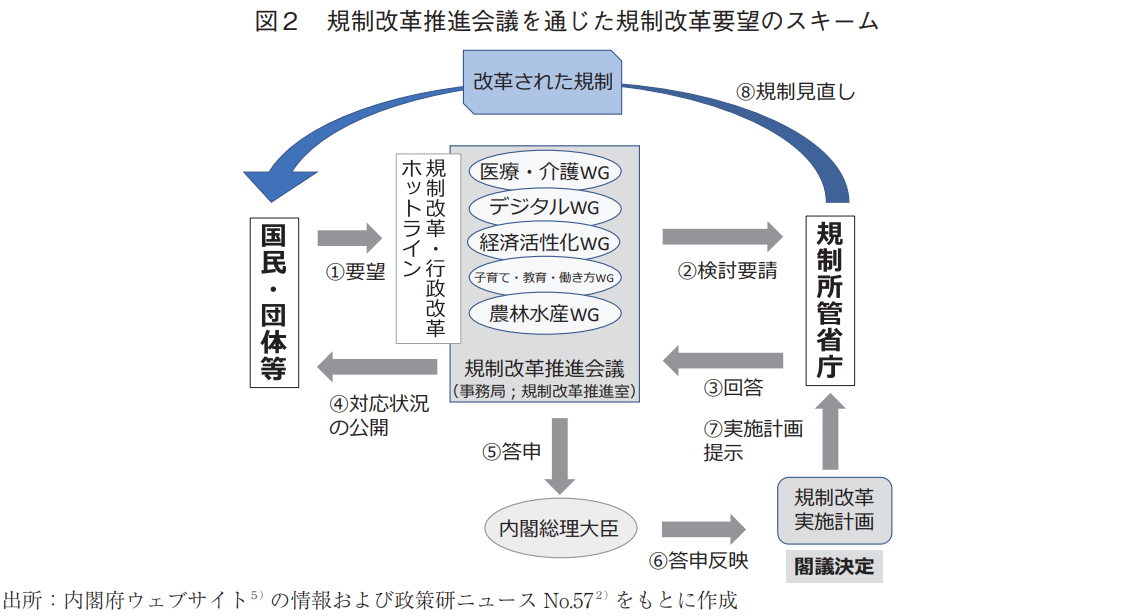
規制改革推進会議を通じた規制改革要望のスキームを図2に示す。国民や団体等から規制改革・行政改革ホットラインに提案された規制改革要望は、規制改革推進室に設置されている5つのワーキング・グループ(WG)での議論等を踏まえ、当該規制を所管する省庁に検討が要請される。所管省庁から検討結果および対応状況が必ず回答されるため、要望の提案主体は内閣府ウェブサイトに公開される回答を確認することが可能となる。すなわち、所管省庁に検討が要請された全ての規制改革提案に関しては何らかの回答が得られることになる。加えて、規制改革推進会議は年一回の頻度で、経済社会の構造改革を進めるうえで必要な規制の在り方について内閣総理大臣に対して答申し、その内容が政府の「規制改革実施計画」に反映される。規制の所管省庁は本計画に基づき規制の見直しを実施する。
内閣府「規制改革・行政改革ホットライン」に提案された規制改革要望の調査・分析
内閣府規制改革ウェブサイトの「提案事項名(タイトル)・提案主体名(会社名・団体名)等一覧表」4)の情報をもとに、2014年1月から2021年8月に規制改革・行政改革ホットラインを経由して所管省庁へ検討が要請された規制改革要望を調査した。なお、本調査においては行政改革要望を対象から除く。
提案件数の年次推移を図3に示す。2014年1月から2021年8月21日時点までに、合計5187件の提案に関して所管省庁へ検討が要請されているが、2020年以降、特に個人からの件数が増加していることが分かる。これは、規制改革を"政権のど真ん中"に置いた菅義偉内閣の発足およびCOVID-19への対応の必要性が要因であろう。個人からの提案件数が直近急増している一方で、個人以外(企業、団体等)からの提案件数は2017年以降、年間400~500件ほどで安定している。本調査においては、2020年4~5月にとりまとめられた経済4団体(日本経済団体連合会、経済同友会、日本商工会議所、新経済連盟)が提出した「コロナ感染症対応としての規制・制度の見直し要望」6)を含んでいないことを踏まえると、個人以外からの提案件数もCOVID-19の影響で2020年に大きく増加していると判断できる。また、製薬業界の関係が深い健康・医療分野の提案件数も全提案件数の増加に伴い2020年に大きく増えていることが分かる。なお、検討要請日から回答取りまとめ日までの平均期間は68.5日間であった。
全分野における規制改革要望の提案主体を調査した結果を表1および図4に示す。日本経済団体連合会(経団連)を始めとする経済団体が最も多くの要望を提案しているが、同程度の要望を業界団体(金融・保険業)が提案していることも分かる。金融・保険業は、銀行法、信託業法、保険業法等が課されている代表的な規制産業でもあり、厳しい規制や制度を打破するために業界団体から率先して多くの規制改革要望が提出されているものと容易に想像することができる。なお、業界団体(金融・保険業)は同様の規制改革要望を複数回にわたって提案している事例が多いことも件数が多い一因として考えられる。他方、製薬業界はどうか。全体的に製造業からの要望は少ない傾向にあるが、製薬業界を含む業界団体(製造業 化学工業)からの要望はごくわずかであり、かつ、社名を公表している民間企業の中に製薬企業の存在は認められなかった。表2および図5には、製薬業界に関連のある健康・医療分野の規制改革要望に限定した調査結果について示す。本分野においては経団連を始めとする経済団体の割合が半数弱を占め大きな存在感を示している。また、製薬業界を含む業界団体(製造業化学工業)からの要望件数の割合は、全分野と比較してわずかに高くなっていることが分かる。
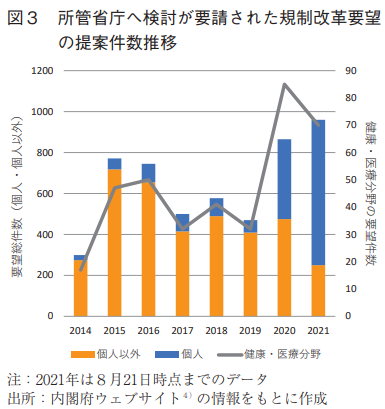
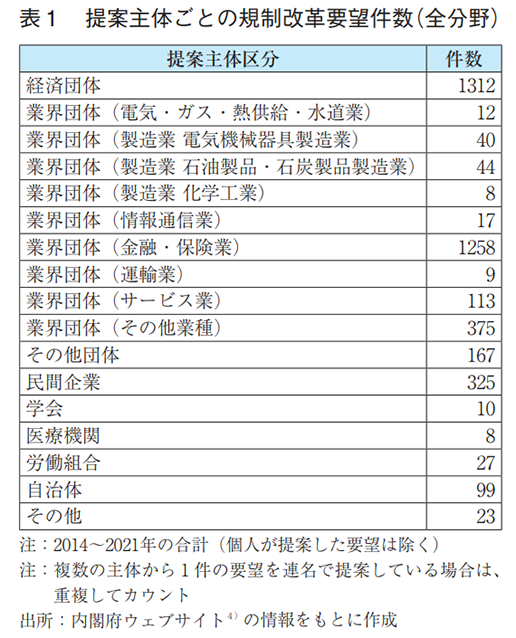
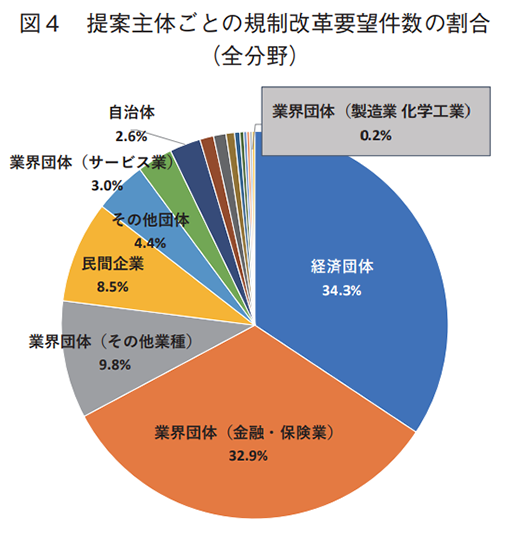
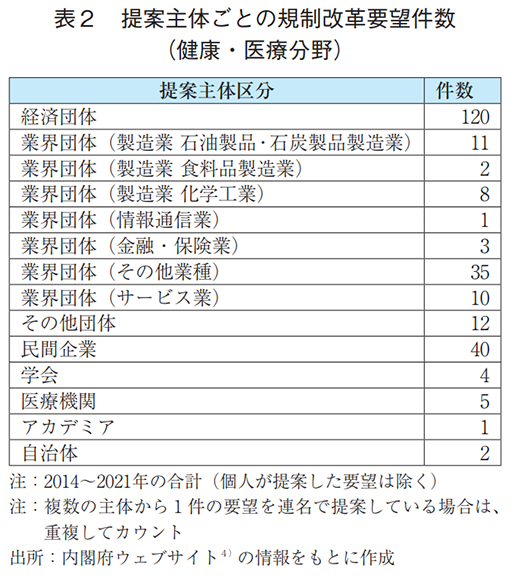
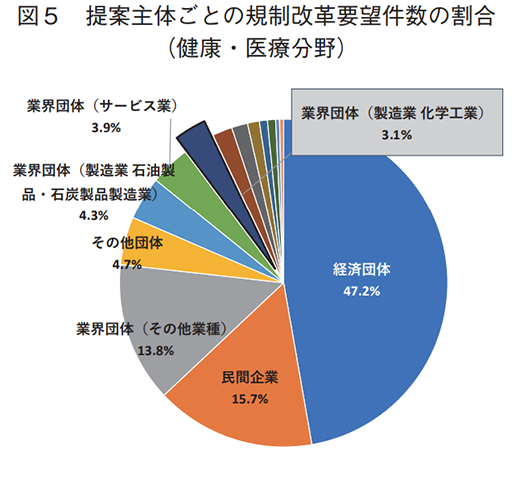
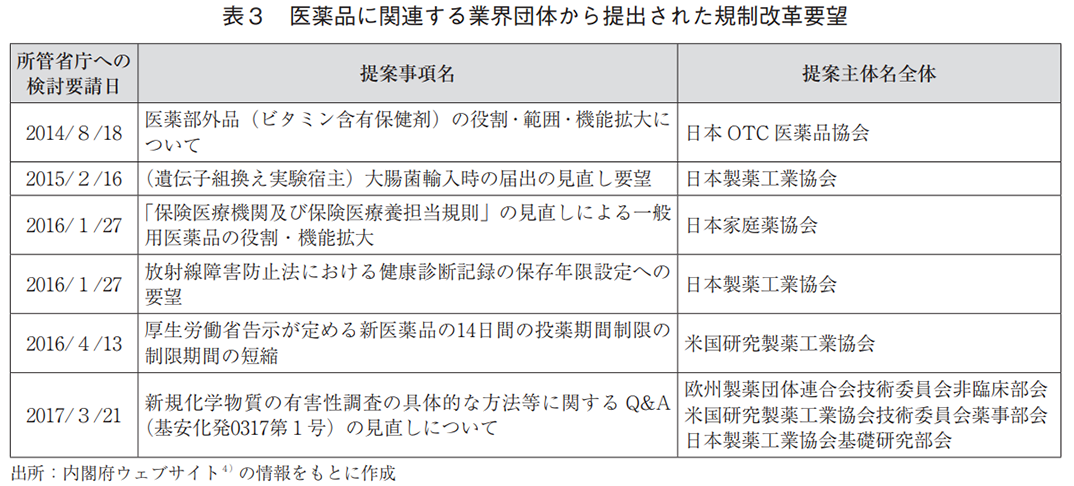
表3には、本調査期間中に医薬品に関連する業界団体から規制改革・行政改革ホットラインに提出された具体的な要望の一覧を示す。2018年以降に提案された要望は存在しないことが分かる。
「個人情報の保護に関する法律(個人情報保護法)」に関連する規制改革の事例
個人情報保護法7)とは、正式には「個人情報の保護に関する法律」といい、個人情報の取り扱いを適切に行うための法律であって、製薬企業においても創薬研究や臨床開発等のあらゆる場面で順守すべき規制である。現行の個人情報保護法においては、本人同意を得ずに要配慮個人情報を取得することならびに第三者へ提供することを認めておらず、加えて、同意を取得する際に提示した目的以外での個人情報の利用も不可能である。ただし、「公衆衛生の向上又は児童の健全な育成の推進のために特に必要がある場合であって、本人の同意を得ることが困難であるとき」等の利用目的や第三者提供の制限の例外規定があり、個人情報の公益目的での利用が許容される場合もある。しかしながら「公衆衛生の向上」の解釈が明確になっておらず、個人情報を活用した医薬品等を創出するための製薬企業における医学研究が、個人情報保護法に記載されている「公衆衛生の向上」に該当するのか判断が困難な状況である。個人情報保護法は2015年の法改正に伴い、情報通信技術の進展が著しいこと等から3年ごとの見直し規定が設けられた。そのため、政府は改正法施行後3年を目途に具体的な検討を進めてきた経緯がある。
2019年12月13日、個人情報保護委員会より、法改正に向けた検討事項が記載された「個人情報保護法いわゆる3年ごと見直し制度改正大綱」8)が公示され、それについて国民から広く意見や情報を収集する意見募集が実施された。本制度改正大綱のなかでは、公益目的による個人情報の取扱いに係る例外規定の運用の明確化について、「安全面や効果面で質の高い医療サービスや医薬品、医療機器等の実現に向け、医療機関や製薬会社が、医学研究の発展に資する目的で利用する場合等」が「公衆衛生の向上」に該当すると考えられる旨が明記された。こういった記載に対して、日本製薬工業協会(製薬協)産業政策委員会は、医薬品等の研究開発の推進は健康長寿社会の実現という公益に資すると考えるため、「医療の向上に資する医薬品等の研究・開発等の推進を目的とした民間企業による利用を、個人情報保護法における公益目的での位置づけとして明確化すべくガイドラインやQ&Aに具体例等を明記いただきたい。」と意見した9)。加えて、日本医療機器産業連合会から同様の意見が寄せられると同時に、他業界団体からは医療分野に限定することなくあらゆる分野においても例外規定を明確化すべく事例を示すよう要望された。
個人情報保護法における例外規定の明確化に関連して、経団連から規制改革・行政改革ホットラインを経由して上記の製薬協等と同様の要望を受けた内閣府は、2020年5月21日に個人情報保護委員会へ検討を要請した。その後、2020年7月29日に得られた個人情報保護委員会からの回答では、今後ガイドラインやQ&Aを更新するなかで例外規定の具体的な事例を示す予定であることが確認できる(表4)。
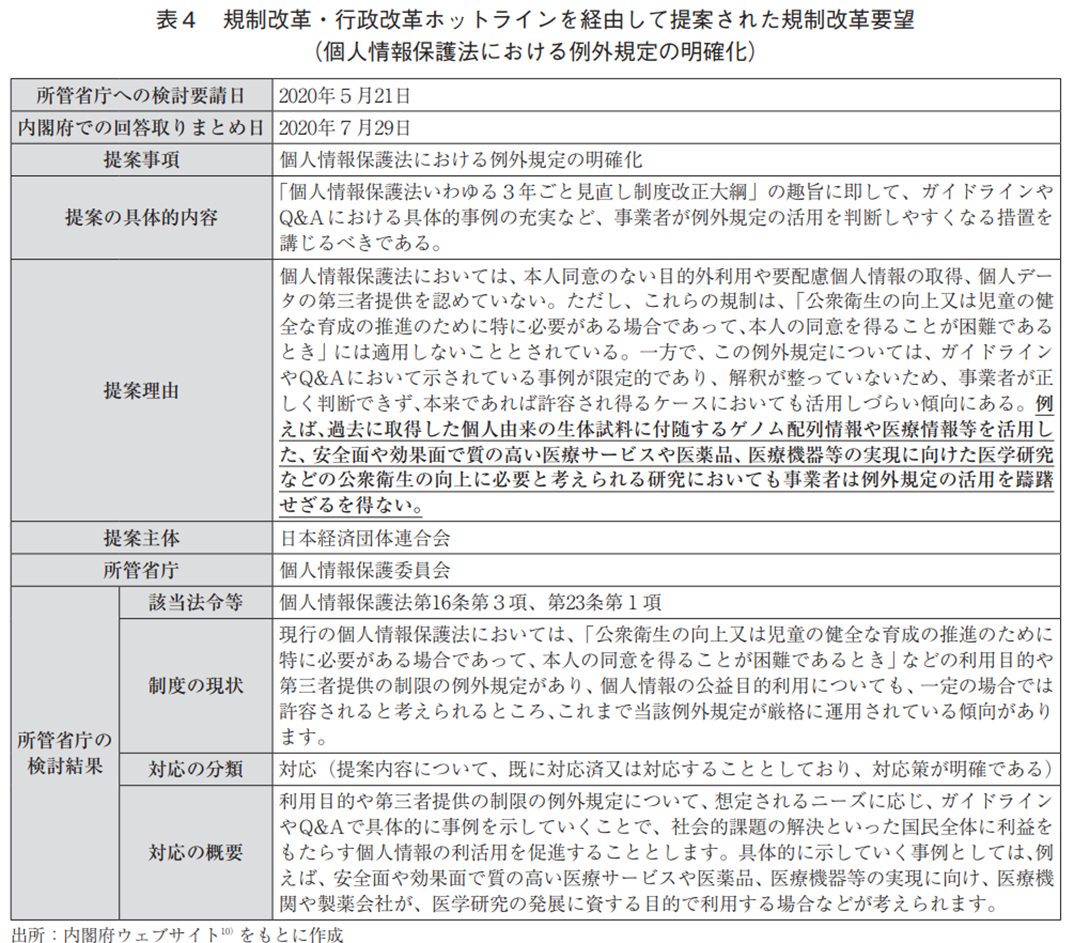
2021年6月30日、個人情報保護委員会は、「『個人情報の保護に関する法律についてのガイドライン』及び『個人データの漏えい等の事案が発生した場合等の対応について』に関するQ&A」を更新し、製薬企業が個人情報を活用する場合の「利用目的による制限の例外」が追加された(表5)。これにより、製薬企業が行う有効な治療方法や薬剤が十分にない疾病等に関する疾病メカニズムの解明、創薬標的探索、バイオマーカー同定、新たな診断・治療方法の探求等の研究は、その結果が広く共有・活用されていくことで、医学、薬学等の発展や医療水準の向上に寄与し、公衆衛生の向上に資するものであるとの考えが示された。

規制改革を通じた多様なステークホルダーとの連携に向けて
ここまで記述してきた内容を概括する。規制改革・行政改革ホットラインに提出された要望の調査より、要望の提出主体としては経済団体や規制産業の一つである金融・保険業の業界団体が多く、医薬品関連の業界団体および企業からの要望はごく少数である事実が分かった。また、個人情報保護法に関わる規制改革の事例より、経済団体や医療機器業界を含む他産業等、製薬産業以外の様々な主体からも、規制改革・行政改革ホットラインだけではなく意見募集の機会もあわせて活用し、一つの案件に対して、複数の規制改革関連チャネルを駆使した効果的な取り組みが確認された。以上のことから、製薬産業として規制改革にどのように向き合う必要があるのか、特に規制改革・行政改革ホットラインの活用に焦点を当てて課題を取り上げつつ考察したい。
第一に懸念される点は、製薬業界が規制改革・行政改革ホットラインの活用事例が現状少数に留まっている可能性があることである。人々の健康あるいは生命の維持に直接関わる医療分野においては、数多くの様々な規制・制度が整備されているなかで、製薬業界が可能な限り迅速に世界の人々に新薬を提供するために見直されるべき規制が存在するはずである。特に現場で従事されている方々におかれては、規制の枠の中で業務を実施することにそれほど違和感を持たない現状があるように思われる。自らの業務を実施するうえで順守すべき規制の存在意義を再認識し、その必要性や改善すべき点を洗い出す作業が必要である。規制・制度の存在により、手続きが煩雑で長期間を要する業務はないだろうか。危険性が高い等の理由から、規制上輸送等の取扱いに労力を要する物質はないだろうか。書類等の現物を目視で確認するため、新興・再興感染症蔓延期であるにも拘わらずオンラインによる面談が許可されずに対面でのやり取りが義務付けられている規制はないだろうか。デジタルトランスフォーメーションが強力に推進されているなか、様々な医療データを駆使して新薬を創出するために足枷となっている規制はないだろうか。新規事業を推進するうえで障壁となっている規制はないだろうか。創薬研究、臨床開発、製造あるいは市販後調査等、医薬品創出のあらゆるバリューチェーンにおいて、また医薬品以外の様々な医療ソリューションを創出する過程において、そういった規制・制度を今一度認識し直す必要がある。具体的には、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)」、「医薬品の臨床試験の実施の基準に関する省令(GCP省令)」、「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令(GMP省令)」、「再生医療の安全性の確保等に関する法律(再生医療等安全性確保法)」等があげられる。個社で課題感を持った規制は他社においても障害になっている可能性があるため、製薬業界としてどのような課題を保有しており、それを解決するためにどのように規制を見直すべきなのかを具体的に検討することも非常に意義深い。
改革が必要な規制が存在する場合、図1に提示したスキームを中心にいずれかのチャネルを活用して規制改革を要望する必要がある。現状、製薬産業は所管省庁に直接要望する機会が多いと思われるが、省庁との結び付きが脆弱な場合には、本稿にて紹介した規制改革・行政改革ホットラインの活用をより積極的に推進してはどうか。そうすることで、要望に対する省庁からの回答を何かしら得るとともに、同様の規制改革を希望する他の企業、業界、団体等との連携が進み、個々の提案主体としては声が小さくともそれらを結束させることによって規制が見直される可能性が高まるだろう。まずは規制や制度に課題や関心を有しており、それらの見直しを要望する声を上げること自体が重要と考える。
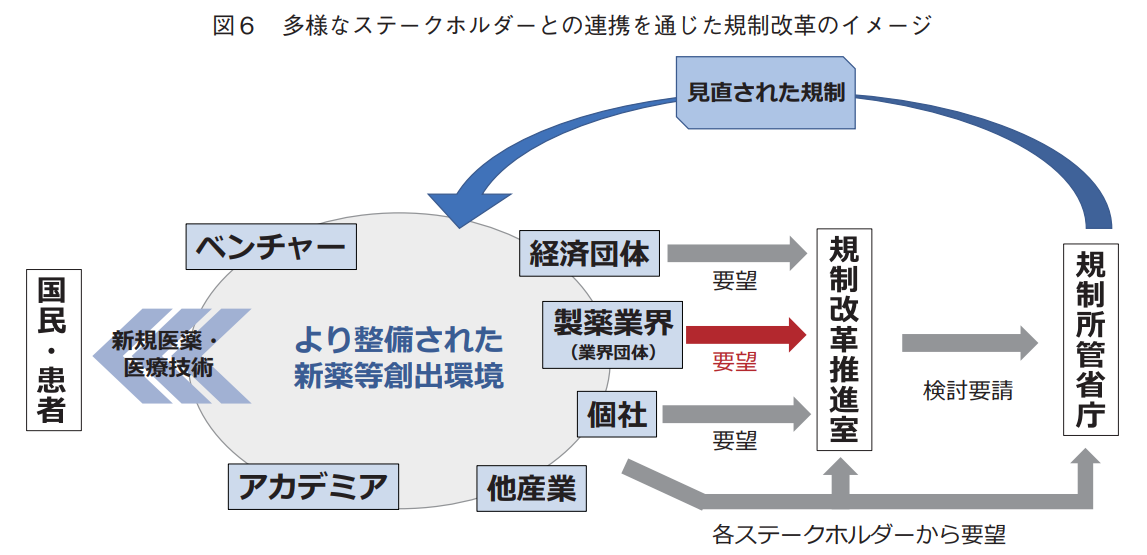
第二に考慮すべき事項は、規制改革・行政改革ホットラインを活用して要望する際、いずれの主体から提案するかである。表2および図5で示したように、製薬業界が関連する健康・医療分野の案件の多くは、様々な業界の会員企業が所属する経団連等の経済団体から提案されているものが約半数を占めている。それによって規制改革要望に重み付けできることは確かであり、経済団体から製薬業界の規制改革要望を提案するというチャネルも重要な選択肢の一つである。しかしながら、その業界特有の規制改革要望を経済団体から提案しようとすると、経済団体や他業界の会員企業と見解の相違が生じる等の理由から、要望の提出が困難な状況に陥る恐れがあり、それを回避するためには業界団体が主体となる規制改革の提案が必要な場合も発生する。製薬業界の中でもとりわけ、新規モダリティの医薬品開発や新たな事業を始めようとする機会が比較的多く、思わぬ規制や制度に事業展開を阻害されやすい研究開発志向型の製薬企業が加盟する製薬協においても、これまで以上に積極的な規制改革に対する取り組みが重要性を持つ。複数の業界に跨り日本全体の大きな方向性を示す要望を経済団体から、製薬業界に特化した要望を製薬業界から提出する大まかな提出主体の役割を設定する。加えて、経済団体や業界団体内で規制改革の方向性がまとまらない場合は個社から要望を提出する可能性もあるだろう。また同時に、提案内容に応じて経済団体、製薬業界あるいは製薬企業個社、他産業等が密に連携を取れる体制を整備する必要があると筆者は考える。そうすることで、見直された規制により新薬等を創出する環境がより一層整備され、新たな医薬品や医療技術を速やかに国民・患者の皆様へ提供できるようになるだろう(図6)。
まとめ
本稿では、日本国内の規制改革制度の中で規制改革推進会議に着目し、規制改革・行政改革ホットラインに寄せられた規制改革提案を調査した。その結果から、製薬産業が業界として規制改革の取り組みを推進するうえでの課題と考察を示した。
2014年1月から2021年8月に規制改革ホットラインおよび規制改革・行政改革ホットラインを経由して所管省庁へ検討が要請された規制改革要望を調査したところ、医薬品関連の業界団体および企業からの要望はごく少数であることが分かった。また、個人情報保護法に関連する規制改革事例の動向を調査することにより、規制改革・行政改革ホットラインを含む複数のチャネルを活用して様々な主体が課題関心を政府に投げかける取り組みが効果を発揮していると推察することができた。以上のことから、規制産業の一つでもある製薬産業が、関連する規制をより積極的に見直す機会を設けることの重要性を示した。加えて、規制改革・行政改革ホットラインを活用する際、要望の提案主体に関する区分について筆者の一考を提示した。
2021年8月23日、政府は新たな陣容のもとで規制改革推進会議を開催し、来夏の答申に向けて議論を開始した12)。行政手続き等のデジタル化が叫ばれていた最中、COVID-19の流行も相まって医療分野においてもその出遅れを挽回すべく、政府における規制改革の取り組みが以前にも増して加速度を持ち推進されていくと想定される。製薬産業ではこれまでにも問題意識を持つ複数の規制や制度に関して改革を要望してきており、本稿にて取り上げた個人情報保護法の事例のように見直しまでたどり着いた規制もある。しかしながら、規制に対する課題関心を政府に伝えたものの、長期間にわたって改善が図られていないものも存在する。そのような規制・制度に関しては、継続的に政府へ働きかけるとともに、問題意識を共有する製薬業界以外のステークホルダーと連携を取りながら規制改革を推進する必要がある。そのような取り組みは、規制に対する課題意識を所管省庁に共有したものの長期間にわたって改善が図られない場合等においても効果的であろう。
革新的な医薬品・医療技術を創出する難易度がますます上昇するなか、製薬業界は新薬を含む医療ソリューションを一刻も早く国民の皆様に届けるため、規制改革の取り組みを通じて多様なステークホルダーとより一層連携が図られることを期待する。
-
1)「産業競争力強化法に基づく企業単位の規制改革制度について」(経済産業省)(参照:2021/9/29)
-
2)医薬産業政策研究所「ヘルスケア分野の規制改革-一丁目一番地の曲がり角-」政策研ニュースNo.57(2019年7月)
-
3)2020年9月に内閣府規制改革推進室「規制改革ホットライン」から変更された。本稿では「規制改革・行政改革ホットライン」を名称として使用する。
-
4)受け付けた提案及び所管省庁からの回答:「規制改革・行政改革ホットライン(縦割り110番)」(内閣府)(参照:2021/9/29)
-
5)第11回規制改革推進会議「規制改革推進会議の進め方について」(内閣府)(参照:2021/9/29)
-
6)経済団体からの「コロナ感染症対応としての規制・制度の見直し要望」への対応についての回答(内閣府)(参照:2021/9/29)
-
7)「個人情報の保護に関する法律」(個人情報保護委員会)(参照:2021/9/29)
-
8)「個人情報保護法いわゆる3年ごと見直し制度改正大綱」(個人情報保護委員会)(参照:2021/9/29)
-
9)「個人情報保護法いわゆる3年ごと見直し制度改正大綱」に関する意見募集の結果について(個人情報保護委員会)(参照:2021/9/29)
-
10)「規制改革ホットライン検討要請項目の現状と対応策」(内閣府)(参照:2021/9/29)
-
11)「Q&Aの追加・更新一覧」(個人情報保護委員会)(参照:2021/9/29)
-
12)第11回規制改革推進会議議事次第(内閣府)(参照:2021/9/29)

