Topics 新薬の革新性と価格プレミアム 日米独のマッチト・サンプルによる分析
医薬産業政策研究所 客員研究員 学習院大学教授 西村淳一
医薬産業政策研究所 所長 東京経済大学教授 長岡貞男
創薬イノベーションへのインセンティブにおいて、薬価制度は中核的な役割を果たすと考えられる。新薬の比較薬に対する価格プレミアムが、新薬の革新性を反映することで、より革新的な医薬品を生み出すことが期待されるからである。本稿では、新薬の革新性の指標を新たに構築し、日本の薬価制度が米独と比較して、革新性をどのように評価してきたかを、新薬の比較薬に対する価格プレミアムのマッチト・データを利用して分析する1)。新薬の価格プレミアムと革新性の関係を国際的な観点で客観的に分析することが、今後の制度設計を考えていくうえで重要である。
Comanor 他(2018)2)の先行研究では、NICEによる医薬品の費用対効果と公的調達機関が価格決定に大きな役割を果たしている英国と、医薬品の効果の評価と価格交渉が民間機関に委ねられている米国について、両国の新薬の価格プレミアムを比較し、平均的に両者はほぼ等しく、英国における価格決定が市場原理による価格決定と大きく異なる結果をもたらしていないと結論づけた。一方で、「新薬の比較薬に対する価格プレミアム:日米欧のマッチト・サンプルによる分析」(政策研ニュースNo.62)は、このComanor 他(2018)の研究を検証し、かつ拡張し、日欧は米国と比較して、価格プレミアムの水準と変動が小さいことを見出したが、その要因の検討はしていない。さらに、前出の分析では、米国における新薬の価格プレミアムが医薬品の革新性をより効果的に反映したものと想定して分析したが、その検証はしていない。本稿ではこれらの先行研究の課題に対応していく。なお、医薬品の革新性によって国際的な価格プレミアムの差を評価した先行文献は現状では見当たらない。
価格データ
本稿では「新薬の比較薬に対する価格プレミアム:日米欧のマッチト・サンプルによる分析」(政策研ニュースNo.62)にて構築したデータをベースとし、革新性に関するデータを追加的に収集し、分析データセットの構築を行った。同分析では、『IQVIA Pricing Insights』を利用し、日米独英仏の5か国で2010年7月~2019年3月において上市している医薬品について、一般成分名、国際商品名、剤形及び規格単位の全てを共通とする、各国の医薬品価格情報(2015年価格で実質化)を四半期レベルにて構築している。本稿では、前出の分析同様に、売上上位の医薬品に焦点をあて、価格プレミアムのデータが入手できる69成分を母集団として分析を行う。しかし、後述する革新性指標や医薬品の特許保護期間のデータ収集において欠損があるため、実際の分析における観測数は69成分を下回る。使用したデータ一覧や分析データの構築手順の詳細は補論1にまとめている。
価格プレミアムの定義と動向
新薬と比較薬との、治療単位での価格比を計算するために、本稿では中央社会保険医療協議会(中医協)の薬価算定資料から各医薬品の一日薬価の情報を用いて、日米独における新薬の比較薬に対する価格プレミアム(価格比の対数値、新薬の比較薬に対する価格上昇率)を測定した。
価格プレミアム=ln(新薬の一日薬価)-ln(比較薬の一日薬価)
新薬と比較薬ともに、その薬価が、健康上の効果を反映して(ICER の基準で)設定されているとすれば、この価格プレミアムは新薬の比較薬に対する健康上の改善効果を反映すると考えられる(政策研ニュースNo.62参照)。また、定義式からわかるように、対数で価格差をとっているため、新薬と比較薬で共通する固有効果(例えば、適応症や薬理作用、対象疾患の需要や市場競争の状況等)は除去されている。
この価格プレミアムについて、米国における推移を示したのが図1である。図の作成において利用する医薬品成分は、当該国の観測期間上、新薬と比較薬のすべての価格情報が得られ、価格プレミアムがすべての期間で計測できるものに絞っている。そのため、各国の価格推移を概観することを目的としており、後の推定で使用する日米独共通サンプルとは構成が異なる。
研究の目的は、価格プレミアムが革新性をどのように反映しているかの分析であり、新薬および比較薬の両方の独占保護期間が存在している期間中の価格プレミアムに注目して分析を行う。比較薬の独占保護期間が終了すると、薬価はジェネリック医薬品との競争等によって医薬品の効能との関連性が大幅に薄まり、価格プレミアムもこれを反映する。他方で、初期の薬価だけに注目すると、治療効果に対する市場での評価によって薬価が変化していくこと、新薬への薬価規制の影響等、各国の薬価が革新性を反映する程度が経時的に変化することを適切に評価できない。以下では、新薬および比較薬の両方の独占保護期間が存在している期間中の価格プレミアムを分析対象とするという分析枠組の適切性の確認をするために、米国における新薬と比較薬の薬価および価格プレミアムの動向を概観する。
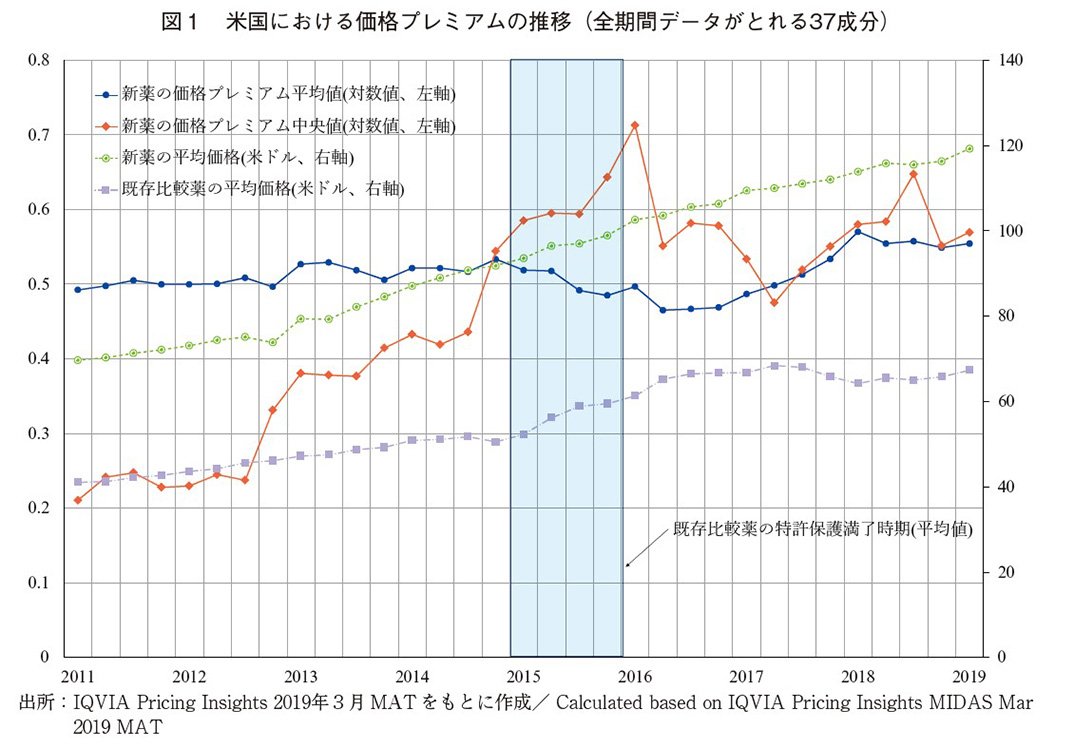
図1は米国における37医薬品成分の価格プレミアムの推移(左軸)、また、当該新薬とそれに対応する比較薬の薬価も示している(右軸)。米国における価格プレミアムの傾向として平均値でみると、比較薬の独占保護期間以前は、0.5前後で上昇傾向にある。これは新薬が比較薬と比べて約50%程度の価格プレミアムがあることを意味する。中央値でみると、経年とともに価格プレミアムは0.2から0.6程度へと上昇傾向にあり、医薬品によって価格プレミアムの動向に大きな差があることを示唆している。新薬と比較薬の薬価の推移については、比較薬の独占保護期間以前は、両者とも経年とともに上昇傾向にあるが、新薬の方がその程度は大きい。新薬については、市場で徐々にその価値が認識されることで、薬価が上昇していくのかもしれない。比較薬については、2015年頃に特許保護が満了しているが、米国では満了後にむしろ薬価の上昇幅が大きくなっているのも特徴的である。よって、新薬の価格プレミアムには、米国では特に、比較薬の特許保護が大きく影響していることが確認された。以下では、革新性の指標の構築を行い、計量分析の手法を用いて、新薬と比較薬の特許保護期間中の価格プレミアムに着目し、その決定要因について日米独の医薬品成分を揃えたマッチト・サンプルでの分析を行う。
新薬の革新性の指標
本稿では4つの新薬の革新性指標を新たに作成した。最初の指標は中医協の「類似薬選定のための薬剤分類」をもとに作成した3)。
- (1)革新性(新規度):新規作用機序かどうか、あるいは既存作用機序の中で何番目の上市かを、中医協の類似薬選定のための薬剤分類をもとに作成した。本稿では、上市の順位の逆数をとり、その後、対数値をとっている(ln(1/上市の順番))。よって、この数値が大きいほど当該医薬品成分の革新性(新規度)は高いと考えられる。
次に、各医薬品成分を保護する特許群(物質特許、結晶特許、用途特許)をサンエイレポートより特定し、当該特許群に対応する米国特許群が書誌情報(フロントページ)に引用している科学論文群をWeb of Scienceより収集し、以下の革新性指標を作成した。なお、被引用情報には本来、トランケーションの問題があり、また、医薬品の特許が科学技術論文を引用する性向も経時的に変化するので、以下の指標を推定に用いる場合には、新薬のATC 薬効分野と上市年を固定効果としてコントロールしている。
- (2)革新性(科学論文数):各医薬品成分を保護する特許群が科学論文をどの程度引用しているかを測定し、その対数値をとっている(ln(科学論文数+1))。この数値が大きいほど、より多様な科学的知識に依拠した革新性が高い医薬品と考えられる。
- (3)革新性(被引用数):成分単位で特定された科学論文群が、他の科学論文によってどの程度引用されたかを測定し、その被引用数の対数値の平均を計算している(ln(被引用数+1))。この数値が大きいほど、重要度の高い科学的知識に依拠した革新性が高い医薬品と考えられる。この指標は新しい科学論文ほど引用数が少ないバイアスがあると予想されるが、推定では新薬の上市年を導入することでコントロールしている。
- (4)革新性(科学活用速度):医薬品成分を保護する特許の出願時期と、その特許が引用する科学論文の発刊時期の差分(引用ラグ)の平均値をとることで、当該医薬品成分が、公刊された科学論文をどの程度早く活用しているかを測定した。本稿では、この引用ラグの平均値の逆数をとり、その後、対数値をとっている(ln(1/引用ラグ))。よって、この数値が大きいほど、より早く科学的知識を吸収・活用した革新性の高い医薬品と考えられる。
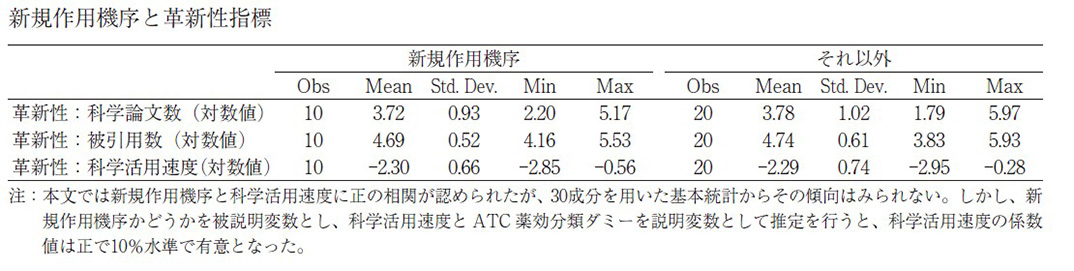
本稿で用いる革新性指標の妥当性について、以下3つの点から述べる。第一に、新規作用機序の医薬品は新しい科学的知識に基づいており、上記の引用ラグが小さく、既存作用機序の医薬品では引用ラグが長いと想定される。実際に、革新性(新規度)と革新性(科学活用速度)には正の相関(0.271、P 値=0.095)があった(47成分、クロスセクションデータより)。
第二に、革新性が高いほど、競争に強く、新薬の経時的な薬価上昇率(初期値1)は高くなると想定される。例えば、米国において、薬価上昇率と革新性(新規度)には正の相関(0.048、P 値=0.078)、薬価上昇率と革新性(科学論文数)には正の相関(0.053、P 値=0.052)、薬価上昇率と革新性(被引用数)には正の相関(0.070、P 値=0.015)、薬価上昇率と革新性(科学活用速度)には正の相関(0.071、P値=0.012)があった(43成分、1240観測数、パネルデータより)。
第三に、政策研ニュースNo.55において、科学論文をその特許で引用している医薬品成分ほど、入院患者の治癒率への貢献が高く、また、医師が判断する薬剤貢献度と正の相関もみられた。科学的知識をより活用している医薬品ほど、その経済効果が高いと想定される。以上から、本稿で用いる革新性指標には、医薬品の革新性が部分的にでも反映されていると考えられる。本稿で捉えることの出来ない医薬品の革新性の程度(投与のしやすさ、副作用の程度等)はモデルにおける欠落変数として扱われている。詳細は補論2の理論的背景にて説明している。
分析モデル
新薬の革新性とその比較薬の薬価から計算される価格プレミアムとの関係を分析するために、パネルデータを利用する。以下の推定モデルの理論的背景については補論2にまとめている。日米独の各国における革新性と価格プレミアムの関係について以下のモデル(1)により推定する。
日米独の価格プレミアム=α1+β1(革新性)+コントロール (1)
観測ユニットは医薬品成分であり、四半期データとなっている。価格データの観測期間は8年間強であり、初期価格が観測されない医薬品もある。このため新薬の上市後経過年数をコントロール変数に導入することで、各年の価格プレミアムを初期値に換算した推定を行っている。同時に、上市後経過年数を推定式から除去し、比較薬の独占保護期間中で観測出来る価格データをそのまま利用した推定も行っている。この場合、独占保護期間中の平均値で評価した推定結果となる。
革新性の変数として前述の4つの指標を同時にモデルに入れている。なお、4つの指標間の多重共線性の問題を考慮し、段階的に変数を入れ替えしたが、係数値に大きな変化はなかった。コントロール変数として、年ダミー、四半期ダミー、新薬上市年ダミー、ATC薬効大分類ダミーも入れている。新薬の上市年ダミーによってコホート効果を入れることで、最近の新薬が引用している論文の引用数が小さくなる傾向を考慮している。推定では最小二乗法を用いている。また、本稿で分析対象となっている新薬はすべて、各国において特許保護期限切れ前の価格データを用いている。すでに述べたように、新薬の革新性が価格プレミアムに与える影響を分析するには、新薬、比較薬の効能がその薬価に適切に反映されている必要性があり、新薬も比較薬も特許切れ前のデータのみで推定した。さらに、日米独のマッチト・サンプルによる分析のため、3か国で共通して、新薬も比較薬もデータが存在する医薬品30成分を用いて推定した。
次に、米国の価格プレミアムを基準として、それと各国の価格プレミアムとの差分を被説明変数として推定を行った。モデル(2)は以下である。
米の価格プレミアム-日独の価格プレミアム=α2+β2(革新性)+コントロール (2)
この推定では新薬と比較薬の組み合わせ特有の(革新性指標では把握が出来ない)固有効果を、国際的な差分をとることで除去できるため、革新性が価格プレミアムに与える影響を、よりバイアス無く測定することができる。コントロール変数として、米国と日独における新薬の上市後経過年数、年ダミー、四半期ダミー、新薬上市年ダミー、ATC薬効大分類ダミーを入れている。
我々の推定モデルにおけるバイアスの可能性について述べておく。我々の分析対象である新薬は世界の売上額で上位300の医薬品であり、高度に成功した医薬品であり、価格プレミアムは概ね高いと予想される。結果として価格プレミアムの水準で医薬品が選択されており、このバイアスは価格プレミアムの方程式における、革新性の係数の推定値を小さくする方向(過小評価)に作用する。
この問題が特に深刻になるのは、科学論文が重要な役割を果たしているにもかかわらず、引用情報が欠如している場合である。この場合、我々の構築した革新性指標がゼロとなるが、上位300の医薬品であり高い価格プレミアムをもたらしているので、革新性の係数は大幅に過小推定となる危険性がある。これを避けるために、我々は特定した米国特許が科学論文を全く引用していない医薬品を推定から除いている(科学活用速度の指標を作成するにあたり、科学論文数がゼロの医薬品は必然的に除去される)4)。
推定結果:革新性と価格プレミアム
表1は、各国におけるモデル(1)の革新性と価格プレミアムの推定結果である。式(1)~(3)では新薬の上市後経過年数をモデルに入れて推定しており、経過年による影響を除去した初期の価格プレミアムにおける革新性の影響をみている。式(4)~(6)では、新薬の上市後経過年数を除いた推定となっており、頑健性の確認とともに、観測期間全体(ライフ・サイクル)における価格プレミアムと革新性の間の平均的な関係を推定している。まず、表1からわかることは、革新性指標(新規度、科学論文数、被引用数及び科学活用速度)がいずれも、日米独の3か国すべてで、正で有意となっていた。その係数値をみると、米国での係数値が最も大きくなっている。例えば、この推定モデルは両対数モデルであるため、式(2)において、新薬が依拠している科学論文の被引用数が10%上昇すれば、あるいは科学論文の成果を活用する速度が10%高まれば、米国における新薬の比較薬に対する価格プレミアムは平均的に、それぞれ3.7%、2.4%高くなることを意味している。係数値を見ると、新規度以外は、米国の係数が最も大きく、その差も大きい。これらの結果は米国市場において、新薬の革新性がその価格プレミアムに最もよく反映されていることを示している。
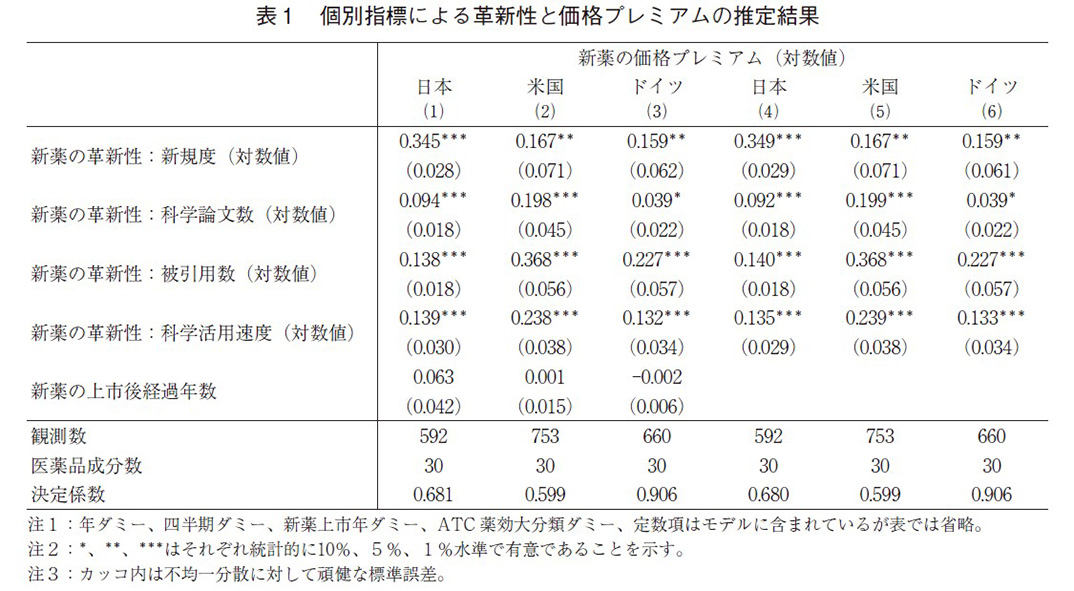
次に、新薬の上市後経過年については、いずれの国においても統計的に有意ではない。式(1)~(3)と上市後経過年数を除いた式(4)~(6)では革新性の係数値に大きな変化もみられなかった。
表2はモデル(2)の革新性と価格プレミアムの国際的差分の推定結果である。式(1)は米国の価格プレミアムから日本の価格プレミアムを引いた推定で、式(2)は米国からドイツを差し引いた推定となっている。推定された係数値は、革新性指標が米国と比較して、どの程度、日本及びドイツで小さく反映しているかを示す。表1と同様に新薬の上市後経過年数を除いた推定も式(3)と(4)で行っている。前述の通り、国際的差分をとることで、推定値のバイアスは小さくなる。
革新性指標の係数をみると、すべての式において、医薬品特許が依拠する科学論文数と科学活用速度が正で有意となった。表1で、日独は米国と比較して、これらの指標の係数が小さいことは既に指摘しているが、差分の推定によって、推定バイアスをコントロールしても、米国と比べて革新性を価格プレミアムに反映する程度が、日独で有意に低いことを示している。さらに、新薬の上市後経過年数を除いた式(3)と(4)の結果をみると、式(1)と(2)と比べて、革新性指標(科学論文数と科学活用速度)の係数値が大きくなる傾向がみられる。これは、医薬品のライフ・サイクルにおいて、米国では日独と比較して、革新性の評価が高まり、それが米国における価格プレミアムに一層反映されていることを示唆する。表1ではそのような傾向がみられなかったが、モデル(1)における欠落変数による推定バイアスだと考えられる。
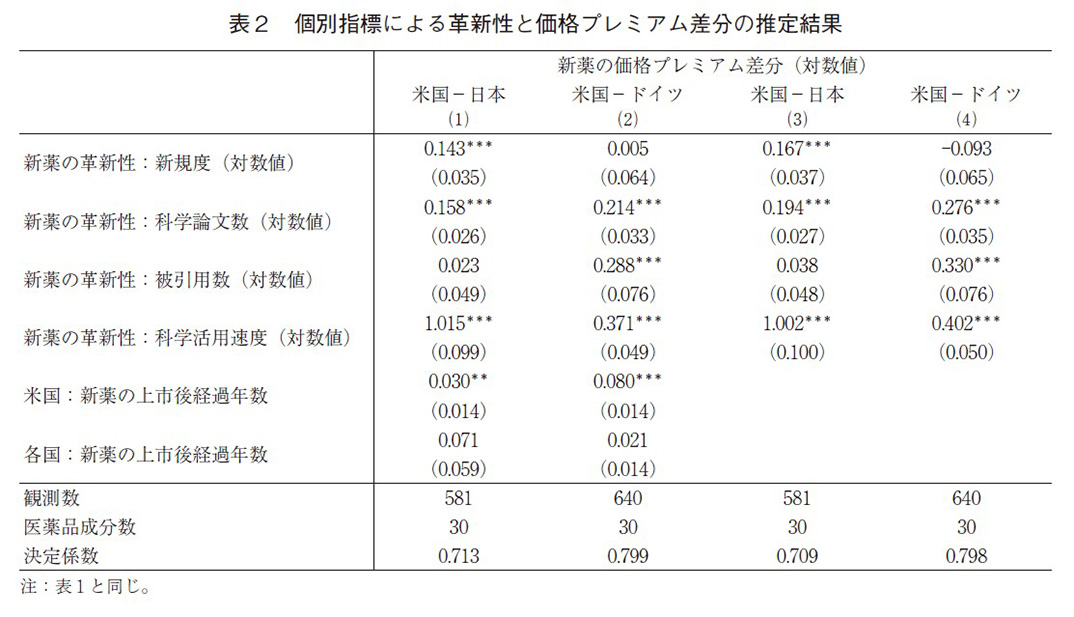
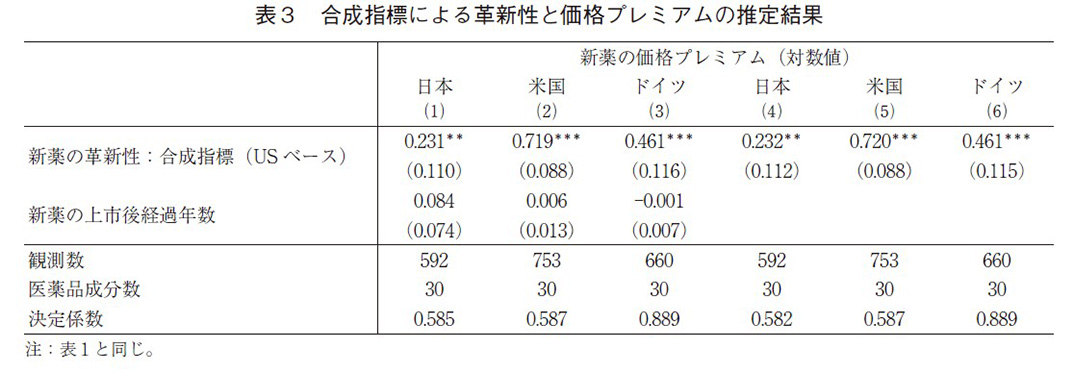
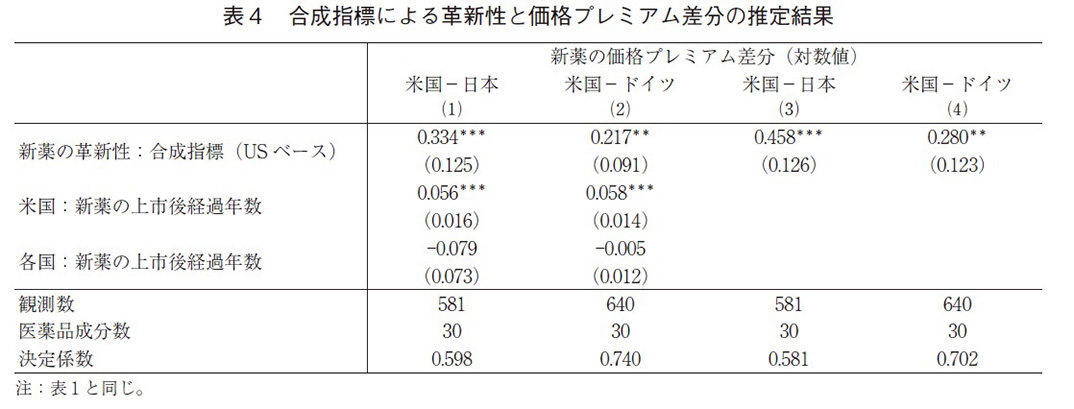
表1と表2では、個別の革新性指標を用いて推定を行ったが、表3と4では4つの革新性指標の合成指標を作成し、同様の推定を行った。合成指標は表1の式(2)における米国の革新性指標の係数値を、それぞれの革新性指標と掛け合わせて求めている。これは、米国市場において革新性指標が最も価格プレミアムに反映されていることを考慮している。日米独の革新性指標の係数値の平均値で合成指標を構築しても、基本的な結果は同じである。
表3と表4の推定結果は、表1と表2の結果と整合的である。革新性(合成指標)は日米独の3か国いずれにおいても正で有意であり、また、差分モデルにおいても正で有意となった。差分モデルでは新薬の上市後経過年数を除くと、その係数値も大きくなっている。また、係数値の大きさから日本はドイツと比較しても、革新性が価格プレミアムに十分に反映されにくい傾向を示している。表3の式(4)と式(5)の米日の合成指標の推定値の差は、表4の式(3)の推定値とほぼ等しいので、表3の式(4)と式(5)の推定値には大きなバイアスは無いと考えられる。この点は、米独にも当てはまる。したがって、表3の式(4)から式(6)の推定にはほぼバイアスがないと考えられ、この係数値から、日本の新薬の価格プレミアムが革新性を反映する程度は米国の約3割、ドイツの場合は米国の約6割ということになる。
この結果は、「新薬の比較薬に対する価格プレミアム:日米欧のマッチト・サンプルによる分析」(政策研ニュースNo.62)の分析結果と整合的である。前回の分析では、日欧と米国の価格プレミアムの関係を分析し、米国で反映される価格プレミアムの約3割しか日本では反映されず、ドイツでは約7割が反映されるという結果を得た(例えば、米国で30%の価格プレミアムがあれば、日本では価格プレミアムが9%となる)。これらの結果をあわせると、新薬の革新性がその価格プレミアムに反映される程度が異なることが、日米独の価格プレミアムの差をかなりの程度、説明していると予想される。
結語
本稿では、新薬の革新性の指標を新たに構築し、日本、米国およびドイツの薬価制度が、革新性をどのように評価してきたかを、新薬の比較薬に対する価格プレミアムのマッチト・データを利用して分析を行った。分析では、Comanor 他(2018)と「新薬の比較薬に対する価格プレミアム:日米欧のマッチト・サンプルによる分析」(政策研ニュースNo.62)を拡張し、日欧では米国と比較して、価格プレミアムの水準と変動が小さいことの要因を新薬の価格プレミアムにおける革新性の評価の視点から検証した。マッチト・サンプルを利用することにより、薬価に作用する医薬品の疾患レベルの欠落変数(我々が利用不可能なデータでコントロール出来ない要因)や新薬と比較薬の組み合わせにおいての欠落変数が、推定を歪める可能性を大幅に減らすことが出来る。主要な知見と示唆は以下の通りである。
第一に、米国の新薬の価格プレミアムの変動は、ドイツあるいは日本と比較してより強く新薬の革新性の程度を反映している。我々の試算では、日本の新薬の価格プレミアムが革新性を反映する程度は米国の約3割、ドイツの場合は米国の約6割ということになる。したがって、米国の価格プレミアムが高い原因のひとつは、新薬の革新性をより反映していることにある。ただし、あくまでも原因のひとつである。
第二に、医薬品特許の科学論文引用データから我々が新たに構築した新薬の革新性の指標が、米、独、日の価格プレミアムの変動を有意に説明することは、サイエンスが創薬イノベーションの重要な原動力であり、サイエンスの進展を、広範に、かつ高いスピードで発明に活用することが、革新的な創薬に重要であることを示している。
第三に、初期の価格プレミアムへの革新性の反映度合いと、ライフ・サイクルでみた価格プレミアムへの革新性の反映度合いを比較すると、米国では日独と比べて、後者の反映度合いの方が大きい傾向が見られた。米国では上市後に認識される新薬の革新性が価格に反映されるメカニズムがあることを示唆している。
今後の研究課題は多いが、以下が重要だと考える。まず、今回の推定で利用できた対象医薬品のサンプルは小さく、これを拡大していくことが重要である。類似薬効比較方式ではなく、原価計算方式で薬価が定められた医薬品も、適切なコントロールグループを設定して分析対象とする必要がある。第二に、欧州のデータとして、英国とフランスを追加した分析を行う必要がある。第三に、革新性が日本の薬価制度で、米独より薬価に反映されない原因を究明していく必要がある。有用性加算率や外国平均価格調整率のデータを踏まえて検討できるが、そのためにはサンプルサイズの拡大も必要になるだろう。第四に、革新性指標の更なる検討も必要である。本稿では、主に研究におけるサイエンスの活用に焦点をあてたが、臨床試験の結果とその論文データの活用も重要である。特に、臨床試験は比較薬との薬効の差を直接示している場合がある。最後に、革新性指標の中でサイエンス活用速度が重要な理由についても解明していく必要がある。活用速度はファースト・イン・クラス等の先行優位性の獲得に寄与しているのかもしれないが、その検証は今後必要になるだろう。
補論1 使用データ一覧と分析データの構築手順
使用データリスト
① IQVIA Pricing Insights(科研費B でライセンス)、② サンエイレポートの特許データ、保護期間や再審査期間情報、③ Clarivate 社の医薬品特許論文情報(科研費B でライセンス)、④ 中医協の薬価算定情報から構築した医薬産業政策研究所作成の薬価情報(加算率、外国平均価格調整率等)、⑤ 中医協の薬価算定情報から収集した新薬と比較薬の一日薬価、⑥ 中医協の類似薬選定のための薬剤分類、⑦ OECD のGDP デフレーターと購買力平価情報(2015年価格)、⑧ IQVIA World Review Analyst 2018の売上上位医薬品情報。
データ構築手順
我々がIQVIA 社からライセンスしている『IQVIA Pricing Insights』には、日米独英仏の5か国で2010年7月~2019年3月において上市している医薬品について月次レベルで価格情報がある(ただし、日本については価格情報が2010年は欠損値)。『IQVIA Pricing Insights』には流通の各段階での価格情報が収載されているが、本稿では、各国における実勢価格に最も近いと想定される薬局購入価格(PPP)を用いて分析している。
この基本データベースから、一般成分名、国際商品名、剤形及び規格単位の全てを共通とする医薬品単位で各国の価格情報をマッチングし、各国における四半期ベースで価格データを単純平均したデータベースを作成した。この価格データについて、OECD より2015年時点における各国GDPデフレーターと購買力平価の情報を入手し、2015年価格で実質化し、購買力平価で換算したドルベースの価格データを作成した。
次に、IQVIA World Review Analyst 2018の売上上位300の医薬品リストと日本の中医協の薬価算定情報より特定した、その上位医薬品と対応する比較薬のリストを作成し、『IQVIA Pricing Insights』より構築したデータベースと接続作業を行った。
最終的に、日本で上市され、比較薬価ベースで新薬の薬価が決定され、かつ米国及び欧州(独、英、仏)3ヶ国のいずれかでも上市されている医薬品69成分(類似薬効比較方式で算定された新薬69成分それぞれに対応する比較薬のデータ)を抽出した。加えて、これらの分析対象となる医薬品は一般成分名、国際商品名、剤形及び規格単位の全てにおいて各国共通の薬剤が存在することも条件となっている。
さらに、新薬と比較薬との、治療単位での価格比を計算するために、本稿では中医協の薬価算定資料から各医薬品の一日薬価の情報を用いて、各国における新薬の比較薬に対する価格プレミアム(価格比の対数値、新薬の比較薬に対する価格上昇率)を測定した。
また、各成分の革新性(新規度)の指標として、新規作用機序かどうか、あるいは既存作用機序の中で何番目の上市かを、中医協の「類似薬選定のための薬剤分類」をもとに作成した。本資料は「類似薬効比較方式に係る類似薬選定の透明化を図るために作成されている医療用医薬品成分の分類で、薬価算定における薬理作用類似薬を判断する上での基礎資料」である。さらに、革新性指標として、サンエイレポートより各医薬品成分を保護する特許群(物質特許、結晶特許、用途特許)を特定し、Clarivate社の特許論文データベースと接続することで、当該特許群(米国特許)が引用している(Web of Science に登録されている)科学論文の収集を行った。そして、各医薬品成分が、科学論文をどの程度引用しているか(科学論文数)、その科学論文が他の論文にどの程度平均的に引用されたか(被引用数)、どの程度早く科学論文を活用しているか(成分毎に、科学論文の発刊時期とそれを引用している特許の日本出願時期の差の平均値:月ベースのデータで計算し年に換算)、の指標を作成した。
最後に、『IQVIA Pricing Insights』から各国における各医薬品成分の特許保護期間の情報を利用している。価格プレミアムの情報は69成分について入手できたが、革新性指標や新薬と比較薬の特許保護期間情報が入手でき、それらの特許が両方とも有効な期間の薬価データがある医薬品成分は限られている。また、推定では日米独の3か国で共通する医薬品成分を用いて国際比較を行うため、実際の推定作業では69成分を下回る。
補論2 分析の理論的背景
ある新薬i の薬価p は、その国の健康改善への支払い意欲wに比例し、また、当該医薬品の革新性(医薬品の治療効果)の水準q、及びその他の要因αを反映して以下のように決定されるとする。いずれも、疾患と医薬品の組み合わせに依存しており、国による差は無いとする。
pi=wαi(qi)β (1.1)
比較薬の薬価は、これに対応して、
po,i=wα0,i(qo,i)β (1.2)
ここでβ≥0であり、革新性を価格に反映する程度は国によって異なる。もしβ=1であれば、薬価は、革新性の効果に等しく比例的に設定されるということになり、β=0なら価格は革新性を反映しない。
(1.1)と(1.2)式の両辺に対数をとって新薬と比較薬の対数差分をとると、新薬の価格プレミアム(比較薬に対する価格上昇率)は、以下のようになる。
premiumi=lnpi-lnpo,i=β ln(qi/q0,i)+ln (αi/α0,i) (2.1)
基準国(米国)でも同じように薬価が決定されているとすると
premiumi*=lnpi*-lnpo,i*=β* ln (qi/q0,i)+ln (αi/α0,i) (2.2)
となる。
ln(qi/qo,i)は、医薬品の治療効果の上昇率であり、これは2つの医薬品の発明の間の科学的な知識の進歩(scii)の活用等に依存する。科学の進歩と独立した要因で治療効果を高める医薬品の進歩をθiとして定義する。治療効果の中で、科学の進歩で説明できない残差をθiとし、両者は独立しているとする。
ln(qi/qo,i)=δlnscii+θi (3)
この場合、国内の価格プレミアムは、 (2.1)式から
premiumi=β(δln(scii)+θi)+ln(αi/α0,i) (4.1)
同様に基準国(米国)では
premiumi*=β*(δln(scii)+θi)+ln(αi/α0,i) (4.2)
となる。ここでscii の係数は、医薬品の革新性に対する、科学の進歩(および、それによってもたらされるすべての効果)を反映している。ln(αi/α0,i)がゼロ(新薬と比較薬で差が無い)あるいはln(scii)と無相関だとすれば、(4.1)式を推定することによって、偏り無くβを得ることが出来る。相関があればβの推定にバイアスが生ずる。
ln(αi/α0,i)は、疾患の種類で決まっており、これがln(scii)と相関をしても、前者は国に依存しない医薬品の特性で決まっており共通だとすると、国の間で差分をとることによって影響を排除できる。すなわち、(4.1)式と(4.2)式の差分をとると、
premiumi*-premiumi=(β*-β)(δln(scii)+ln(θi)) (5)
となる。差分をとった推定で(β*-β)を偏り無く推定することが出来る。
価格プレミアムは新薬上市の後、新薬および比較薬の薬価改定によって変化をしていく。上市時点の薬価を(4.1)式が与えているとし、経過年tに比例して価格プレミアムが変化していくとすると
premiumi,t=β(δln(scii)+θi)+ln(αi/α0,i)+γt (6)
となる。(6)式の推定によって、価格プレミアムの時間的な変動を要約したパラメターγとともに、複数時点の価格データを活用してβを推定できる(経時的な変動がリニアでγが正しく推定されているとすれば、より正確になる)。国際的な差分の推定によって、初期時点に革新性を価格に反映する程度の国際的な差(Δβ=β*-β)、およびダイナミクスの差(Δγ=γ*-γ)も評価することが出来る。両国で医薬品の上市年が等しいとすると、
premiumi*-premiumi=(Δβ)(δln(scii)+θi)+(Δγ)t (7)
なお、実際の推定モデルでは、新薬の上市年(コホート年)ダミー、暦年ダミーとATC 薬効分類ダミーを導入している。上市年コホート年変数を導入することで、scii のデータのベースになっている、医薬品特許からWeb of Science への引用データが引用慣習やトランケーションで変化していくことによる影響をコントロールできる。特許文献から科学論文の引用性向が増大する、あるいは科学論文の被引用件数にトランケーションが存在する等である。すなわち、推定では同じ年に上市された医薬品の間での変動のみを利用している。暦年ダミーは、我々の薬価データがバランスト・パネルでは無く、その結果、価格プレミアムが変動していくことが、薬価のダイナミクスに影響を与えるので、これをコントロールしている。ATC薬効分類ダミーは、疾患特有の需要と供給要因をコントロールしている。
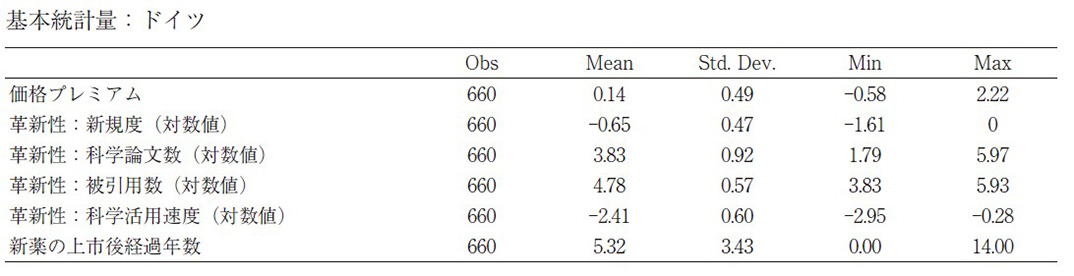
補論3 基本統計
参考資料
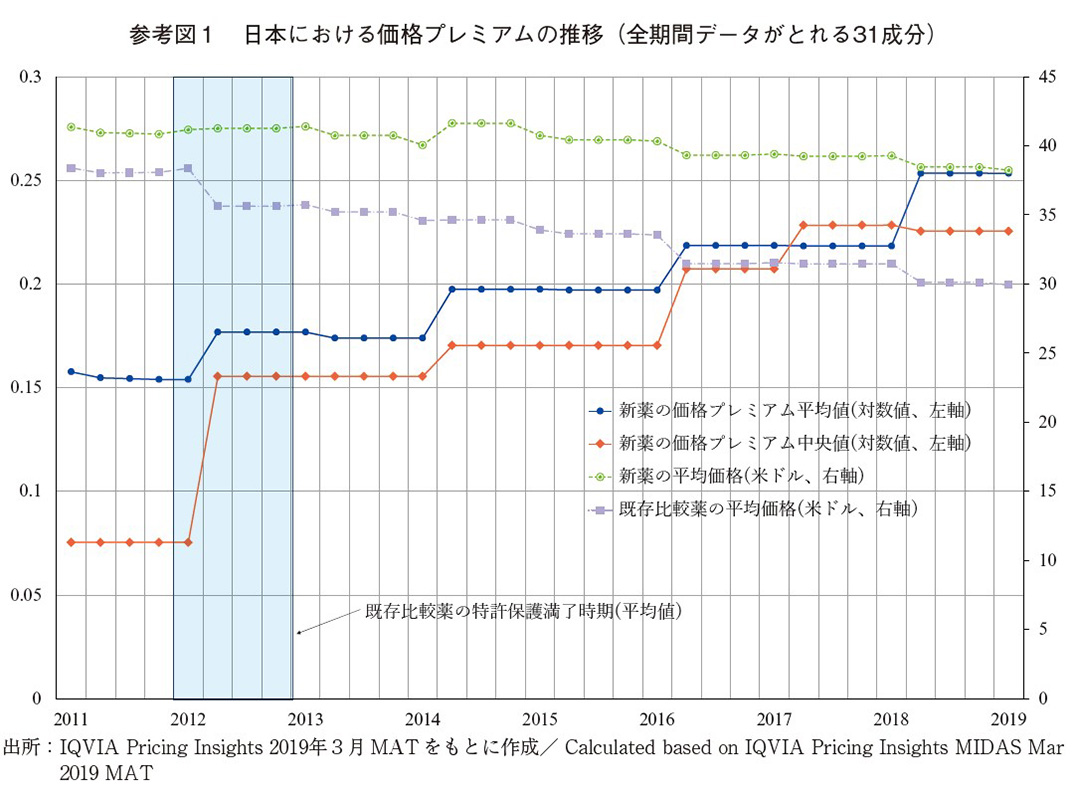
参考図1は日本における31医薬品成分の価格プレミアムの推移を平均値と中央値で示している(左軸)。また、当該新薬とそれに対応する比較薬の薬価も示している(右軸)。価格プレミアムの傾向として平均値でみると、比較薬の独占保護期間以前は、平均値は0.15、中央値で0.08と安定している。日本では比較薬の独占保護期間以後、平均値と中央値いずれも同様の上昇傾向が見られるが、これは主に比較薬の薬価が下落することに起因している。新薬はほとんどが新薬創出加算の対象となっているため、一定期間まで薬価は下落せず維持されている一方、比較薬については、2012年頃に特許保護が満了しており、それに対応した薬価規制の変化や競争の影響により下落傾向にあり、価格プレミアムが大きく上昇している。
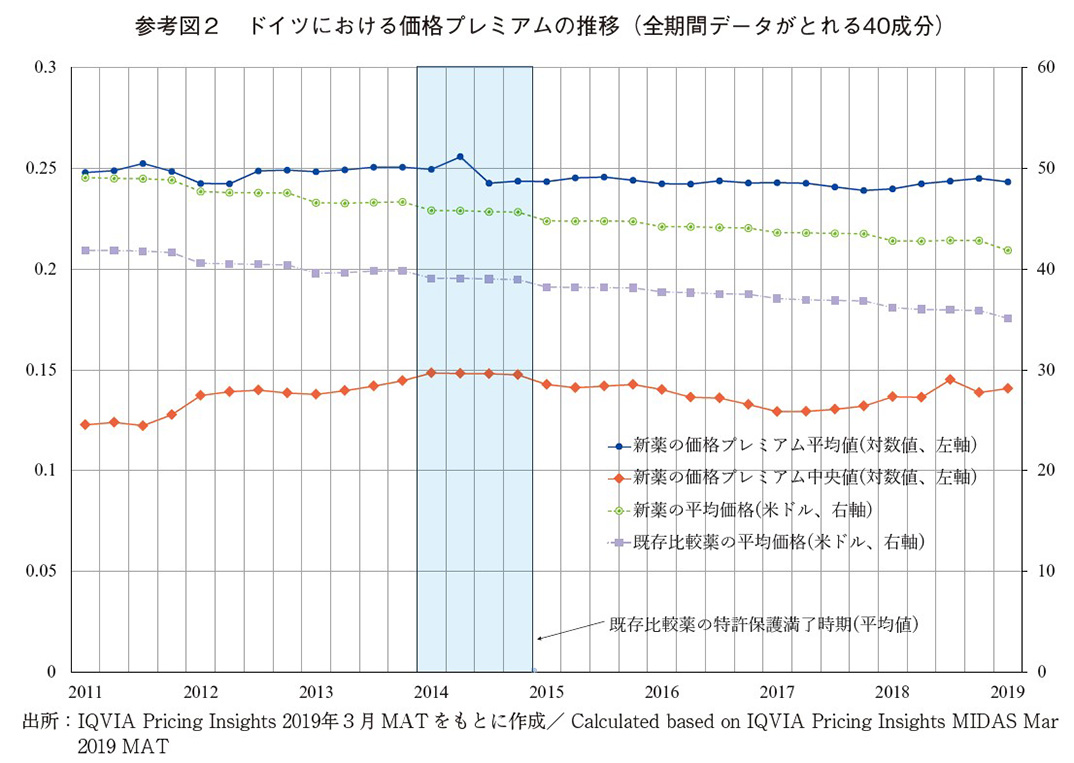
参考図2はドイツにおける40医薬品成分の価格プレミアムの推移(左軸)。また、当該新薬とそれに対応する比較薬の薬価も示している(右軸)。価格プレミアムの傾向として平均値でみると、比較薬の独占保護期間以前はやや上昇傾向にあるが、全期間で0.23から0.24へとほぼ一定に推移している。中央値でみると、比較薬の独占保護期間以前は経年とともに価格プレミアムは0.11から0.14程度へとやや上昇傾向にある。ドイツでは新薬と比較薬ともに薬価は物価水準の変動の影響もあり、実質価格では経年とともに同程度の下落傾向にある。比較薬については、2014年頃に特許保護が満了しており、その後、価格の下落は加速しているが、日米と比べると価格プレミアムへの影響は軽微である。
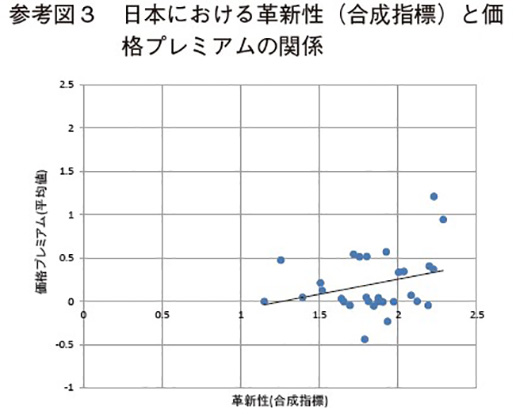
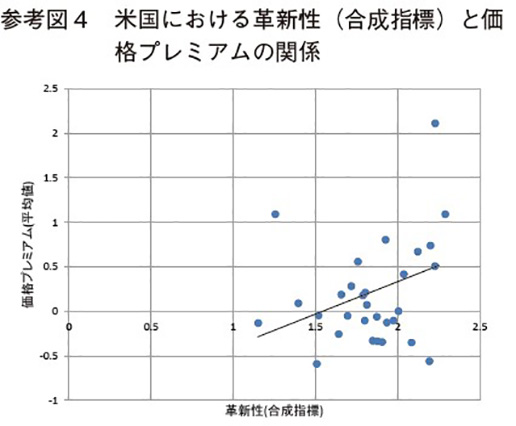
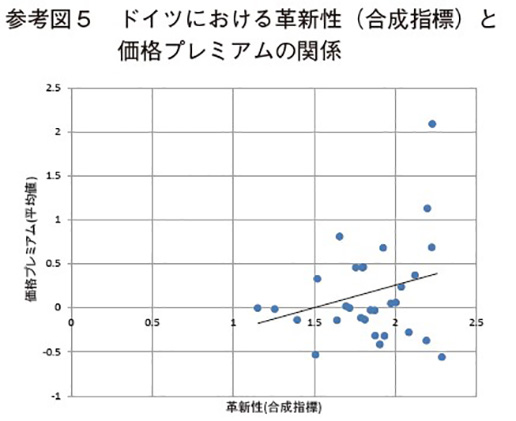
以下の参考図3~図5は、横軸に革新性(合成指標)、縦軸に価格プレミアムの推定期間中の平均値をとって、各国別の革新性と薬価プレミアムの関係を示している。これらの図は本文の推定結果と整合的である。
-
1)本稿の研究には医薬産業政策研究所の研究員各位から有益なコメントを頂いたことに感謝申し上げたい。本研究は、科研費基盤B(「創薬イノベーションとインセンティブの研究」、18H00854)の支援を受けて実施した。
-
2)Comanor, W.S., Schweitzer, S.O., Riddle, J.M., and Schoenberg, F.(2018)"Value based pricing of pharmaceuticals in the US and UK: Does centralized cost effectiveness analysis matter?" Review of Industrial Organization, 52, 589-602.
-
3)特許が引用する科学技術論文によってサイエンスの貢献を計測する試みは多数行われており、例えば、Sampat and Lichtenberg(2011)はそれを活用して公的な支援の成果がどの程度創薬に活用されているかを分析している(Sampat B.N., Lichtenberg, F.R.(2011)"What are the respective roles of the public and private sectors in pharmaceutical innovation?"Health Affairs, 30, 332-339.)。
-
4)科学論文が重要な役割を果たしているにもかかわらず、引用情報が欠如している可能性は相当程度あると考えられる。米国特許法は、先行文献を開示する義務を発明者(出願人)に課しており、また、不完全であれば審査官が引用を追加することになっているので、引用情報は特許庁の中で最も完備されている。このため、我々は医薬品の米国特許の科学論文への引用(米国特許のフロントページ(書誌事項)の引用)を利用して、革新性指標を構築している。しかし、審査官は審査の過程において高い頻度で特許文献を追加しているが、科学論文の場合は主として発明者(出願人)が引用している場合が多い。このため、発明者(出願人)が科学論文の引用を何らかの事情で記載しなかった場合、審査官がそれを補完していない可能性は高いと考えられる。

