目で見る製薬産業 ドラッグ・ラグ:国内NME承認品目の上市状況 米国・欧州との上市時期比較
医薬産業政策研究所 主任研究員 澁口朋之
はじめに
本ニュースで吉田が紹介した1)ように、ドラッグ・ラグには2つの側面があり、1つは他の国では発売されているのに日本では発売されていないという「未承認薬」の問題であり、もう1つは日本でも発売されてはいるものの発売までに要した期間が他の国よりも長かったという「ラグ(遅延)」についてである。後者のドラッグ・ラグについては、粟村が世界の売上高上位300製品の日米欧の上市状況について報告2)しており、ドラッグ・ラグが近年改善傾向であることを報告している。本ニュースでは2010年から2020年に国内で新有効成分含有医薬品(New Molecular Entity, NME)として承認された品目を対象に、日米欧における上市時期の差やその上市順位について年次推移に着目して調査を行ったので報告する。
研究方法
対象とした国内でNMEと承認された品目は、政策研ニュースNo.62にて吉田が報告した「日本で承認された新医薬品とその審査期間」3)を参考とした。また、それら品目の米国、欧州での承認状況については前回のニュース4)で報告した「グローバル承認品目」のデータをもとに承認状況等をアップデートして使用した。各品目の上市日はEvaluate社のEvaluate Pharmaを用い、日米欧における"First Launch"日を参照した。情報のない一部の品目についてはクラリベイト社の Cortellis Competitive Intelligence を用い、各品目の"Development Status"において日米欧(欧州の場合、"EU"もしくは英仏独)で"Launched"となった最も早い"Date"を採用した。日本の上市日については上記のデータベースを基本とし、上市日の記載がなかった品目についてはインタビューフォームに記載される「販売開始年月日」を採用した。
また、NMEとして最も早い上市日を採用しているため、適応が必ずしも各国で一致するとは限らない。ただし、海外で初上市時の適応とは大きく異なる適応(ドラッグ・リポジショニング)で国内承認されたことが審査報告書から確認できた場合、各国の初上市日を国内承認時の適応に合わせた。
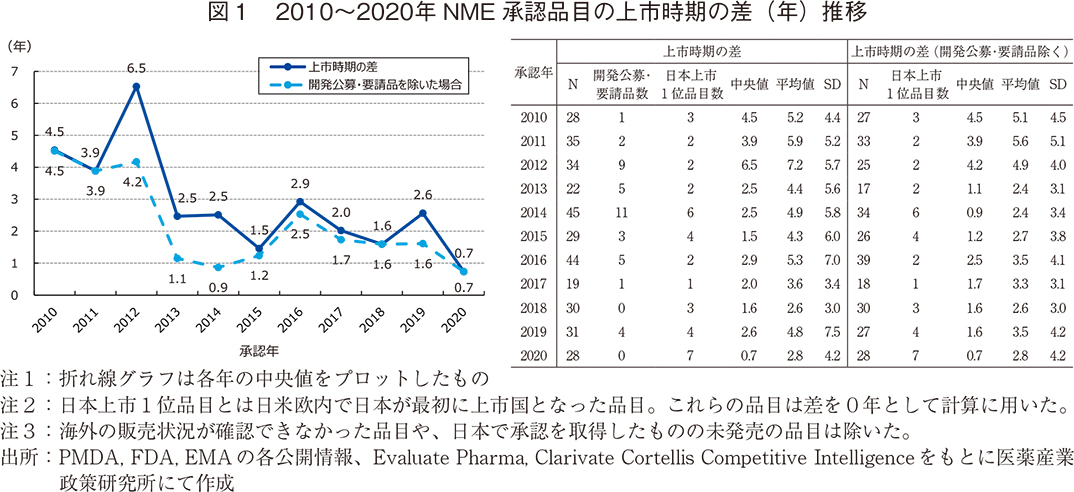
2010~2020年承認品目の上市時期の差
2010~2020年に日本でNMEとして承認された品目は436品目あった。そのうち、2021年5月末時点で米国・欧州の両方もしくはどちらか一方で上市済みの品目は345品目あった。図1は上記品目を日本での承認年ごとに分け、日米欧で最も早い上市日から日本の上市日との差を「上市時期の差」として算出し、その中央値をグラフ化したものである。なお、日本が日米欧内で最も早い上市国となった品目はその差を「0年」として計算した。また、2つの折れ線グラフで構成されるが、一方は各年におけるすべての品目における上市時期の差であり、もう一方はその中から厚生労働省において開催された「医療上の必要性の高い未承認薬・適応外薬検討会議」における検討結果を受けて申請された品目を「開発公募・要請品」として計算の対象から除いた場合の値である。
2010~2012年に承認された品目の上市時期の差の中央値は3.9~6.5年程度であったが、2013年以降は上記期間より短縮され、0.7~3年弱で推移した。開発公募・要請品を除いた場合は全体的に短縮されるが、2010~2012年が3.9~4.5年、それ以降は0.7~2.5年と傾向としてはすべての対象品における上市時期の差と同様であった。
図1右表に各年の品目数、平均値や標準偏差などを開発公募・要請品の有無でまとめた。平均値においても中央値の傾向と同様に2010~2012年の承認品目では5.2~7.2年程度であったが、2013年以降は短縮傾向が見られ、2.6~5.3年の間を推移した。開発公募・要請品など一部の品目で欧米の上市日から10年以上経過した品目が一定程度含まれるため、平均値は中央値よりも高めであった。開発公募・要請品を除いた場合(表1右)、その短縮傾向はより明確となり2010~2012年の承認品目では4.8~7.2年程度であったものが2013年以降は2.6~3.5年程度であった。
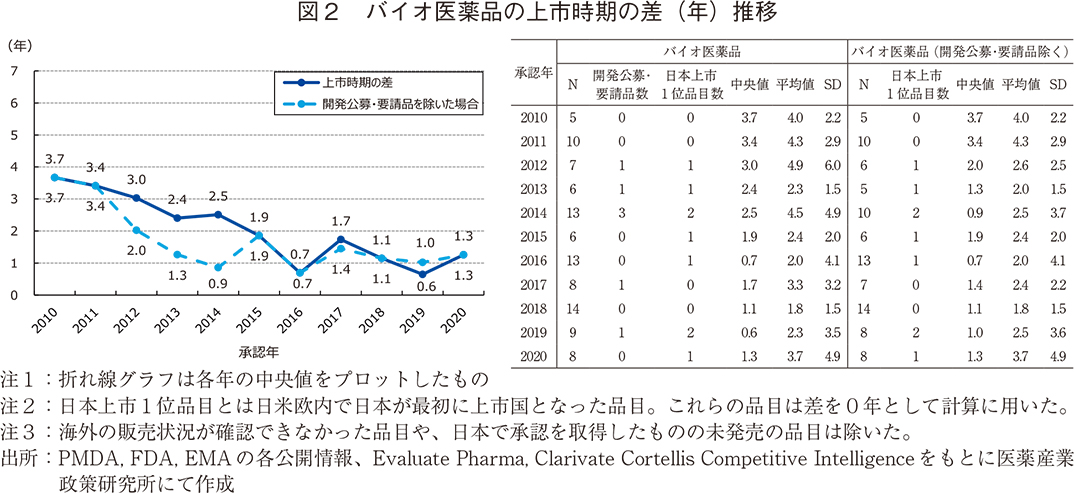
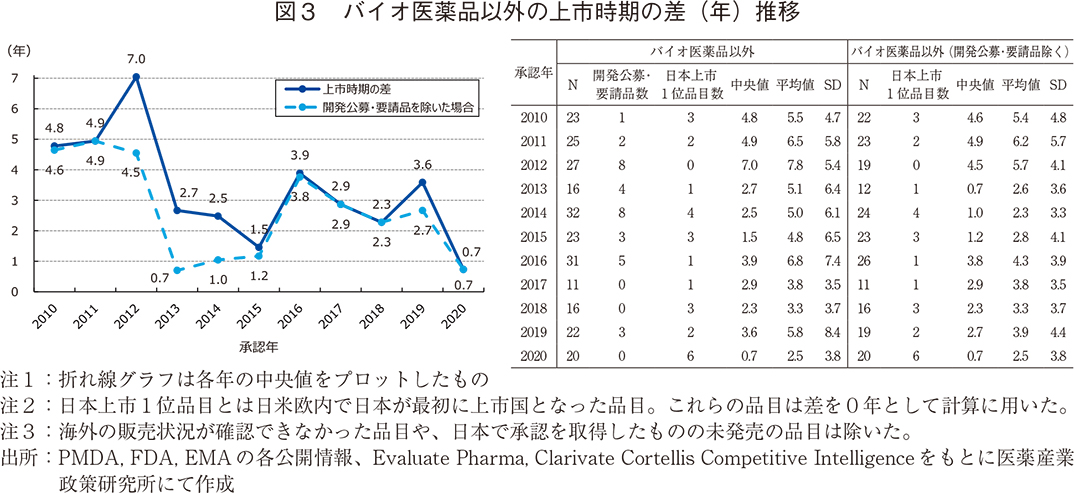
バイオ医薬品とそれ以外の品目の上市時期の差
図1に示した品目をバイオ医薬品5)と低分子医薬品等のバイオ医薬品以外の品目で分類し、上市時期の差を比較した(図2、3)。バイオ医薬品では差が年を追うごとに短縮傾向にあり、2010年は中央値で3.7年であったものが2020年には1.3年程度まで短縮され、特に2015年以降はいずれの年でも2年以内に収まっていた。平均値においてはばらつきの大きい年があるものの、2010年代前半は4年以上の年が多かったのに対し、2015年以降は4年未満で上市につながっていた。
バイオ医薬品では開発公募・要請品の数が少なかったが、それらはいずれも国内上市までに欧米から9年以上経過したものであり、対象品目を除いた際に中央値や平均値の低下が見られた。
低分子医薬品をはじめとするバイオ医薬品以外の品目においても2013年以降はそれ以前に比べ上市時期の差が短縮される傾向にあった(図3)。2012年では中央値で7年の差が生じていたが、2013年以降は長くても3.9年、2013年(開発公募・要請品除く)や2020年では中央値が0.7年程度と1年を切る年も散見されるようになってきた。
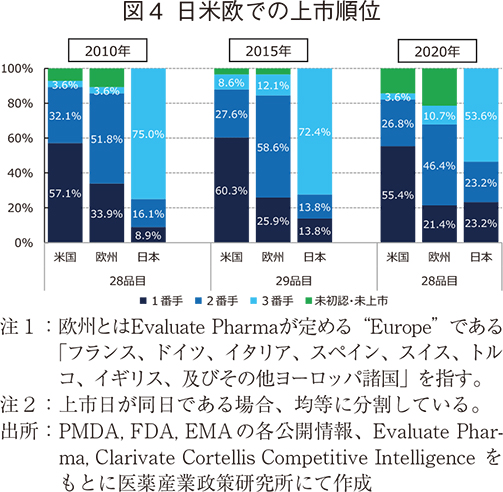
日米欧の上市順位
前節まで欧米との上市時期の差について年次推移をみてきた。2013年度以降、その差は短縮傾向にあったが、それに伴い3極で上市する順位に変化があったのかを調査した。図4に示すように2010年の国内承認品目において、最初に上市されたのが米国となる品目が6割近くを占め最も多く、次いで欧州、日本は3番手となることが多かった。この傾向は2015年にかけてその傾向に変わりはなかったが、2020年においては初上市が米国となる品目が最も多かったものの、初上市が日本である品目が欧州に比べて多くなった他、日本において1番手・2番手上市品の合計は5割近くまで拡大した。
考察
ここまで2010~2020年に日本でNMEとして承認された品目について承認年別に上市ラグの推移を見てきた。いずれの年においても2013年以降は上市ラグが短縮傾向にあり、特にバイオ医薬品ではその傾向が強かった。また、2020年の承認品目では日本が初上市となる品目が全28品目中7品目と、欧州を超える年も見られるようになった。その背景として①日本を含む国際共同治験の増加に伴う開発ラグの短縮、②日本の審査期間短縮・安定化、③新薬創出・適応外薬解消等促進加算制度等の薬事・薬価制度の環境整備が挙げられる。
日本を含む国際共同治験増加による開発ラグの短縮ついては、2020年の中央値である0.73年より上市時期の差が短い14品目中、9品目において日本を含む国際共同治験の成績に基づいた承認申請が行われたことが審査報告書から確認でき、その国際共同治験の多くが米国およびEUにおいて主要な試験成績として承認申請が行われていた。一方、0.73年を超える14品目では3品目にとどまっており、国際共同治験実施数増加が開発ラグの短縮に寄与していることが示唆された。
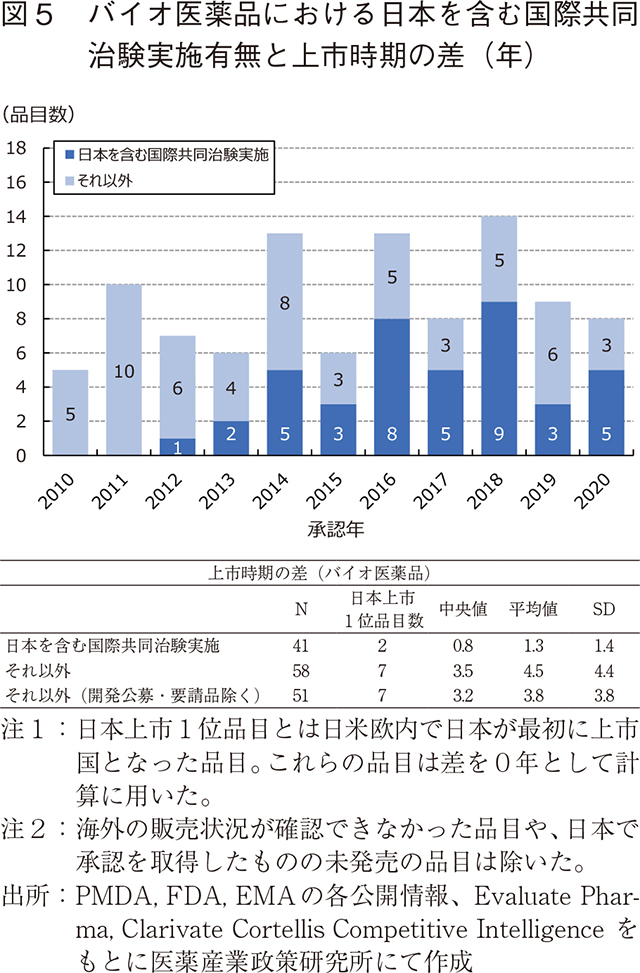
そこで、比較的上市時期の差の短縮傾向が分かりやすかったバイオ医薬品に限定して日本を含む国際共同治験の成績に基づいた承認申請が行われたことが審査報告書から確認できた品目とそれ以外について、その品目数の推移と上市時期の差について比較した。図5に示す通り、2012年以降の国際共同治験の成績に基づいて承認申請された品目は増えつつあることが分かり、またそれらの品目の上市時期の差は中央値で0.8年とそれ以外の品目の中央値3.5年に比べて短いことが分かる。開発公募・要請品を除いても中央値は3.2年であり、日本を含む国際共同治験の実施により、開発ラグが短縮される傾向にあると考えられる。
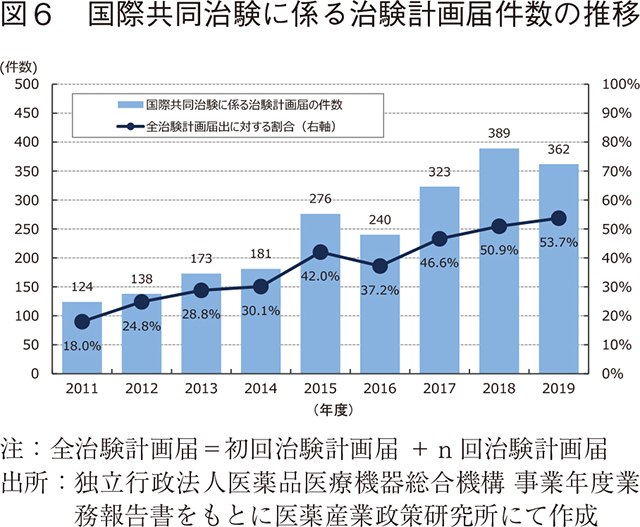
また、粟村が報告した6)ように日本で実施される国際共同治験は増加しており、2019年度の治験計画届674件中、国際共同治験に係るものは362件(53.7%)と過半数を占めていた(図6)。この傾向が続くのであれば欧米との上市時期の差は拡がりにくいと思われる。
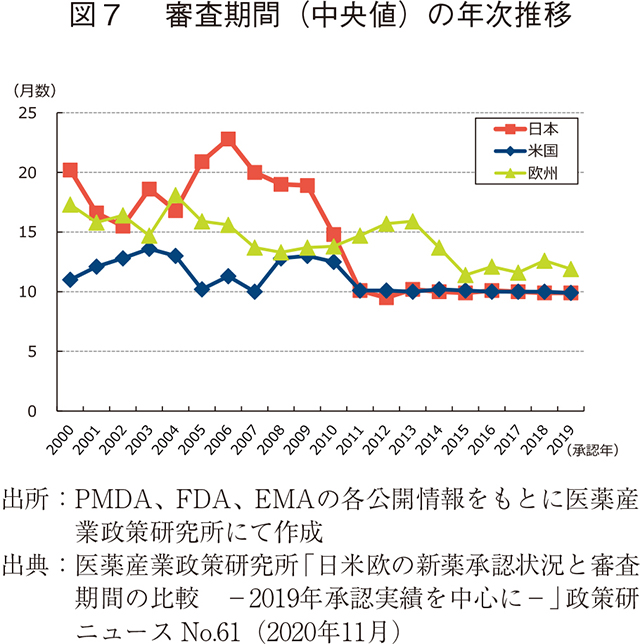
日本の審査期間の短縮についてはニュースNo.61で吉田らが報告した7)ように、2011年以降、日本と米国の審査期間の中央値は同様(約10ヶ月)となっている(図7)ほか、日本の審査期間は米国や欧州と比べて品目ごとのばらつきが比較的小さく安定していることも特徴である。審査期間の差が小さくなり、近年ではほとんどその差が無いことも上市時期の差の短縮に影響していると思われる。
最後に挙げた薬事・薬価制度の整備についてその効果を定量的にここでは測ることはできないが、革新的新薬の開発やドラッグ・ラグ解消に取り組むインセンティブとして新薬創出・適応外薬解消等促進加算制度が2010年度から導入された。対象品目については薬価が特許期間中維持されることで医薬品開発コストの回収予見性が高まった。また2015年度からは世界で最先端の治療薬を最も早く提供することを目指し、先駆け審査指定制度(2020年から先駆的医薬品指定制度)等が施行されるなど、一連の制度整備が日本市場への上市インセンティブを高め、上市時期の差の短縮に寄与したと思われる。
まとめ
今回2010~2020年の日本におけるNMEとして承認された品目について米欧との上市時期の差について調査を行った。調査では米国や欧州で上市が先行する傾向は変わらないものの、2013年以降、上市時期の差は中央値で4年以上あったそれ以前に比べ、年によってはその差が1年を切るなど、短縮している傾向が見られた。その背景として日本を含む国際共同治験の増加、日本の審査期間短縮・安定化、薬事・薬価制度の環境整備などがその短縮要因として考えられた。
一方、2018年度に行われた薬価制度の抜本改革における新薬創出・適応外薬解消等促進加算制度の見直しや本年度の中間年改定の実施など薬価をめぐる環境は年々厳しくなっており、日本におけるドラッグ・ラグの再燃が危ぶまれている。現時点で上市時期の差への影響は見られなかったが、日本に上市するインセンティブが下がることで、日本が国際共同治験に今後組み込まれにくくなるなど開発ラグに影響すれば、上市時期の差の拡大に直接つながりかねない。医薬品開発に時間がかかることを考慮するとその影響は比較的長期間に及ぶものと思われる。
また、本ニュースで吉田が報告した1)ように日本に開発拠点を持たない新興バイオ医薬品企業の品目を中心に未承認薬が増加傾向にあるといった新たな課題も浮き彫りとなった。日本の患者様に革新的新薬がいち早く届けられるよう、開発環境の整備と共に魅力ある日本の医薬品市場環境も必要であるように思われる。
-
1)医薬産業政策研究所「ドラッグ・ラグ:国内未承認薬の状況とその特徴」政策研ニュース No.63(2021年07月)
-
2)医薬産業政策研究所「世界の売上高上位300製品の上市状況の日米欧比較 ドラッグ・ラグの解消は進んでいるのか」政策研ニュース No.57(2019年07月)
-
3)医薬産業政策研究所「日本で承認された新医薬品とその審査期間 2020年承認実績と過去10年の動向調査」政策研ニュース No.62(2021年3月)
-
4)医薬産業政策研究所「日米欧NME承認品目の創出企業の国籍 2010~2019年の承認品目を中心に」政策研ニュース No.62(2021年3月)
-
5)バイオ医薬品は日本における承認情報において抗体等一般名に遺伝子組換え(Genetical Recombination)とある品目、また、血液製剤やワクチンなど添付文書に特定生物由来製品、生物由来製品と記載されている品目とした。
-
6)医薬産業政策研究所「近年の国際共同治験の参加国の分析 臨床試験登録システムClinicalTrials.govを基に」政策研ニュース No.58(2019年11月)
-
7)医薬産業政策研究所「日米欧の新薬承認状況と審査期間の比較 2019年承認実績を中心に」政策研ニュース No.61(2020年11月)

