目で見る製薬産業 ドラッグ・ラグ:国内未承認薬の状況とその特徴
医薬産業政策研究所 主任研究員 吉田昌生
医薬産業政策研究所では、日本、米国、及び欧州の医薬品の承認情報および審査期間に関して、独立行政法人医薬品医療機器総合機構(PMDA)、U.S. Food and Drug Administration(FDA)、及び European Medicines Agency(EMA)がそれぞれホームページ等で公表している情報をもとに、継続的に収集、分析している1、2、3)。
2018年度に行われた薬価制度の抜本改革における新薬創出・適応外薬解消等促進加算制度の見直しや、2021年度の中間年改定の実施等薬価をめぐる環境は年々厳しくなっており、日本の医薬品市場への上市インセンティブ低下に伴う「ドラッグ・ラグ」の再燃を危惧する声が多くなっている。このため、今回のニュースでは、2010年から2020年に日米欧各極で新有効成分含有医薬品(NME:New Molecular Entity)として承認された品目を対象とし、「ドラッグ・ラグ」の1つの側面である「国内未承認薬」の状況とその特徴について調査を行ったので報告する。
1-1. 序論
「国内未承認薬」とは、海外で承認されていながら日本では承認されていない薬のことである。現在、国内未承認薬を使用した場合、それにかかわる費用は個人負担となる。また、病院では国内未承認薬による治療を受けた場合、本来医療機関が保険請求できる薬剤費・診察料・検査料もすべて保険請求ができなくなる。その場合は、治療にかかったすべての費用を全額自己負担しなければならないこともある。さらに、国内未承認薬を使って万一副作用が出た場合は、国の医薬品副作用被害救済制度は適用されない4)。
この国内未承認薬の問題は、2000~2010年代にかけて我が国で課題として指摘されてきた「ドラッグ・ラグ」の1つの側面である。ドラッグ・ラグは、海外で既に承認されている薬が日本国内での薬事承認を得るまでに長い年月を要するという問題のことであるが、日本製薬工業協会によるとドラッグ・ラグには2つの側面があるとされており、1つは、他の国では発売されているのに日本では発売されていないという「国内未承認薬」の問題。もう1つは、日本でも発売されてはいるものの発売までに要した期間が他の国よりも長かったという「ラグ(遅延)」についてである5)。「ラグ(遅延)」の問題については、国と製薬産業が課題解決に取り組んだ結果、日本を含む国際共同治験の増加、日本の審査期間短縮・安定化、薬事・薬価制度の環境整備等がその短縮要因となり、近年改善されつつあることを粟村および澁口が報告している6、7)。
最近、PMDA理事長である藤原氏は、国立がん研究センターの調査による「米国か欧州で承認され、日本未承認または適応外であるがん領域の医薬品数とその推移」をもとに、抗がん剤のドラッグ・ラグが拡大しているとの報告をおこなった8)。要因のひとつとして、日本法人や国内管理人を持たない新興バイオ医薬品企業(Emerging Biopharma)が多くの抗がん剤開発を担っているため、日本で開発を行っていない実態があると述べている。また、段落冒頭にて「適応外」という言葉が出てきたが、日本で医薬品として承認され使用されている薬でも、海外で認められている使い方(適応症)が認められていない場合がある。これを「未承認適応(適応外使用)」といい、国内未承認薬と同じように患者さんにとって問題となっている4)。
1-2. 未承認薬および適応外薬問題への取り組み
2010年4月に薬価制度として「新薬創出・適応外薬解消等促進加算」が試行的に導入されるとともに、厚生労働省は、「医療上必要性の高い未承認薬・適応外薬検討会議」(以下「検討会議」)を設置し、製薬企業による未承認薬・適応外薬の開発を促進してきた10、11)。ここで、国内未承認薬および適応外薬の開発促進の状況を理解するため、本検討会議での検討結果を受けて開発企業の募集又は開発要請が行なわれた医薬品の承認状況を示した(表1、図1)。
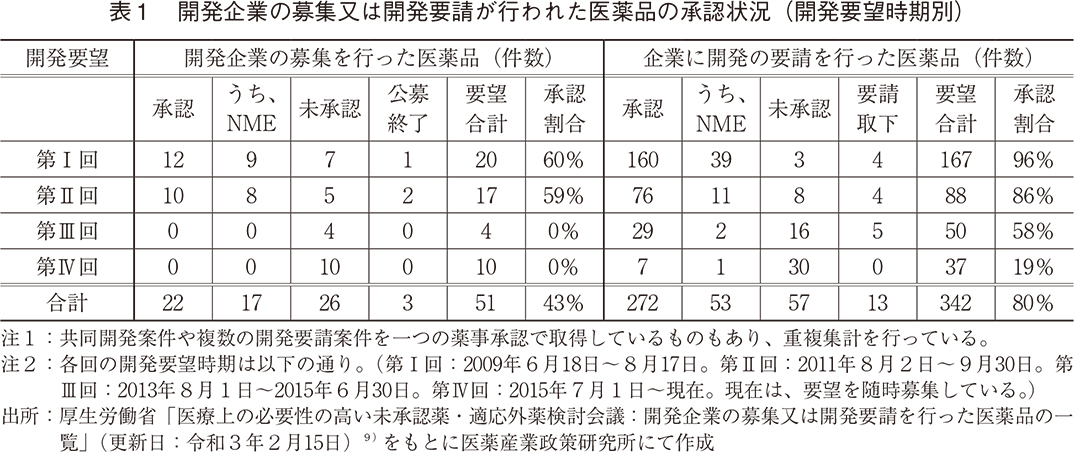
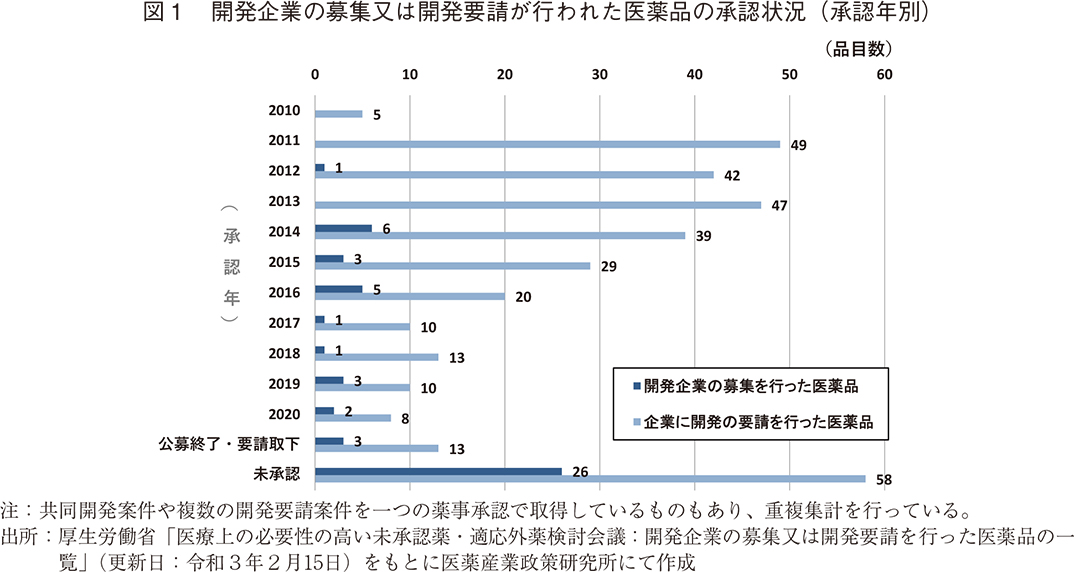
これまでに厚生労働省から第Ⅰ~Ⅳ回の計4回の開発要望が出されており、要望された医薬品の総計は393件にのぼる。開発要望医薬品の承認状況を見ると、要望件数全体393件のうちの294件(75%)が承認されており、そのうちの70件63品目がNMEであった。開発要望医薬品の承認状況を承認年別に見ると、ドラッグ・ラグが課題となっていた2010年代前半に、数多くの対象となる医薬品の承認が得られていた12)。このように、国、医療関係者、製薬企業の一体となった取り組みにより、多くの未承認薬・適応外薬が開発され薬事承認に至り、この問題が改善されてきた。
2. 調査方法
今回のニュースでの調査は以下の方法にて行った。調査対象は2010年から2020年に日米欧各極でNMEとして承認された品目とし、欧米での承認日と日本での承認状況を比較することで、国内未承認薬を特定した。具体的には、PMDA「未承認薬データベース(更新日2021年3月1日)」に記載の品目をもとに13)、医薬産業政策研究所にて構築したデータベース1)、2、3を用いて日米欧のNME承認情報を確認し、情報を補完した。ただし、ワクチンと再生医療等製品(EMAにてAdvancedtherapy medicinal products(ATMP)に該当する品目を含む。)に区分される品目は今回の調査対象から外した。解析には、標準的な統計解析ソフトStata/IC 14.0 for Windows(Stata Corp LP, Col-lege Station, TX, USA)を使用した。
なお、本調査は承認数や開発状況の観点からの分析であり、日本国内の医療ニーズを考慮した調査でないことは調査の限界として事前に提示しておく。
3. 国内未承認薬数とその割合の経時変化
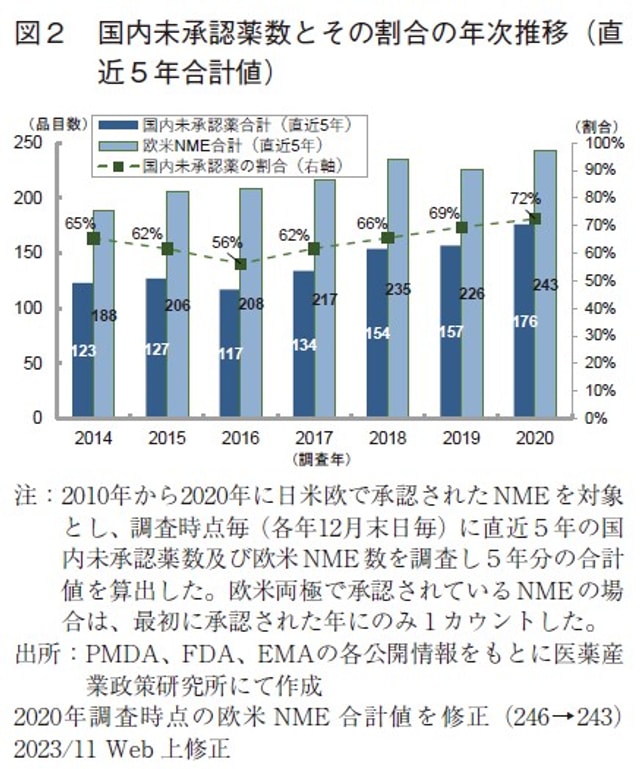
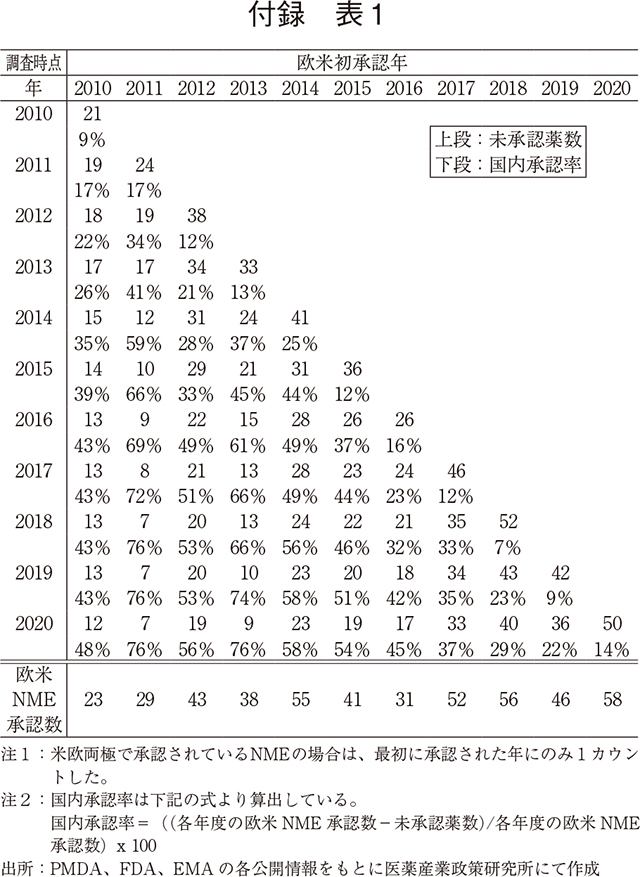
国内未承認薬数の推移を確認するため、2010年から2020年の日米欧各極のNME承認情報を用い、調査時点毎(各年12月末日毎)に国内未承認薬数および欧米で承認されたNMEについての日本国内での承認率を集計した(補足1)。本データセットを用い、2014年から2020年の調査時点毎に直近5年の国内未承認薬数を集計し、5年分の合計値を算出した。比較として、欧米NME数合計値についても同様に算出した。加えて、欧米NME数に対する国内未承認薬数の割合を算出し経時変化を追った(図2)。なお、米国と欧州の両極で承認されているNMEの場合は最初に承認された年にのみ1カウントした。
年次推移を追った結果、2014年から2016年調査時点にかけて国内未承認薬の割合は減少(65%→56%)していたが、2016年調査時点を底として国内未承認薬の割合が増加し、2020年末時点では直近5年の欧米NME数の72%が国内未承認薬であった。また、この期間は欧米NME数自体も増加しているため、国内未承認薬数(直近5年合計)は2016年末時点では117品目であったが、2020年末時点では176品目と1.5倍に増加していた。
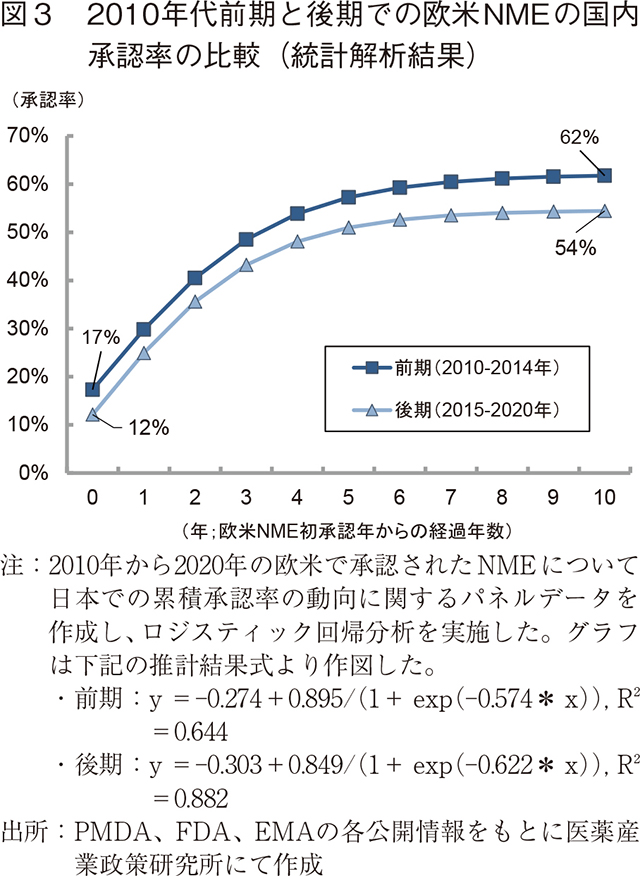
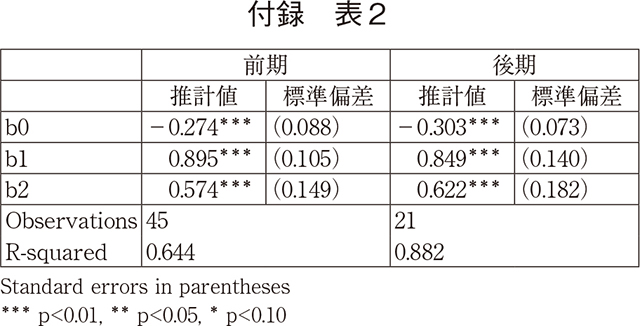
ここで、2010年代後期において国内未承認薬数の増加傾向があるという上記結果を検証するために統計解析を試みた。図2作成時のデータセット(補足1)を用い、2010年から2020年の欧米で承認されたNMEについて日本国内での累積承認率の動向に関するパネルデータを作成。2010年代前期(2010~2014年)と後期(2015~2020年)に分けて、欧米NMEの初承認年からの経過年数と承認率との関係を調べるため、ロジスティック回帰分析をおこなった(図3、補足2)。
解析の結果、2010年代前期では欧米と国内とで同年に承認された品目の割合(x=0)が17%であったのに対し、2010年代後期では12%であった。欧米承認後10年(x=10)の水準を比較すると、2010年代前期では欧米で承認された品目の62%が国内で承認されるが、2010年代後期では54%まで水準が低下した。つまり、前期の方が曲線の高さが初期にも最終的にも高いことを示唆している。この2010年代前期と比較して2010年代後期に日本国内での承認率が低下したことは、統計学的に有意であった(補足2)。
4-1. 国内未承認薬の欧米での承認状況
ここからは、2010年から2020年の間に日米欧で初めて承認されたNMEのうち、2020年12月末時点で国内未承認であった265品目について詳細に調査していく。
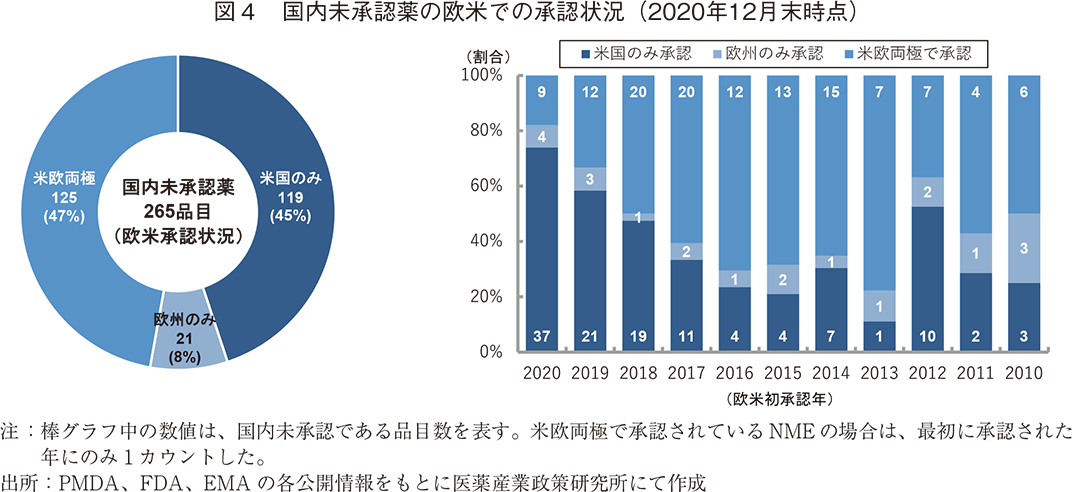
最初に、2020年12月末時点での国内未承認薬数と欧米での承認状況の内訳を図4に示した。2020年12月末時点での国内未承認薬である265品目のうち、米国、欧州の両地域で承認されているグローバル承認品目は125品目と全体の47%を占めた。また、米国のみで承認されている品目については119品目(45%)とグローバル承認品目とほぼ同数を占め、他方、欧州のみで承認されている品目は21品目(8%)と少数であった。
次に、欧米初承認年ごとに見ると、直近の2020年、2019年、そして2012年を除いて、米欧両極で承認されている国内未承認薬の割合が各年で5割を超えていた。また、2020年に近づくにつれて米国のみで承認された国内未承認薬の割合が多く、欧州のみで承認されている品目は各年に数個ある程度であった。ただし、近年の調査の結果から、NMEの日米欧の上市順位は米国、欧州、日本の順となるのが最も一般的なパターンであるとされており6)、7、本調査時点で米国のみで承認されている国内未承認薬についても、2021年以降に欧州や日本において承認されていく品目が複数あると想定できる。
4-2. 国内未承認薬の国内開発状況
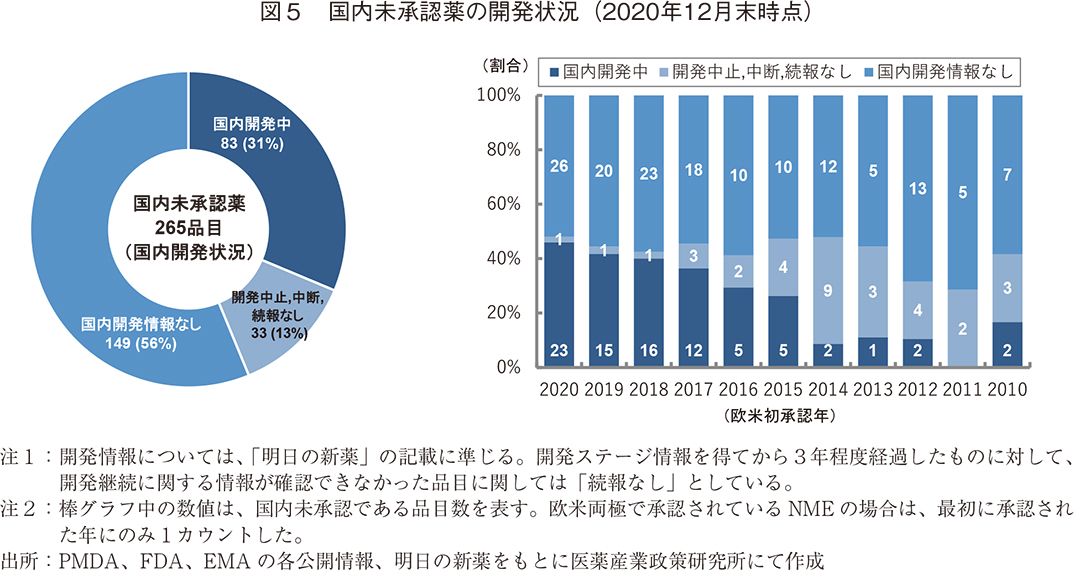
2020年12月末時点での国内未承認薬の国内開発状況の内訳を図5に示した。国内未承認薬265品目のうち国内開発中の品目は83品目(31%)あり、これらの品目については欧米との承認時期の「ラグ(遅延)」はあるものの国内での臨床開発試験は進行中であるため、近い将来、国内で薬事承認される可能性がある。
他方、国内開発中止・中断の判断をされた品目(3年間開発情報の続報がない品目含む。)については33品目(13%)あった。「中止・中断」の理由を特定するのは難しいが、戦略上の理由、事業環境の変化、国内臨床試験失敗、欧米にて重篤な副作用が報告された等、多岐にわたっていた。また、国内開発情報のない品目は149品目(56%)であった。これらの現在開発が動いていない国内未承認薬182品目(69%)については、2021年以降に新たに国内開発が開始されない限り、今後も「国内未承認薬」として残っていく。
次に、欧米での初承認年毎に、国内未承認薬として残っている品目の開発情報を確認した。開発中の83品目のうち8割を占める66品目が2017年から2020年に、9割以上を占める76品目が2015年から2020年に欧米で承認された品目であり、それ以上前の2014年以前の品目で開発情報があるものは開発中の品目全体の1割以下(7品目)であった。ただし、2014年以前の国内未承認薬に関しても、現在開発中の品目(7品目)と開発中止・中断となっている品目(21品目)を合計した28品目については、国内で開発されていた形跡があった。この視点で国内未承認薬全体を見ると、製薬企業により国内での薬事承認を得るための努力が行われていた品目は116品目あり、国内未承認薬全体の44%であった。
4-3. 国内開発情報のない未承認薬の特徴
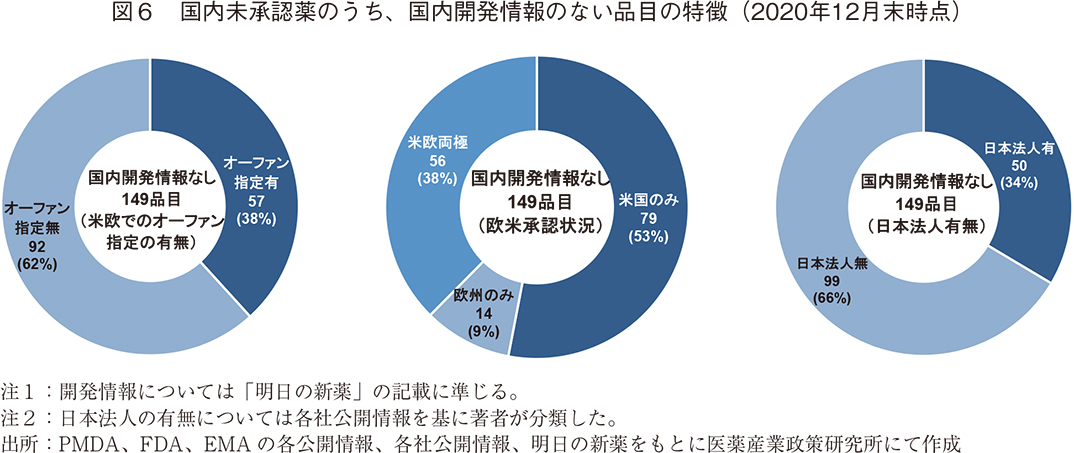
ここで、国内未承認薬のうち2020年12月末調査時点までに国内での開発が行われた形跡の無い「国内開発情報なし」となった149品目についての特徴を調査した(図6)。
最初に、米欧でのオーファン指定の有無を確認した。対象の149品目についてオーファン指定での区分けを行ったところ、オーファン指定有の品目が57品目(38%)を占めた。政策研ニュースNo.61によると、米国および欧州にて承認されたNMEの過去5年間(2015-2019年)のオーファン指定品目割合は40%前後で推移していた2)。つまり、国内未承認薬のうち国内開発情報なしの品目の米欧でのオーファン指定の割合は、米国および欧州にて承認されたNMEのオーファン指定の割合と大差がなかった。
次に、欧米での承認状況を確認した。国内開発情報のない国内未承認薬149品目のうち56品目(38%)は米国と欧州の両極で承認されているグローバル承認品目であった。図4の国内未承認薬全体の場合と比較すると、国内開発情報なしの品目については米欧両極で承認されている割合が9%少なく、米国のみで承認されている割合は8%多くなっていた。
最後に、国内開発情報なしの品目について欧米での開発企業を調査したところ、149品目のうち147品目が海外企業による開発品であった14)。さらに開発企業について詳細を見るために、対象となる海外企業の日本法人の有無について確認した。結果、99品目(66%)が日本法人を持たない海外企業により開発された品目であることがわかった。
4-4. 国内未承認薬の薬効分類と開発状況
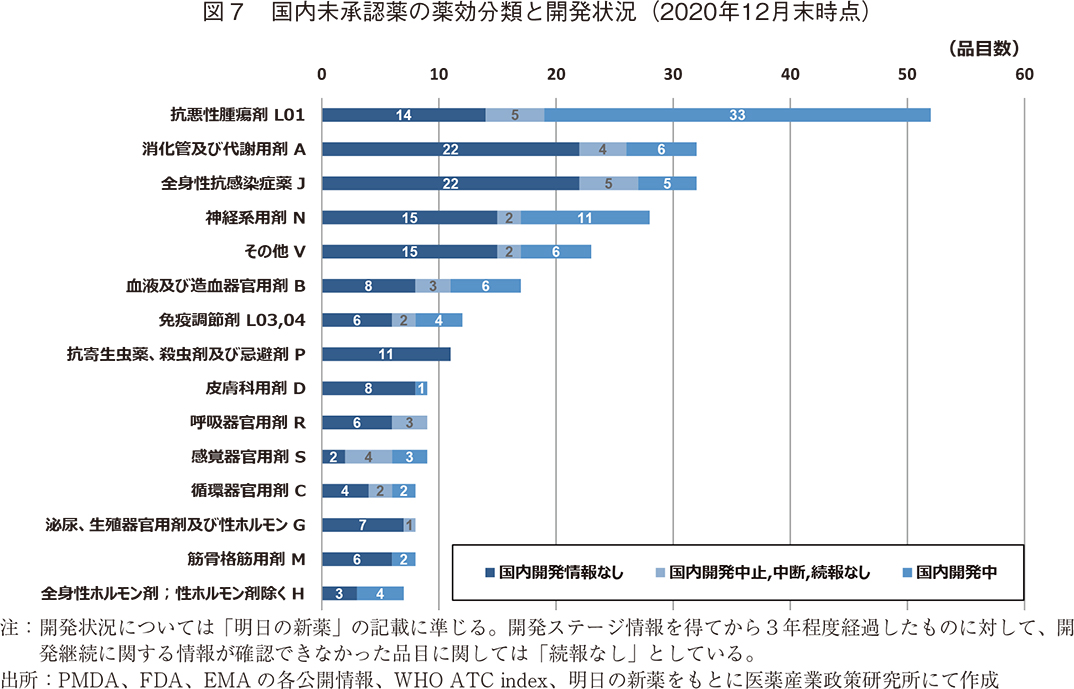
調査の最後として、2020年12月末時点での国内未承認薬265品目についての薬効分類15)と国内開発状況を図7に示した。
国内未承認薬を薬効分類別に見ると、抗悪性腫瘍剤(L01)が52品目(20%)と最も多かった。国内未承認薬が10品目以上ある薬効分類を並べると、消化管及び代謝用剤(A)32品目(12%)、全身性抗感染症薬(J)32品目(12%)、神経系用剤(N)28品目(11%)、その他(V、診断薬等)23品目(9%)、血液及び造血器官用剤(B)17品目(6%)、免疫調節剤(L03,04)12品目(5%)、抗寄生虫薬、殺虫剤及び忌避剤(P)11品目(4%)と続いた。
図5において示した国内開発中の83品目について薬効領域別に見ると、抗悪性腫瘍剤(L01)が33品目と国内開発中の品目全体の40%を占めていた。この数は、抗悪性腫瘍剤の国内未承認薬52品目のうちの63%を占める品目数であった。このように、抗悪性腫瘍剤の未承認薬については、他の薬効分類と比較して国内開発中の品目数が多いだけでなく割合も大きく、多くの品目が国内開発に着手されていたことがわかった。続いて国内開発中の品目が多いのは、神経系用剤(N)の11品目であり、国内開発中の品目全体(83品目)の13%を占めていた。この数は、神経系用剤の国内未承認薬28品目のうちの39%を占め、抗悪性腫瘍剤の次に国内開発割合も大きかった。また、これら2つの薬効分類だけで開発中の未承認薬全体の半数以上(53%)を占めていた。
一方、国内開発情報のない149品目について薬効領域別に見ると、全身性抗感染症薬(J)が22品目、消化管及び代謝用剤(A)22品目、神経系用剤(N)が15品目、その他(V, 診断薬等)が15品目、抗悪性腫瘍剤(J01)が14品目と続いており、抗悪性腫瘍剤よりも多い薬効分類を4分類確認した。このうち、国内未承認薬数の多かった全身性抗感染症薬(J)や消化管及び代謝用剤(A)については、国内開発中の品目がそれぞれ6品目、5品目と国内開発中の品目全体(83品目)の5~6%を占める程度であり、多くの未承認薬は開発されないまま残っていることがわかった。また、抗寄生虫薬・殺虫剤及び忌避剤(P)、呼吸器官用剤(R)、泌尿・生殖器官用剤及び性ホルモン(G)に分類された国内未承認薬については、調査時点で国内開発が行われている品目はなかった。
5. 本調査結果の要点
本稿では、2010年から2020年に日米欧各極で新有効成分含有医薬品(NME:New Molecular Entity)として承認された品目を対象とし、国内未承認薬の状況とその特徴について調査した。今回の調査から明らかになった主な内容を以下に示す。
- ①国内未承認薬数とその割合の経年分析から、近年、国内未承認薬の増加傾向が見られた(図2)。2010年代前期と比較して2010年代後期に国内での承認率が低下したことは、統計学的に有意であった(図3、補足2)。
- ②国内未承認薬には、米国、欧州の両地域で承認されているグローバル承認品目が約半数(47%)含まれていた(図4)。
- ③国内未承認薬のうち、製薬企業により国内で臨床開発が行われていた品目数は、国内未承認薬全体の44%であった(図5)。
- ④国内開発情報のない品目の38%は、欧米でのオーファン指定品目であった。また、国内開発情報のない品目の66%が、日本法人を持たない海外企業により欧米で開発されたNMEであった(図6)
- ⑤抗悪性腫瘍剤の国内未承認薬については、他の薬効分類と比較して国内開発中の品目数が多いだけでなく割合も大きく、多くの品目が国内開発に着手されていた(図7)。
- ⑥国内開発情報のない品目に限ると、抗悪性腫瘍剤に分類された国内未承認薬の数よりも、全身性抗感染症薬、消化管及び代謝用剤、神経系用剤、その他(診断薬等)の4領域各々に分類される国内未承認薬数のほうが多かった(図7)
6. 考察
ここからは、国内未承認薬の状況とその特徴の調査から得られた結果について、考察を加えていきたい。
まず、国内未承認薬数とその割合の経時変化からは、2010年代後期に国内未承認薬数の増加傾向が見られた。国内未承認薬は「ドラッグ・ラグ」の1つの側面であることを述べたが、承認品目数や承認割合の観点から調査した結果、本側面については拡大の兆候が見られると言える。この理由を探るため、2020年12月末時点での国内未承認薬について詳細に調査をおこなった。
欧米での承認状況の調査からは、米国、欧州の両地域で承認されているグローバル承認品目である国内未承認薬が約半数(47%)含まれていることがわかった。国内で未承認薬となっている品目にはグローバルで展開されない其々の地域のローカルドラッグが大部分含まれるのではないかと考えていたが、その考えは否定された。
国内開発状況の調査からは、国内未承認薬全体の44%は各製薬企業により国内開発されていたが、残りの56%は開発情報のない品目であった。「国内開発中の品目」については、「ラグ(遅延)」ができるだけ短くなることが望ましいものの、将来的には国内において患者さんがその薬剤にアクセスできる可能性がある。しかし、「開発情報のない品目」については調査時点以降に国内開発が開始されない限り、このまま未承認薬として残っていく。
開発情報のない品目をさらに分析調査したところ、38%は欧米でのオーファン指定品目であったが、その割合と欧米NME全体でのオーファン指定品目割合とを比較することで、2つの間に大きな差はないことを示した。ただし、オーファン指定品目については、希少であるが故に市場規模や臨床試験の実施可能性の問題が生じうるため、今後国内単独で臨床開発を開始する割合は低いと考えられ、多くが国内未認薬として残っていく可能性がある。国内未承認薬となっているオーファン指定品目には国内の患者数が著しく少なく治験が実施できない遺伝性疾患や希少がんの薬剤等が含まれる16)。海外開発・承認が先行してしまうと、日本で検証試験は困難となり、日本人での科学的根拠が希薄となり、結果としてドラッグ・ラグを引き起こしてしまう。製薬企業は、日本国民に最先端医療を提供するために、日本人も含めた有効性と安全性を検討できる規模の国際共同試験に参加し、結果として国内と海外との同時承認もあり得る状況に最初から持っていくことが重要であろう。
国内開発情報のない品目では、国内未承認薬全体での結果と比較して、米国のみで承認されている品目の割合が大きかった。加えて、国内未承認薬のうち国内開発情報のない品目の66%は、日本法人を持たない海外企業により欧米で開発されたNMEであった。最近のIQVIAの調査レポート"Global Trends in R&D:Overview through 2020"によると、過去3年間で承認されたNMEの40%以上が新興バイオ医薬品企業(Emerging Biopharma)により開発・発売されているとあるが17)、これら新興バイオ医薬品企業の多くは日本法人を持たない。また、新興バイオ医薬品企業の多くは米国発祥であり米国でのみ開発・販売する割合が高いと考えられ、そのため、国内未承認薬のうち国内開発情報のない品目については米国のみで承認されている割合が高くなっていると思われた。このことから、新興バイオ医薬品企業をどのように国内開発に呼び込むかが、国内未承認薬の問題を解決するための1つの課題として浮かび上がった。国際共同治験のし易い環境を構築することや、国内で臨床開発をやりたくなるような環境と企業へのインセンティブを整備すること、魅力ある国内市場を作ること等で新興バイオ医薬品企業自体を国内に呼び込むことも重要であるし、新興バイオ医薬品企業の品目に特化して国内導入することで国民の新薬へのアクセスを確保するという戦略を持つ国内製薬企業が出てきても良いのかもしれない。
国内未承認薬の薬効分類別調査からは、抗悪性腫瘍剤の国内未承認薬の数は他の薬効分類と比較して最も多いが、国内臨床開発中の割合も最大であり、多くの未承認薬について製薬企業による開発努力が続けられていることがわかった。今後は、より承認時期のラグ(遅延)が短くなること、及び、希少がんの薬剤等の開発されていない国内未承認薬の割合がさらに減っていくことを期待したい。
開発情報のない品目の薬効分類別調査では、抗感染症薬に分類された未承認薬の割合が高く、さらに、抗寄生虫薬に分類された未承認薬については国内開発が1品目もされていなかったが、これまで国内に薬剤耐性菌(AMR)治療用等の感染症を対象とした医薬品の研究開発の促進に寄与するような企業へのインセンティブが少なかったこと等も原因であろうと推察された。2020年秋に厚生労働省により「特定用途医薬品」の指定制度が創立されたことで一定の対策は打たれたと認識しているが、昨今のCOVID-19パンデミックに対する国内の研究開発状況を見ると、より効果の高い抗感染症に対する打ち手が必要であるとも感じている。例えば、2020年に英国で実装されたサブスクリプション(定額課金)型償還モデルのようなPull型のインセンティブを本格的に議論する時期にきているのかもしれない18)。
7. まとめ
今回、国内未承認薬の状況とその特徴について取り上げてきた。「ドラッグ・ラグ」の1つの側面である「国内未承認薬」については、2010年代後期に拡大の兆候が見られており、特に、新興バイオ医薬品企業をどのように国内開発に呼び込むかが、国内未承認薬の問題を解決するための1つの課題として浮かび上がった。また、国内未承認薬数の多い抗悪性腫瘍剤だけでなく、国内開発情報のない品目の多い抗感染症薬等の領域への対策が必要であることもわかった。これら課題の解決に向けて重要な点として、①国際共同治験のし易い環境の構築、②日本国内で臨床開発をやりたくなるような環境の整備、③感染症等における企業への新型インセンティブの付与、④魅力ある国内市場を作ること、の4点を挙げた。
冒頭でも述べたが、日本の医薬品市場への上市インセンティブ低下に伴う「ドラッグ・ラグ」の再燃を危惧する声が多くなっている。このまま欧米 NMEの国内での承認率が減少し国内未承認薬が増加していくことになると、将来的に国民は革新的な新薬への迅速なアクセスができなくなる可能性がある。イノベーションと医薬品の価値を理解した適正な制度が運用されるように国民的な議論が進むことを期待したい。
8. 謝辞
本調査で用いた統計解析について、医薬産業政策研究所 長岡貞男所長(東京経済大学教授)の協力を得た。ご協力に対して深謝いたします。
補足1 国内未承認薬数と欧米NMEの国内承認率の集計
分析に用いたデータセットは、以下の通りである。2010年から2020年の日米欧各極のNME承認情報を用い、調査時点毎(各年12月末日)に欧米初承認年ごとの国内未承認薬数、及び、欧米で承認されたNMEについての日本国内での承認率を集計した。(付録 表1)
補足2 統計解析の詳細
分析に用いたロジスティック曲線は、以下の通りである。被説明変数(Lcy, lag)は、欧米でNMEが承認された各年cy(コホート年)について、経過年(lag)毎の日本での承認率であり、以下の推計モデルを用いる。最初の推計モデルは
Lcy, lag=b0+b1/(1+exp(-b2lag)) (1)
であり、これを前期(t=2010-2014, period=0)と後期(t=2015-2020、period=1)それぞれについて推計を行う。モデル⑴では、曲線の初期値の高さ(lag=0)がb0+(b1)/2であり、曲線が漸近する高さがb0+b1となる。値が各コホート年毎に承認率のベースとなる医薬品の数(cohort_n)は異なるので、これを反映した加重回帰分析を行う。前期ではcohort_nの平均36、後期では44である。経過年は前期、後期全ての年を利用しているが、5年に標準化しても大きく異ならない。
推計結果は以下の通りである。推計した全ての係数は1%で有意であり、推計されたロジスティック曲線によって図3を描いている。前期の方が曲線の高さが初期にも最終的にも高いことを示唆している。
データ数の制約から、上のそれぞれ3つのパラメーターを持つロジスティック曲線の前期と後期の差の有意性を検定することは困難である。以下では、前期と後期で、b0が等しいという仮説及びb1が等しいという仮説を検定する。b0の差は承認率に平均的な水準の差があるかどうかを示しており、b1の差は平均の差と同時に傾きの差があるかどうかを示している。推計は前期と後期のデータを統合して利用して、推計式⑴に、b0あるいはb1と後期ダミーとの交差項を導入している(その係数がそれぞれ、b0Aあるいはb1Aであり、これは後期での係数の変化量を示す)。欧米上市からの経過期間は後期に合わせて5年までとしている。
推計結果は以下の通りである。
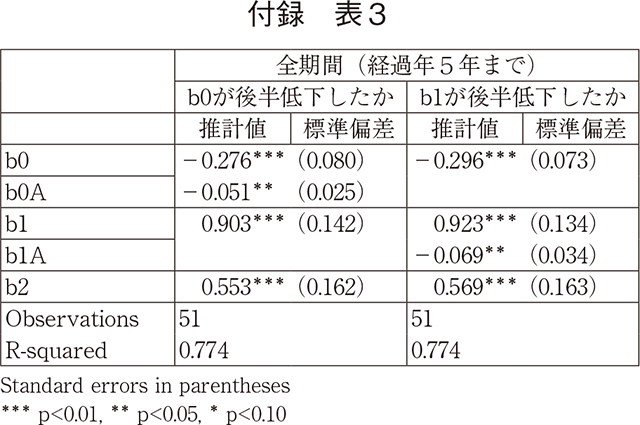
この結果が示すように、いずれのモデルでも後期に承認率は有意に低下している。最初の推計結果では、全期間平均として5%承認率が後期に有意に低下したことを示している。また第二のモデルでは、後期では最終的な承認率で6.9%低下し、初期に3.5%低下したことを示している。前期と後期の経過年を合わせる制約をとっても、有意性は弱まるが、ほぼ同じ結果を得る。
最後に、結果の頑健性を確認するために、以下では単純に、前期、後期共通するしかし承認の拡大曲線に一般的形状を仮定し、水準のみが前期と後期で異なり得るとして、その差の有意性を検定する。経過年は5年までに限定して推計している。
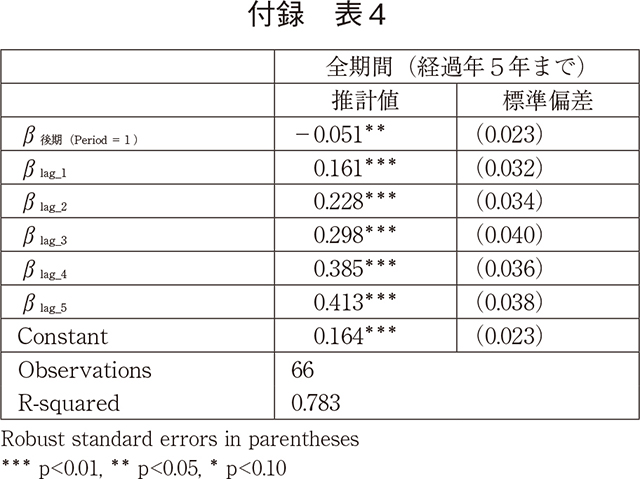
Lcy, lag=(β後期*period)+∑lagβlag*lag+constant (2)
このモデルでは前期と後期では、β後期だけ、曲線の高さが異なるとしている。
モデル(2)の各係数の推計結果は以下の通りである。推計結果によれば、後期には有意に5%だけ承認率が低く、付録の表3の最初の推計結果とほぼ同じ結果である。
-
1)医薬産業政策研究所.「日本における新薬の臨床開発と承認審査の実績」リサーチペーパー・シリーズ No.69(2016年11月)
-
2)医薬産業政策研究所.「日米欧の新薬承認状況と審査期間の比較 2019年承認実績を中心に」政策研ニュース No.61(2020年11月)
-
3)医薬産業政策研究所.「日本で承認された新医薬品とその審査期間 2020年承認実績と過去10年の動向調査」政策研ニュース No.62(2021年3月)
-
4)
-
5)
-
6)医薬産業政策研究所.「世界の売上高上位300製品の上市状況の日米欧比較 ドラッグ・ラグの解消は進んでいるのか」政策研ニュース No.57(2019年7月)
-
7)医薬産業政策研究所.「ドラッグ・ラグ:国内 NME 承認品目の上市状況 米国・欧州との上市時期比較」政策研ニュース No.63(2021年7月)
-
8)
-
9)
-
10)
-
11)医薬産業政策研究所.「製薬企業に開発要望された未承認薬・適用外薬 薬事承認に見る実用化促進に向けた措置の現況」政策研ニュース No.45(2015年7月)
-
12)第Ⅲ回および第Ⅳ回開発要望品については、要望時期が比較的最近であるため現状では未承認の件数が多い。しかし、現在進行中で開発および検討が行われており、近い将来、対象となる未承認薬・適応外薬の多くが承認されると考えられる。
-
13)
-
14)国内開発情報のない国内未承認薬149品目のうち、Bempedoic acid/Ezetimibe(米国:Esperion、欧州:第一三共)、Ospemifene(米国:Duchesnay、欧州:塩野義)以外の147品目は、米欧にて海外企業により開発品された品目であった。
-
15)薬効分類はWHOの下記webサイトを参照し、各品目のThe Anatomical Therapeutic Chemical code(ATC cod)をもとに行った。また、ATC code が付与されていない品目については類縁医薬品から予想されるものを採用した。
ATC/DDD Index 2021 -
16)医薬産業政策研究所.「希少疾病医薬品(Orphan drug)の開発動向 FDAで承認された Orphan drug の日本での開発状況の分析」政策研ニュース No.59(2020年3月)
-
17)
-
18)

