目で見る製薬産業 日本で承認された新医薬品とその審査期間 2020年承認実績と過去10年の動向調査
医薬産業政策研究所 主任研究員 吉田昌生
医薬産業政策研究所では、規制当局の公表情報をもとに、医薬品の承認情報および審査期間に関して継続的に収集、分析している1、2、3)。今回のニュースでは、2020年1~12月に日本で承認された新医薬品と新再生医療等製品の承認状況およびその審査期間について調査した。加えて、2010~2020年の継続的な調査から見えてくる現況を、新有効成分含有医薬品、モダリティ区分、疾患区分、先駆的医薬品指定制度、特例承認に係る品目、それぞれの分析を切り口に考察した。
調査方法
調査の対象は、独立行政法人医薬品医療機器総合機構(PMDA)のホームページの「新医薬品の承認品目一覧」4)に掲載されている医薬品とした。品目は審査報告書毎にカウントすることを基本とし、学会等からの要望により同一成分の品目を複数の企業が同時に公知申請したような場合や併用薬物療法等にて複数成分が承認されたものは1つの品目として集計した。各品目の承認情報は、審査報告書、新医薬品の承認品目一覧、添付文書および薬務公報から抽出した。解析には、標準的な統計解析ソフトStata/IC 14.0 for Windows(Stata Corp LP, College Station, TX, USA)を使用し、審査期間は承認申請日から承認日までの期間として算出した。
新医薬品の承認品目数とその内訳
2010~2020年の間に日本で承認された新医薬品の承認品目数の年次推移を図1に示した。日本で2020年に承認された新医薬品の品目数は125品目で、2019年より5品目減少したものの、2010~2019年の平均承認品目数(117品目)より多い結果であった。そのうち、新有効成分含有医薬品(NME:New Molecular Entity)は38品目が承認され、2019年と比較して1品目減少、2010~2019年の平均承認NME品目数(40品目)と同程度であった。
続いて、承認品目の内訳を表1に示した。申請区分別の内訳では、2020年は前述のNMEの他、新剤型医薬品は2品目、新用量医薬品は12品目であり、これらの数値は2019年より減少した。一方、新効能医薬品は58品目であり、2019年と比較して13品目増加し、これは弊所が記録している2000年以降で2011年の59品目に次ぐ多さであった。また、バイオ後続品(バイオシミラー)は2品目5)と、2019年と比較して6品目減少し、2017年以来の少なさであった。
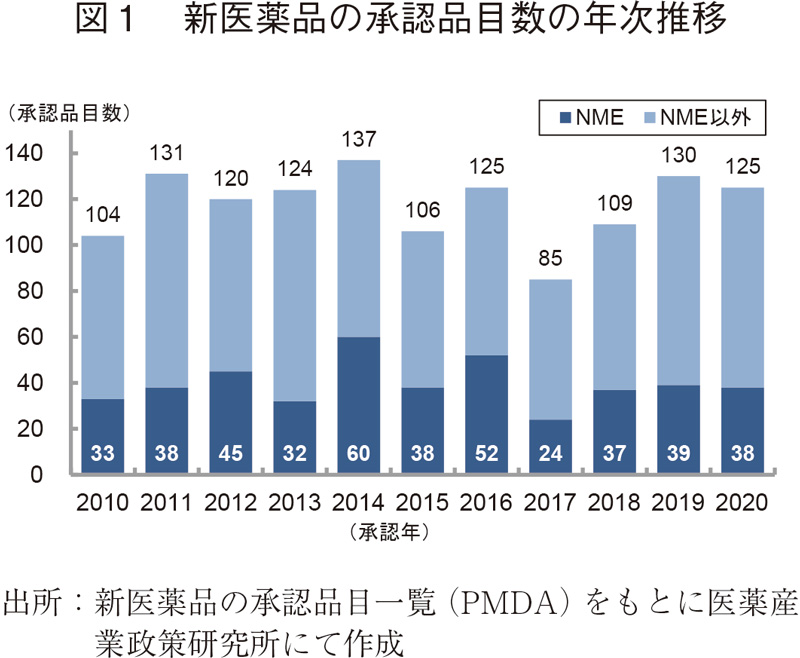
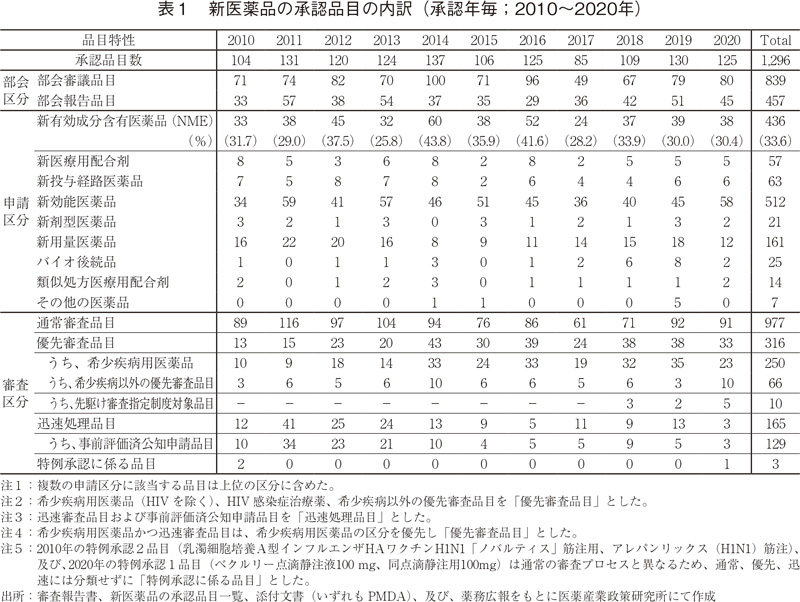
審査区分別の内訳では、通常審査品目が91品目、優先審査品目は33品目であった。優先審査品目が全承認品目に占める割合は26%であり、2014年以降の水準(30%前後)と同程度であった。ただし、優先審査品目のうち、希少疾病用医薬品は23品目と、2019年と比較して12品目減少した。先駆け審査指定制度対象品目については、2018年に最初の対象品目が承認されて以来、過去最多の承認数となる5品目が承認された。加えて、現在も世界中で感染拡大が続く「新型コロナウイルス(SARS-CoV-2)による感染症」を効能・効果として、「ベクルリー点滴静注液100 mg、同点滴静注用100 mg」が特例承認された。特例承認に係る品目が承認されたのは、2010年に「新型インフルエンザ(H1N1)の予防」を効能・効果として承認された2つの輸入ワクチン以来のことであった。
新医薬品の審査期間
2010~2020年に承認された新医薬品の審査期間の推移を表2および図2に示した。2020年に承認された全125品目の審査期間の中央値は10.6ヶ月と、2019年より0.7ヶ月長く、これは審査期間が大幅に短縮した2011年以降では僅差ながらも最も長いものであった。
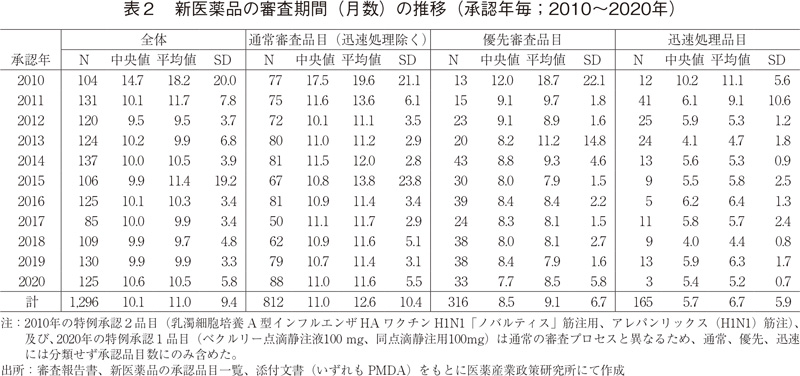
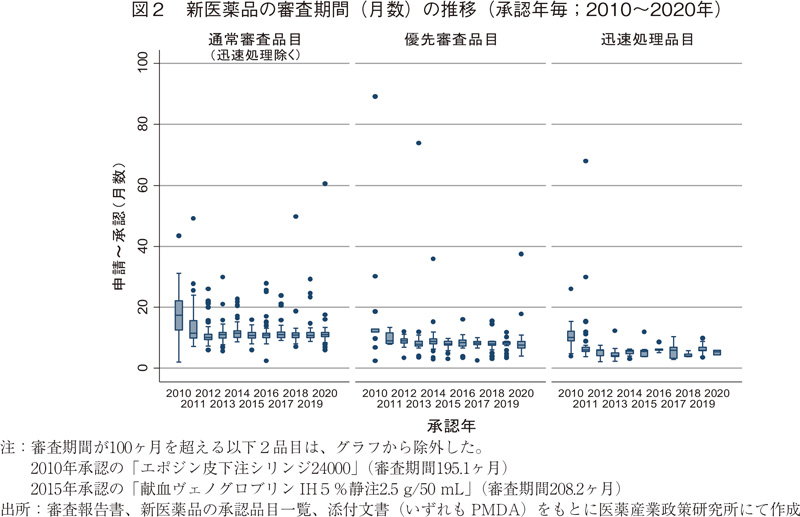
次に審査区分別で見てみると、審査期間の中央値は迅速処理品目を除いた通常審査品目では11.0ヶ月であり、こちらは2011年以降の審査期間と同様であった。一方、優先審査品目の審査期間中央値については7.7ヶ月と、2019年より0.7ヶ月短く、2010年以降の最短で審査処理されていた。なお、通常審査品目(迅速処理除く)と優先審査品目其々の審査期間の80パーセンタイルは、11.9ヶ月、8.9ヶ月であり、目標値とされる12ヶ月以内、9ヶ月以内に承認されていることが確認できた6)。
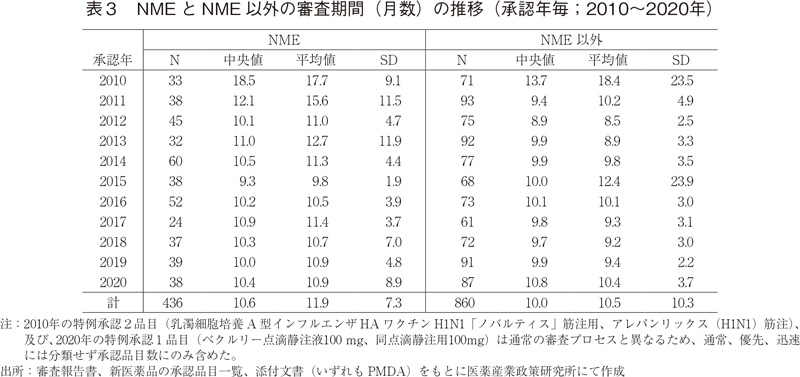
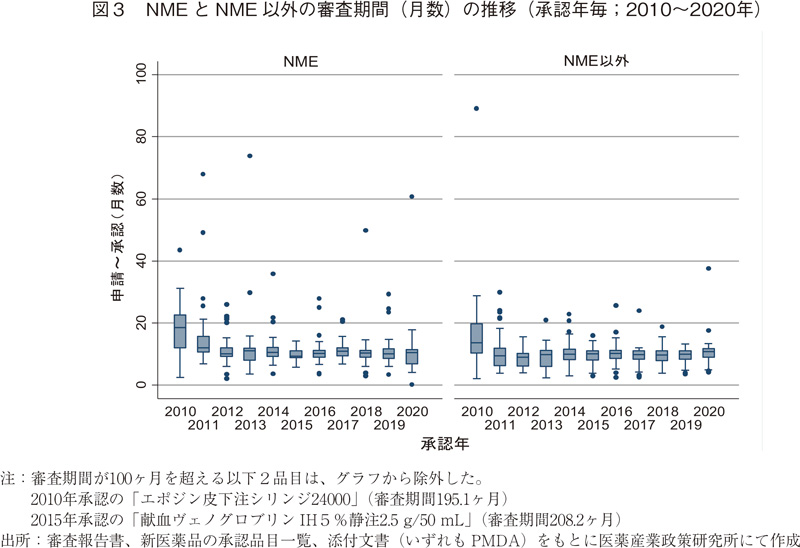
続いて、NMEとNME以外に区分した場合の審査期間の推移について表3および図3に示した。2020年に承認されたNME 38品目の審査期間の中央値は10.4ヶ月であり、2019年より0.4ヶ月長かった。NME以外の品目については審査期間の中央値が10.8ヶ月となっており、2019年より0.9ヶ月長く、これは2011年以降で最も長い審査期間を要したことになる。また、2020年はNMEの審査期間のばらつき(標準偏差:SD)が例年に比べて大きかったが、こちらについては審査に60ヶ月以上要した品目があり、その影響であろうと見てとれた。(図3)
新医薬品の承認品目に関する分析
2010~2020年に承認された新医薬品に関して、各区分別での経年分析をおこなった。NME承認品目に関しては審査区分別および内外資企業別7)の2つの調査を、新医薬品全体の承認品目についてはモダリティ区分としてバイオ医薬品8)と低分子等医薬品9)、疾患区分として希少疾病用医薬品と抗悪性腫瘍薬に関して調査をおこなった。
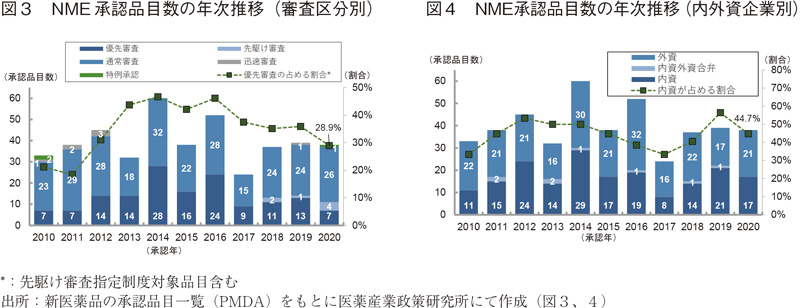
最初に、NME承認品目数に関する審査区分別の年次推移を図3に示した。2020年に承認されたNME 38品目の審査区分別内訳は、通常審査品目が26品目(68%)、優先審査品目数が7品目(18%)、先駆け審査対象品目が4品目(11%)、特例承認に係る品目が1品目(3%)であった。先駆け審査指定品目のNME承認品目数は2018年に初めて承認されて以来、最多の品目数であった。優先審査品目(先駆け審査指定対象品目含む)のNME承認品目数に占める割合は、2010年、2011年の20%前後から2014年に向けて増加したが2014年の47%をピークに減少に転じ、2020年には29%と2012年の水準まで下がった。
次に、NME承認品目数に関する内外資企業別の年次推移を図4に示した7)。NMEの申請企業を内外資企業別に見ると、2020年の内資企業のNMEは17品目(45%)、外資企業のNMEは21品目(55%)であった。2010~2020年の期間において、内資企業NME承認品目数の占める割合が半数を超えた年は2012年、2019年の2回のみであり、2012年から2017年にかけてその割合は減少していたものの2017年からは反転し、2019年には2010年以降で最も高い割合(56%)を示していた。
続いて、NMEに限定せず新医薬品の全承認品目を対象に、バイオ医薬品8)とそれ以外の低分子等医薬品9)の承認品目数の年次推移を図5、6に示した。
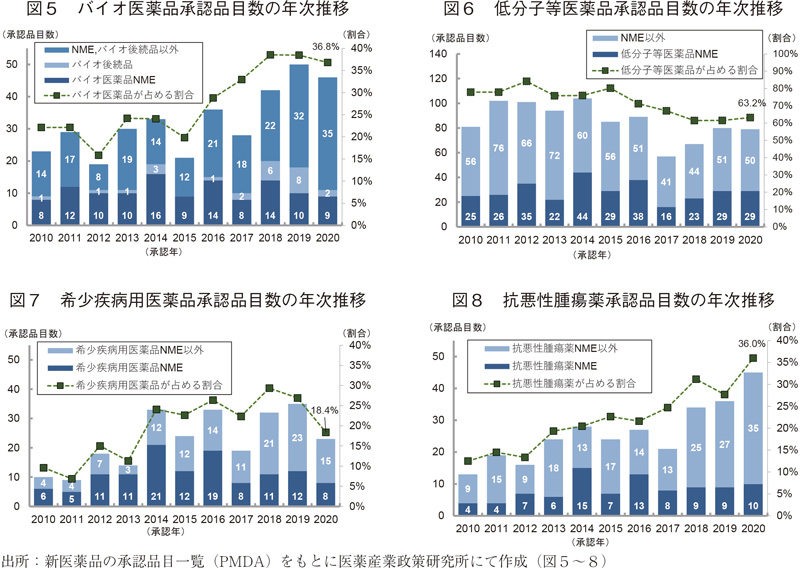
2020年に承認された全125品目のうち、バイオ医薬品の承認品目数は46品目であった。その内訳は、NMEが9品目、バイオ後続品が2品目、それら以外(新効能医薬品等)が35品目であった。2020年のバイオ医薬品NME数(9品目)は、全NME 38品目の24%を占めたことになる。2010~2020年の期間において、バイオ医薬品承認品目数が全承認品目数に占める割合は、2010年は22%、2012年には16%と落ち込んだが、2020年には37%を占めるまでに至った。ただし、バイオ医薬品NMEについてはコンスタントに承認されてはいるものの、その数が大幅に伸びている傾向はない。直近3年のバイオ医薬品承認品目数については、バイオ後続品や新効能医薬品等の品目が多くの割合を占めていることがわかる。
対して、低分子等医薬品の承認品目数については、2012年には全承認品目数の84%を占めていたが2018年には62%まで割合は下がった。ただし、直近3年はその割合に大きな変化はなく、2020年は63%(79品目)となっている。また、低分子等医薬品のNMEについても2017年に16品目と落ち込んだものの直近3年は安定して承認されており、2020年は全NME(38品目)の76%(29品目)を占め、2019年に引き続いてバイオ医薬品NMEの約3倍もの承認を得ていた。
次に、新医薬品の全承認品目を対象に、希少疾病用医薬品(審査区分)の承認品目数の年次推移を図7に示した。2020年の希少疾病用医薬品の承認品目数は23品目(18%)であり、2019年より12品目減少したものの、2010~2019年の平均承認品目数(23品目)と同様であった。その内訳は、NMEが8品目、NME以外が15品目であった。2010~2020年の期間において、希少疾病用医薬品の承認品目数が全承認品目数に占める割合は、2010年は10%程度であったが、2018年には29%を占めるに至り、2019年は品目数として過去最多の35品目が承認されていた。NMEに限ると2016年以降はその承認数は伸びておらず、直近4年は10品目前後に留まっており、2020年の希少疾病用医薬品NME数(8品目)は全NME 38品目の21%であった。
本項の最後に、新医薬品の全承認品目を対象とした抗悪性腫瘍薬の承認品目数の年次推移を図8に示した10)。2020年の抗悪性腫瘍薬の承認品目数は45品目であり、2019年と比較して9品目増加し、これは弊所が記録している2000年以降で最多の承認数であった。2010~2020年の期間において、抗悪性腫瘍薬の承認品目数が全承認品目数に占める割合は、2010年では全体の13%(13品目)を占めるのみであったが、以降右肩上がりに増加し、2020年には全125品目の36%を占めるに至った。この期間の抗悪性腫瘍薬承認品目の変化として、NME以外の新効能医薬品等の品目数が大幅に増加していることが特徴であった。NMEに関しては大幅に承認数が伸びているわけではないが毎年着実に承認を得ており、2020年の抗悪性腫瘍薬NMEは10品目と、全NME 38品目の26%を占めた。
先駆け審査指定制度の対象品目の承認と審査期間
2020年までに承認された先駆け審査指定制度の対象品目を表4に示した。2020年、本制度の対象品目として過去最多の5品目が承認された。
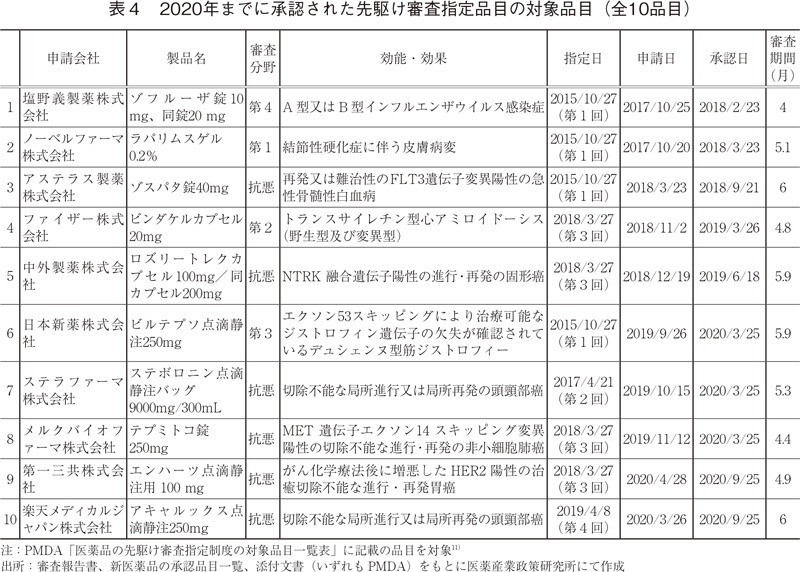
先駆け審査指定制度は、世界に先駆けて、革新的医薬品・医療機器・再生医療等製品を日本で早期に実用化すべく、その開発を促進するため、2015年より試行的に実施されており、2020年までに全10品目が本制度により承認された。申請会社の内訳を見ると、それらの品目全てが異なる会社によるものであった。また、審査分野別の内訳は、第1-4分野に其々1品目ずつ、抗悪分野が6品目と、抗悪分野が多いものの幅広い分野の品目が承認されていた。
対象品目全体の審査期間中央値は5.2ヶ月(平均値5.2ヶ月、標準偏差0.73)と、2020年の新医薬品の優先審査品目の審査期間中央値7.7ヶ月と比較して大幅に短い期間で審査処理されていた。品目別で見ても全品目が6ヶ月以内の審査期間を示しており、目標値とされる6ヶ月以内の承認が達成されていた6)。また、これら対象品目について世界での承認状況を確認したところ、NMEについては全品目が世界に先駆けて日本で承認を得ており、一部変更申請の品目についても先駆け審査指定制度対象の効能・効果において、世界初の承認を得ていた12)。
試行的運用がなされていた先駆け審査指定制度は、2019年11月に改正薬機法が成立、2020年9月に施行されたことで法制化され、新たに先駆的医薬品指定制度として創設された。本制度は、患者に世界で最先端の治療薬を最も早く提供することを目指し、一定の要件を満たす画期的な新薬等について、開発の比較的早期の段階から先駆的医薬品に指定し、薬事承認に係る相談・審査における優先的な取扱いの対象とするとともに、承認審査のスケジュールに沿って申請者における製造体制の整備や承認後円滑に医療現場に提供するための対応が十分になされることで、更なる迅速な実用化を図るものと明記されている13)。
特例承認に係る品目の承認とその審査期間
2020年までに承認された特例承認に係る品目を表5に示した。2020年、現在も世界中で感染拡大が続く「新型コロナウイルス(SARS-CoV-2)による感染症」を効能・効果として、「ベクルリー点滴静注液100 mg、同点滴静注用100 mg」が特例承認された14)。その審査期間は3日であった。
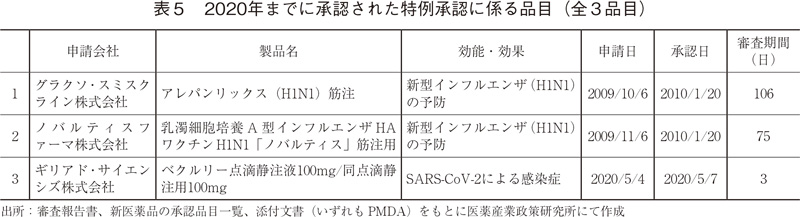
特例承認とは、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第14条の3第1項の規定に基づき、①疾病のまん延防止等のために緊急の使用が必要、②当該医薬品の使用以外に適切な方法がない、③海外で販売等が認められている、という要件を満たす医薬品について、承認申請資料のうち臨床試験以外のものを承認後の提出としても良い等として、特例的な承認をする制度である。ただし、上記条件のいずれかに該当しなくなったと認めるとき、又は保健衛生上の危害の発生若しくは拡大を防止するため必要があると認めるときは、これらの承認を取り消すことがあると明記されている14)。過去を遡ると、特例承認に係る品目が承認されたのは、2010年に「新型インフルエンザ(H1N1)の予防」を効能・効果として承認された2つの輸入ワクチン以来のことであった。それら2つのワクチンの審査期間は、それぞれ106日(3.5ヶ月)、75日(2.5ヶ月)であり、比較するとベクルリーの審査期間(3日)がいかに短期間であったかがわかる。
ここで、ベクルリー(一般名:レムデシビル)について日米欧の承認審査期間に関する情報を比較整理したい。日本では、米国においてCOVID-19に対するレムデシビルの緊急使用許可(EUA:Emergency Use Authorization)が得られたことを受けて、5月4日に申請、5月7日に特例承認を認めた。承認に当たり、「本剤の有効性及び安全性に関する情報は極めて限られていることから、現在進行中の治験又は臨床試験の成績が得られ次第、当該成績をとりまとめて速やかに報告すること。」等の義務を課されていた14)。米国のEUAは、薬剤の供給と緊急使用を許可する一時的な措置であり、正式な新薬承認申請の提出、審査と承認のプロセスに代わるものではなく、緊急事態の原因が終了、または薬剤が正式な新薬承認を受けた時点で終了するものであり15)、日本での特例承認がレムデシビルの世界で最初の法制上の承認となった。一方、米国においては、5月1日に上記EUAが認められた後、8月7日に新薬承認申請(New Drug Application)、10月22日に正式な承認を受けていた16)。また、欧州では、認可されていない薬の使用を認めるコンパッショネートユースの推奨(Compassionate use recommendation)が4月2日に出され17)、4月13日から各種データの審査が始まり、6月5日に販売承認申請(Marketing Authorization Application)、7月3日に条件付き承認(Conditional Approval)を得ていた18)。このように、日米欧各極それぞれの制度を活用しこの難局に対処していたことがわかる。
2021年1月末時点、厚生労働省により新型コロナ感染症に対する治療薬として使用が認められているものは、ベクルリー、ステロイド薬のデカドロン(デキサメタゾン)、血栓リスクに対応するためのヘパリンの3剤となっている19)。その他、治験や特定臨床研究実施中のものは複数あるが、それらについては厚生労働省資料を参照いただきたい20)。
新再生医療等製品の承認品目とその審査期間
ここからは新再生医療等製品の承認品目とその審査期間について紹介する(表6)。2020年、新再生医療等製品として新たに2品目が承認され、2020年までに承認された品目は全11品目(承認区分として一部変更を含む。)となった。そのうち、2020年の2品目を含む6品目が希少疾病用再生医療等製品として承認されていた。また、2020年は先駆け審査指定再生医療等製品として1品目が新たに承認された。
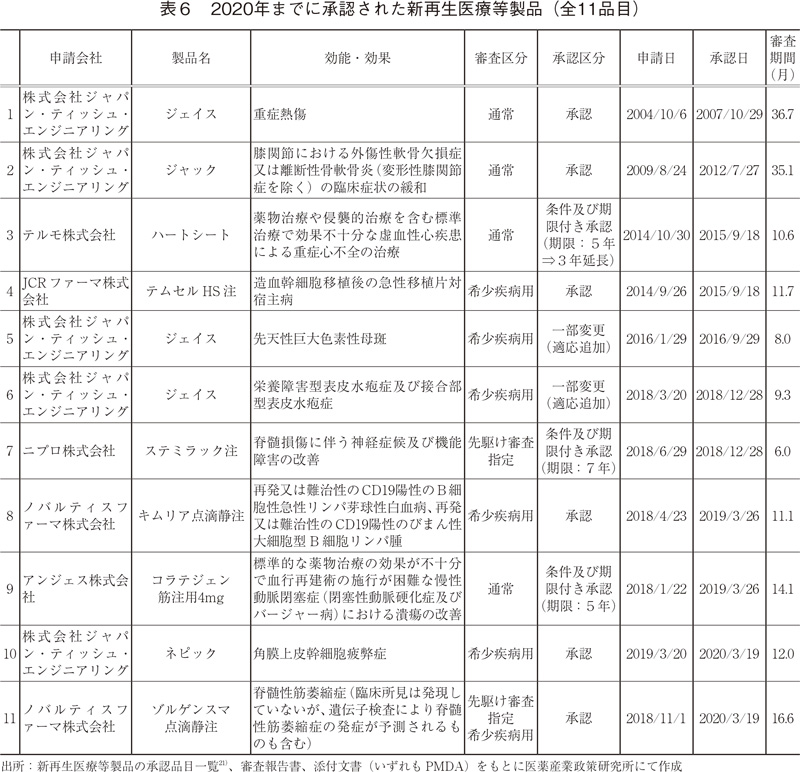
新再生医療等製品の審査期間については、2020年までに承認された対象品目全体の審査期間中央値が11.7ヶ月(平均値15.6ヶ月、標準偏差10.4)であった。また、医薬品医療機器等法(2014年11月施行)により再生医療等製品のカテゴリーが新設された後に承認された9品目については、審査期間中央値が11.1ヶ月(平均値11.0ヶ月、標準偏差3.2)となった。これらの結果を前述した2010~2020年の期間での新医薬品の審査期間と比較したところ、大きな差は確認されなかった。
ただし、2020年に承認された2品目は希少疾病用で優先審査の対象であり、そのうち1品目は先駆け審査の対象となっていたが、それらの審査期間はどちらも12ヶ月以上の期間を要した。再生医療等製品における審査期間の目標値として優先品目では全品目の50%を9ヶ月以内に処理とされており6)、その目標を達成できたとは言い難い。特に、先駆け審査指定の品目については、本制度の主旨として「患者に世界で最先端の治療薬を最も早く提供することを目指す」とあるが、米国での承認(2019年5月)から約10ヶ月遅れた。本件は、厚生労働省「先駆的医薬品指定制度について」13)に記載された指定の取消要件「十分な事前評価を受けずに申請された又は申請資料に相当の瑕疵があると判明した結果、我が国での早期の開発が達成できなくなった場合」の厳格化に繋がった22)。
考察とまとめ
本稿では、2020年に日本で承認された新医薬品と新再生医療等製品の承認状況およびその審査期間について調査した。加えて、2010~2020年に承認された新医薬品に関する各区分別での経年分析をおこなった。また、2020年秋に施行された先駆的医薬品指定制度に関するこれまでの承認・審査期間情報、現在も猛威を振るう新型コロナウイルスに対する治療薬に適応された特例承認に係る品目に関する情報をまとめた。
日本で2020年に新医薬品として承認された品目数は125品目であり、過去10年間の年平均承認品目数より高い水準であった。その内訳を見ると、新効能医薬品が2019年に比べて13品目増加するなどの特徴が見られた。承認された品目の審査期間に関しては、その中央値は10.6ヶ月と、審査期間が大幅に短縮した2011年以降では僅差ながらも最も長いものであった。2020年は新医薬品の承認に関してもCOVID-19の影響が懸念されたが、承認された品目数やその審査期間を見る限り最低限の影響に留められていたことが確認できた。ただし、COVID-19の流行により医療従事者の負担が増え、被験者の感染リスクが高まったことで、臨床開発に影響が出ているとの分析もあるため23)、2021年以降の新薬承認状況を注視する必要があるだろう。
NME承認品目に関する各区分別での経年分析については、審査区分別での調査において優先審査品目の割合が2014年をピークに減少する傾向が見られた。これは優先審査対象となる希少疾病用医薬品NME数の減少が要因の1つと考えられた。一方、先駆け審査対象品目の承認数の着実な増加は、患者および製薬企業にとっての光明であろう。また、NME承認品目数に関する内外資企業別の調査からは、2017年から2019年にかけて内資企業申請品目の承認割合が増加していることが確認された。医薬品の研究開発が多様化・高度化する中、近年の内資企業の研究開発への取り組みが功を奏してきたとも考えられる。ただし、2020年はその割合が若干の減少に転じていた。国内医薬品産業振興の観点からも、2021年以降の再度の巻き返しを期待したい。
バイオ医薬品承認状況の経年分析からは、全承認品目に占めるバイオ医薬品の割合が2010年と比べて大きく伸びている要因として、NMEの承認数増加よりも新効能医薬品やバイオ後続品の増加の影響が大きいということが確認された。理由の1つとして、抗体医薬品であるオプジーボやキートルーダの事例のように、医薬品の作用機序からしてそもそも汎用性がある医薬品が、この10年の間にNMEとして複数承認され、その後に新効能医薬品として数多く承認されたことが挙げられる。また、1つの新薬、特にNMEの創出が容易でない昨今を鑑み、多くの製薬企業が売上の拡大を狙う方策の1つとして、入口としてはマーケットが小さくとも成功確率の高い標的疾患を選抜し承認を得た後、効能追加によりマーケットの拡大を狙うという開発戦略をおこなっている現状が表れており、この戦略にバイオ医薬品がマッチしたのかもしれない。また、バイオ後続品については、2010~2020年の期間もバイオ医薬品NMEは着実に増加しており、それら製品はいずれ特許期間や再審査期間の満了を迎えることになるため、医療費削減の政府の方針も相まって今後も安定的に承認されていくと考えられる。
一方、低分子等医薬品の承認品目数については、新医薬品の全承認品目数に占める割合が2010年から減少傾向にあったものの直近3年はその減少に歯止めがかかり、そのうちのNMEに関しては、昨年、今年とバイオ医薬品NMEの約3倍もの承認を得ていた。低分子医薬品は、標的分子の枯渇や研究開発の高難易度化などから新薬創出のハードルが益々高まっていると言われて久しいが24)、タンパク質間相互作用やRNAなどの核酸を標的とした低分子創薬の進展等による標的分子の拡大により25)、今後も着実に生み出されていくと思われる。また、今回の区分けでの低分子等医薬品の定義はバイオ医薬品以外としており、2020年に承認された「ビルテプソ点滴静注」のような化学合成により製造される核酸医薬品も含めている。今後、これら新規モダリティの発展による承認や審査への影響についても注視していく必要があるだろう。
希少疾病用医薬品の承認状況については、2019年に過去最多の承認品目数となっていた反動か、2020年の承認品目数は大きく減少していた。ただし、この減少が将来的に続くとは考えておらず、厚生労働省ホームページにて公開されている「希少疾病用医薬品指定品目一覧表」26)を見ると、2020年だけで49品目が希少疾病用医薬品指定を受けており、製薬企業等による希少難病で苦しむ患者さんに向けた医薬品創出の取り組みは継続されていることがわかる。
抗悪性腫瘍薬の承認品目数については、2010年以降右肩上がりに増えており、2020年は過去最多の45品目が承認され、新医薬品の承認品目数全体の36%を占めた。今回調査したデータを見ると、着実に抗悪性腫瘍薬の開発は進められ、承認数も年々増えていることがわかる。一方、国立がん研究センターが公開している「国内で薬事法上未承認・適応外である医薬品について」を見ると、米国や欧州で承認されているが日本未承認または適応外のがん領域の医薬品が未だにかなりの数あることがわかる27)。日米欧でのドラッグラグの解消が進んでいることは過去の分析から確認できてはいるものの28)、この辺りの差異については今後の検討課題としたい。
新医薬品の承認品目における先駆け審査指定制度対象品目の承認と審査期間の調査からは、2020年までに承認された全10品目全体の審査期間中央値が5.2ヶ月、品目別で見ても全品目が6ヶ月以内と非常に短い期間で審査処理されており、全品目が世界に先駆けて日本で承認されていたことを確認した。正式な審査を行ったうえでの短期間での承認は、画期的な新薬を待ち望んでいる患者さんへのメリットだけでなく、企業にとってのインセンティブともなり、双方にとって望ましい結果であった。また、審査期間の短縮を達成するためには審査側と申請側との協力体制が不可欠であるが、本調査結果はこの協力体制がうまく機能していることを示唆している。本制度については、2020年秋に先駆的医薬品指定制度として法制化・施行されたことで、これまで年1回の指定だったものが、年に2回程度(概ね4月及び10月)の指定をおこなうと公表されており、より良い制度となった13)。さらに厚生労働省は、小児用や薬剤耐性菌治療用を対象とした医薬品の研究開発の促進に寄与することを目的として、「特定用途医薬品」の指定制度を創設し29)、未充足な領域への対策をうった。今後、製薬企業側はこれら制度を活用し、社会的な要請に応えていく必要があるだろう。
特例承認に係る承認品目とその審査期間の調査では、ベクルリーと過去のインフルエンザ(H1N1)輸入ワクチンとの審査期間の比較、そしてベクルリーを例としたCOVID-19に対する日米欧の承認審査期間に関する情報整理から、今回の特例承認対応の早さを再確認しただけでなく、日本の特例承認と米国の緊急使用許可との違いや欧州の対応の仕方にも調査の幅を広げ報告した。今後の特例承認であるが、ファイザー社の新型コロナワクチン(mRNAワクチン)が2020年12月18日に国内で承認申請されており30)、2021年2月中には特例承認を受けると報道されている。過去のインフルエンザ(H1N1)輸入ワクチンの際は2.5ヶ月以上の審査期間を要しており、報道通りならばワクチンとしては国内最速での承認となる。COVID-19の収束に向け大いに期待するところであるが、将来の新たな感染症も見据え、今後のCOVID-19に関する承認品目も含めた更なる日米欧各極の比較調査を進め、分析を深めていく必要があるだろう。重篤な患者に用いられる治療薬、軽度の患者に用いられる治療薬、感染前の人々に用いられるワクチンとでは、薬効、血中動態、安全性など求められるハードルに違いがあり、さらに品目ごとに製剤面や大量・安定供給に向けた生産体制などの課題を有するため、承認状況、開発状況、各国のこの難局に対応するための制度など含め、理解が難しい点が多々ある。
新再生医療等製品の承認品目と審査期間の調査からは、2020年までに承認された全11品目(承認区分として一部変更含む)の審査期間中央値が11.7ヶ月であったことがわかった。承認品目の半数以上(6品目)が希少疾病用再生医療等製品、2品目が先駆け審査指定再生医療等製品として承認されており、これまで治療が困難であった難病に対する新たな治療選択肢としての地位を確立しつつある。ただし、新再生医療等製品はこれまでの新医薬品(低分子やバイオ医薬品)と異なる新たなモダリティであるが故に生じる課題があるため、PMDAの審査期間目標値もより幅を持たせてあり6)、実際に予定通りに審査が進んでいなかった品目も確認された。今後の状況であるが、2021年1月末時点で既に承認された品目が1品目(イエスカルタ点滴静注:承認日1月22日)、承認申請中の品目が4品目あり31)、新再生医療等製品の承認品目は増加していくと考えられる。また、2020年承認品目は該当しなかったが、再生医療等製品の特有の制度として「条件及び期限付き承認制度」がある。この制度は、2014年11月に再生医療等製品のカテゴリーが新設された際に導入され、これまで3品目に適応されている(表6)。均質でない再生医療等製品については、有効性が推定され、安全性が確認されれば、条件及び期限付きで特別に早期に承認できる仕組みとなっており、その場合、承認後に有効性・安全性を改めて検証する必要があり、承認を受けたものは、期限内に使用成績に関する資料等を添付して、再度承認申請を行うことが求められている。つまり、治療法の乏しい患者への早期のアクセスを確保しつつも、市販後に有効性が確認されない場合は承認を取り消す法的根拠があり、科学的評価を追求しながら製品の性質に対応した制度となっている。表6を見ると、対象の3品目は2023年~2025年にかけてその期限を迎え再度承認申請を行うことになる。現在承認申請中の品目も本制度の適応対象となる可能性のある品目があり、申請中の4品目のうち3品目は希少疾病用再生医療等製品に指定されていることからも、新たな治療選択肢として早期の承認が望まれる。
以上、2020年の承認品目とその審査期間調査と共に、過去10年の動向と特徴的な制度の現況について取りあげてきた。医薬品の研究開発が多様化・高度化する中、環境変化に対応し、患者さんの健康や公衆衛生上の課題に貢献していくことを念頭に、新たなイノベーションと価値が生み出されていくことを期待する。
-
1)医薬産業政策研究所.「日本における新薬の臨床開発と承認審査の実績」リサーチペーパー・シリーズ No.69(2016年11月)
-
2)医薬産業政策研究所.「2019年に日本で承認された新医薬品とその審査期間」政策研ニュース No.59(2020年3月)
-
3)医薬産業政策研究所.「日米欧の新薬承認状況と審査期間の比較-2019年承認実績を中心に-」政策研ニュース No.61(2020年11月)
-
4)独立行政法人医薬品医療機器総合機構(PMDA)ホームページ「新医薬品の承認品目一覧」Accessed on Jan 26, 2021.
-
5)2020年はバイオ後続品(申請区分)として、インスリン リスプロ1品目、アダリムマブ1品目が承認されている。
-
6)独立行政法人医薬品医療機器総合機構(PMDA)ホームページ 第四期中期目標
-
7)本稿で用いた内外資企業の定義:厚生労働省「医薬品・医療機器産業実態調査:用語の解説」を参照。2020年の申請企業である楽天メディカルジャパンについては内資企業として集計した。
-
8)本稿で用いたバイオ医薬品の定義:厚生労働省「バイオ医薬品・バイオシミラー講習会」資料参照 Accessed on Jan 26, 2021.
-
9)本稿で用いた低分子等医薬品の定義:バイオ医薬品と定義されたもの以外を低分子等医薬品としている。
-
10)本稿で用いた抗悪性腫瘍薬の定義:PMDAホームページ「新医薬品の承認品目一覧」にて「抗悪分野」と記載がある品目 Accessed on Jan 26, 2021.
-
11)
-
12)明日の新薬((株)テクノミック)、及び、各社公表情報をもとに医薬産業政策研究所調べ。2020年末時点で日本以外では開発されていない品目を含む。
-
13)厚生労働省「先駆的医薬品指定制度について」
-
14)厚生労働省「医薬品医療機器等法に基づくレムデシビル製剤の特例承認について」「レムデシビル製剤の使用に当たっての留意事項について」(令和2年5月7日)
-
15)
-
16)
-
17)
-
18)
-
19)
-
20)厚生労働省「新型コロナウイルス感染症について:治療薬の候補となる薬剤について(2020年12月23日版)」Accessed on Jan 25, 2021.
-
21)独立行政法人医薬品医療機器総合機構(PMDA)ホームページ「新再生医療等製品の承認品目一覧」Accessed on Jan 25, 2021.
-
22)
-
23)医薬産業政策研究所.「医薬品産業におけるCOVID-19パンデミックへの対応と今後」政策研ニュース No.61(2020年11月)
-
24)医薬産業政策研究所.「創薬化学の側面から見た低分子医薬の将来像-低分子から中分子への広がり-」リサーチペーパー・シリーズ No.72(2018年5月)
-
25)Drug Discovery Chemistry VIRTUAL, MAY 18-20, 2021 Accessed on Feb 3, 2021
-
26)
-
27)国立がん研究センター「国内で薬事法上未承認・適応外である医薬品について」Accessed on Jan 29, 2021.
-
28)医薬産業政策研究所.「世界の売上高上位300製品の上市状況の日米欧比較-ドラッグラグの解消は進んでいるか-」政策研ニュース No.57(2019年7月)
-
29)厚生労働省「特定用途医薬品の指定制度について」
-
30)厚生労働省「新型コロナワクチンの開発状況について」
-
31)明日の新薬((株)テクノミック)、及び、各社公表情報をもとに医薬産業政策研究所調べ。

