目で見る製薬産業 日米欧NME承認品目の創出企業の国籍 2010~2019年の承認品目を中心に
医薬産業政策研究所 主任研究員 澁口朋之
はじめに
医薬産業政策研究所では、医薬品世界売上高上位100品目について、各品目の基本特許1)を調査し、出願時の医薬品創出企業を継続的に調査・報告している2)。また、希少疾病用医薬品や日米欧の薬事上の特別措置を受けた品目に焦点を当てた調査も行ってきた3)。これまでの分析に加え、より最近の新薬創出の実績や全体的な傾向を把握するため、2010~2019年の10年間に日米欧各極で新有効成分含有医薬品(New Molecular Entity, NME)として承認された品目を対象として創出企業の国籍調査を行ったので報告する。
研究方法
NMEは、政策研ニュースNo.61にて吉田らが報告した「日米欧の新薬承認状況と審査期間の比較」4)で用いた日米欧各審査機関の承認情報および分析結果をもとに、それぞれの審査機関でNMEと特定された品目とした。
各品目の基本特許はクラリベイト・アナリティクス社のCortellis Competitive Intelligenceを用い、各品目の"Patent"に収録された特許のうち、"Product"に分類された特許をもとに特定した。創出企業・機関の国籍はこれまでの調査と同様に、上記特許に記載されている出願人/譲受人の国籍としているが、出願時点に海外親会社がある場合には親会社の国籍とした。なお、一部の製品に関しては特許が無い等の理由で特定できなかったものもある。
日米欧各極で承認されたNMEの創出企業国籍
2010~2019年の10年間(欧州は2013~2019年の7年間)に承認されたNMEの創出企業国籍についてそれぞれ上位10か国についてまとめた(図1)。
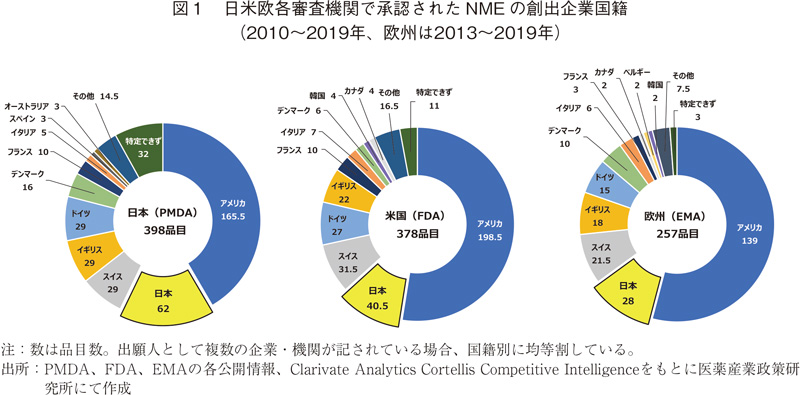
日本ではこの期間に398品目がNMEとして承認され、創出国は全部で19か国であった。その中でアメリカが最も多く、165.5品目であった。2番手は日本の62品目、3番手に29品目でスイス、イギリス、ドイツが続いた。割合や順位の違いはあるものの、基本的にはこれまでの政策研ニュースで報告してきた内容と同様の傾向であった。
アメリカでNMEとして承認された品目は378品目であった。創出国は23か国にのぼったが、1番手はアメリカの198.5品目と半数以上を占めた。2番手は日本で40.5品目あり、スイス(31.5品目)、ドイツ(27品目)、イギリス(22品目)と続いた。
欧州に関してはデータの都合上2013~2019年の集計データである。本期間中にNMEとして承認された品目は257品目あり、創出国は19か国あった。欧州においてもアメリカが最も多く、半数以上の139品目を占め、2番手は日本の28品目であった。その後は日米同様にスイス(21.5品目)、イギリス(18品目)、ドイツ(15品目)と続いた。
いずれの国・地域においても日本が2番手であった。創出国はいずれも20か国前後であり、アメリカ、日本、およびスイス、イギリス、ドイツをはじめとする欧州各国が創出国の中心であったが、韓国および中国の品目も複数見られた。
日米欧2極以上で承認されたNME(2010年以降初承認品目)
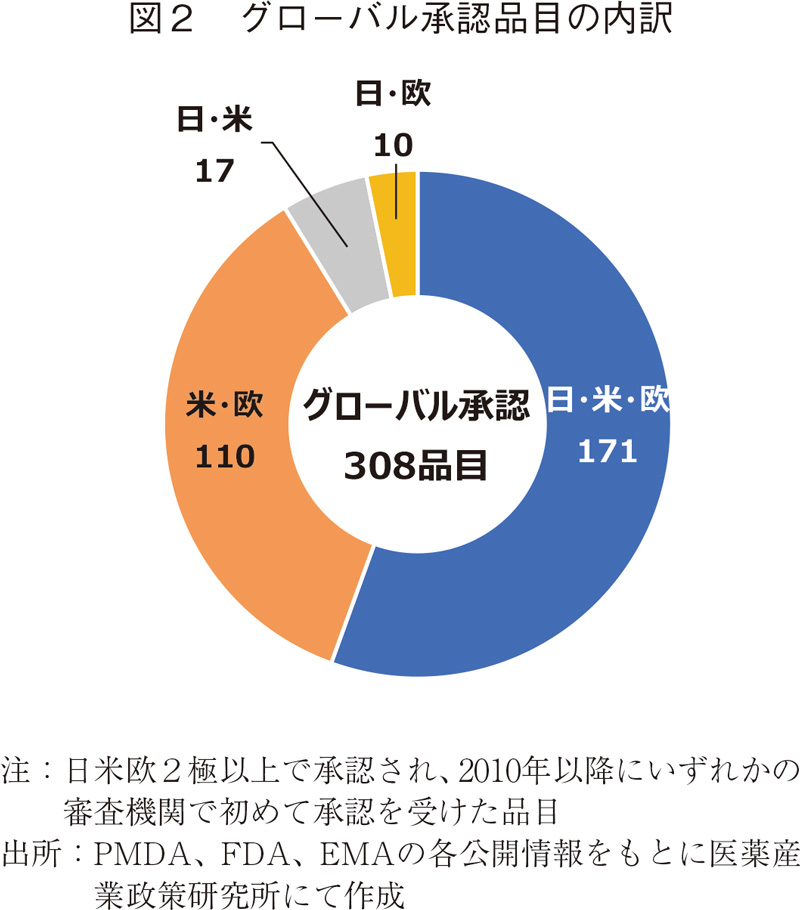
前節で検証した結果は各国・地域内のみで展開されるローカルドラッグも含まれる。グローバル展開される医薬品の創出企業国籍を調べる目的で、図1に示した品目を対象に日米欧2極以上で承認を受けた品目(グローバル承認品目)を抽出した5)。なお、抽出にあたり各品目の2010年以前もしくは2020年の承認状況を確認し、2極以上かつ2010年以降に初めて承認を受けた品目を抽出した。その結果、308品目が本条件に該当し、その内3極で承認を受けている品目が最も多く171品目あった(図2)。米・欧のみで承認されている品目が110品目あったが、その内43品目は日本で開発を行っており6)、今後承認される可能性がある。以降の節では308品目について解析を行った。
グローバル承認品目の特徴
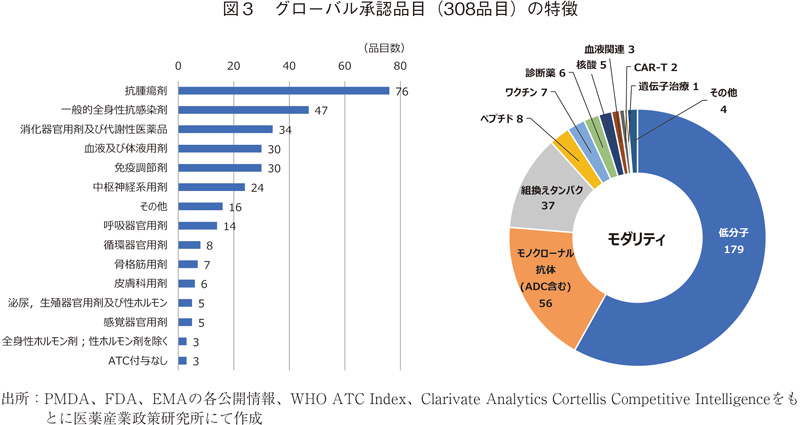
前節で抽出した308品目について、薬効分類7)およびモダリティ8)を図3にまとめる。薬効分類では抗腫瘍剤が76品目と最も多く、続いて一般的全身性抗感染剤(47品目)、消化器官用剤及び代謝性医薬品(34品目)、血液及び体液用剤(30品目)、免疫調節剤(30品目)と続いた。モダリティに関しては低分子が179品目と全体の6割弱を占めた。続いてADCを含むモノクローナル抗体が56品目、組換えタンパクが37品目となった。また、核酸、CAR-Tや遺伝子治療など昨今注目を集めるモダリティも含まれた。
グローバル承認品目の創出企業国籍
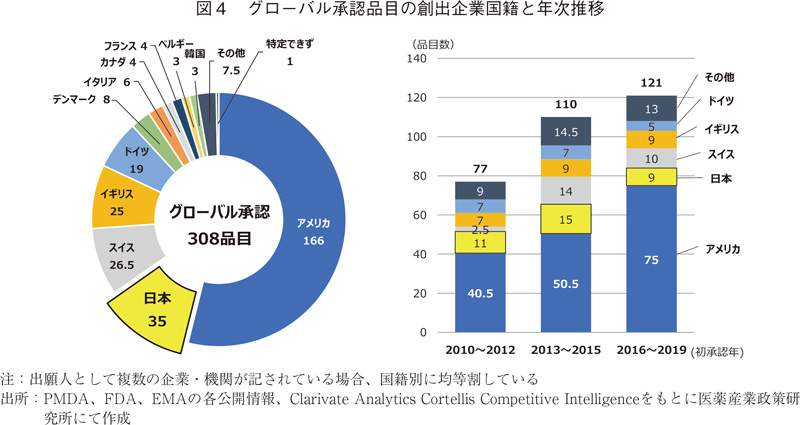
グローバル承認品目308品目について創出企業国籍分類を行った。創出国は全部で17か国あり、上位10か国の結果をまとめた(図4左)。本集計においても日本はアメリカに次ぐ2番手、35品目であった。創出国および地域に関しては図1とほぼ同じ内容であったが、本集計においても韓国が3品目見られた。政策研ニュースNo.61にて鍵井が報告9)したように韓国企業による新薬開発が進んでおり、今後の動向が注目される。図4右は308品目について初承認年をもとに年次推移をとったものである。2010年から3~4年間ずつの累計となるが、2010年代後半になるにつれ、アメリカの品目が増えている。年次推移ではアメリカ主体の傾向が見られたが、日本はそれぞれの期間において2もしくは3番手の品目数であり、グローバルに用いられる医薬品創製の担い手として継続的にNMEのタネを創出し続けていることが分かった。
モダリティの創出企業国籍
図3に示したモダリティのうち、品目数の多い3モダリティの創出企業国籍についてまとめた(図5)。低分子は179品目あり、図4に含まれる17か国のうち、16か国が含まれた。日本はアメリカに次ぐ2番手30品目であり、スイス(15.5品目)、イギリス(14品目)、ドイツ(10品目)と続き、全体的に図4の順位と同じ傾向であった。
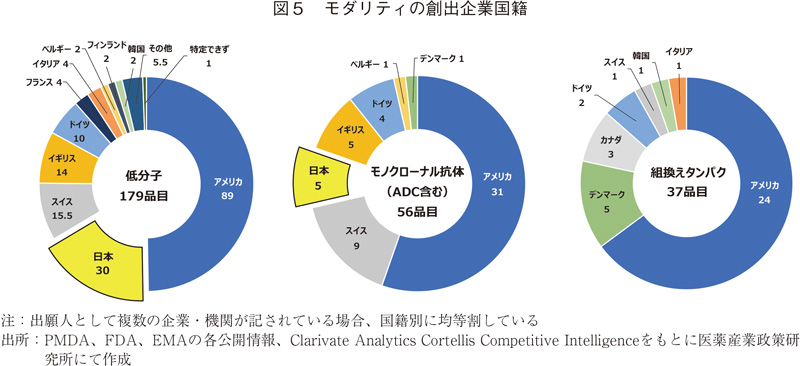
ADCを含むモノクローナル抗体は56品目あり、創出国は7か国であった。アメリカ(31品目)、スイス(9品目)に続き、日本はイギリスと同じ5品目で3番手につけた。低分子に比べ順位や割合は低くなるものの、バイオ医薬品の1つであるモノクローナル抗体を日本が創出していることが分かった。
モダリティの中で3番目に多かった組換えタンパク(37品目)では創出国として7か国見られた。アメリカが1番手で24品目と6割以上を占め、次いでデンマーク(5品目)、カナダ(3品目)となった。順位・創出国は前述の低分子やモノクローナル抗体と傾向が異なった。
グローバル承認品目として韓国が3品目見られたが、その内2品目が低分子、1品目が組換えタンパクであった。
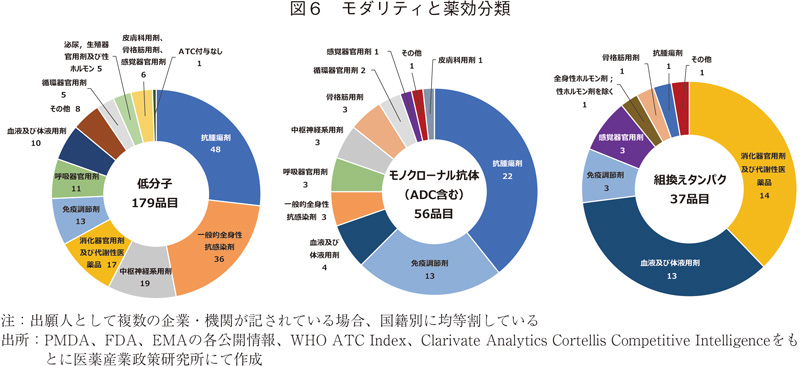
モダリティと薬効分類
前節では組換えタンパクにおいて、創出国の傾向が低分子やモノクローナル抗体と異なる傾向が見られた。その背景を探る目的で各モダリティと薬効分類について調査した。
図6左側に示すように低分子は図3に示した薬効分類のほぼすべてを網羅(13/14薬効分類)し、品目割合も傾向としては同じであった。ADCを含むモノクローナル抗体では主に抗腫瘍剤、免疫調節剤が多かったが、その他の薬効分類についても適応されており、図3に示した14薬効分類中11分類にて活用されていた。組換えタンパクでは、消化器官用剤及び代謝性医薬品と血液及び体液用剤が全体の7割強を占めた。図に示していないが、上記2つの薬効分類の中でも一部の分類に集中していた。具体的には前者においてはインスリン製剤などの糖尿病用薬、および希少疾病医薬品に多くみられる、その他の消化器官用剤及び代謝性医薬品であった。また後者においてはそのほとんどが抗出血薬に分類される品目であった。このようにある程度限定された領域において組換えタンパクは活用されており、その技術及び薬効領域を得意とする企業国籍が反映されたものと思われる。
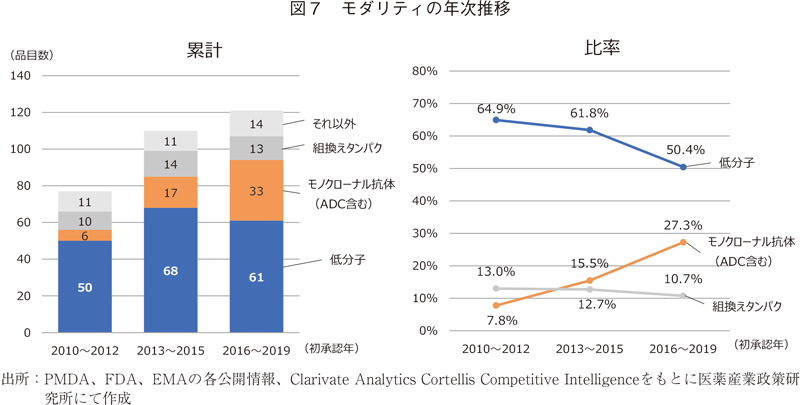
モダリティの年次推移
続いて3モダリティについて初承認年別に年次推移を調査した(図7)。低分子がいずれの期間においても最も品目数が多かった(図7左)。一方、品目全体の比率でみると徐々に低下傾向であり、2010~2012年では65%程度であったが、2016~2019年では50%程度まで下がっている。その一方でモノクローナル抗体の承認数が品目数・割合共に増加傾向にあり、2016~2019年では全体の3割弱を占めるようになっていた。組換えタンパクに関しては大きな変化は見られなかった。
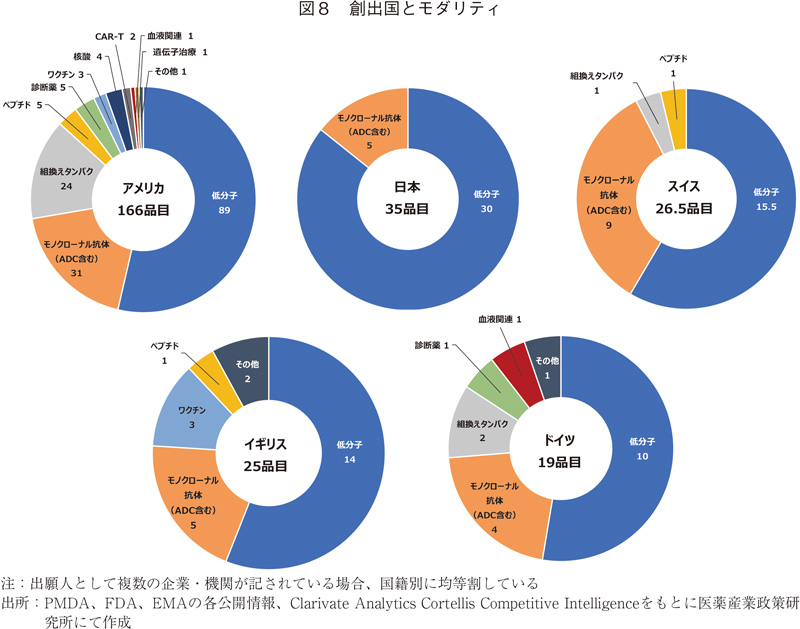
創出国とモダリティ
最後に創出国とモダリティの関係を調査した。図8に示すようにアメリカは品目数が多く、核酸やCAR-Tなど注目を集めるモダリティも含め、グローバル承認品目における各モダリティの割合と同じ傾向であった。一方日本は35品目中30品目と低分子が8割以上を占め、他はADCを含むモノクローナル抗体5品目であった。日本と品目数の近いスイス、イギリス、ドイツでは低分子と抗体が多くを占めるものの、他に複数のモダリティの品目が見られた。今回の調査期間において日本は低分子とモノクローナル抗体のみであったが、それ以前ではペプチドなど他のモダリティの品目も創製していた。組換えタンパクやワクチンに関しては日本のみの承認品目として複数あったが、2極以上での承認品目という観点ではなかった。
まとめ
これまで見てきたように2010~2019年にNMEとして承認された品目において、各国・地域別、および2極以上で承認を受けた品目のいずれの集計においても日本が2番手の創出国となった。アメリカオリジンの品目がいずれも全体の半数以上を占め、年次推移でアメリカのシェアが高まる傾向も見られるが、グローバルに用いられる医薬品創製の担い手として日本が世界で一定の地位にあることが示された。
また、今回モダリティに着目して創出企業やその薬効分類の特徴について調査を行った。日本が低分子に特化している傾向が改めて認識されたものの、モノクローナル抗体を中心にバイオ医薬品の創出にも寄与していることが分かった。また、今回の調査期間には含まれないものの、デュシェンヌ型筋ジストロフィー治療剤として日本新薬が創製した核酸医薬であるビルトラセン(製品名:ビルテプソ®)が2020年に日米で承認を得ており、今後も日本創製品のモダリティ多様化を期待したい。
モダリティはあくまで対象とする疾患治療に最適なものを選ぶべきであり、新しいモダリティが最適とは限らない。また低分子で代替できるメカニズムも存在すると思われ、低分子に強みを持っていることは資産だと考えられる。同時に、新しいモダリティによって初めて解明される疾患メカニズムや治療手段があることも確かであり、今後も継続して新薬を創出していくためにも創薬の手段として積極的に活用する能力を構築していく必要があると思われる。
-
1)本調査における基本特許とは、物質特許や用途特許等、各品目の鍵となっている特許を示す。
-
2)医薬産業政策研究所「国・企業国籍からみた医薬品の創出と権利帰属」政策研ニュースNo.42(2014年07月)、以降、政策研ニュースNo.47(2016年3月)、No.50(2017年3月)、No.52(2017年11月)、No.55(2018年11月)、No.58(2019年11月)、No.61(2020年11月)
-
3)医薬産業政策研究所「日本で承認された希少疾病用医薬品の創出国 -2008年度から2017年度-」政策研ニュースNo.54(2018年7月)
医薬産業政策研究所「日米欧の薬事上の特別措置を受けて承認された医薬品の創出国」政策研ニュースNo.57(2019年7月) -
4)医薬産業政策研究所「日米欧の新薬承認状況と審査期間の比較 -2019年承認実績を中心に-」政策研ニュースNo.61(2020年11月)
-
5)調査時時点(2020年12月)において単一国のみで承認を受けた品目であっても将来的にグローバル展開する可能性がある。
-
6)Cortellis Competitive Intelligenceの各品目の"Development Status"において日本での開発状況が確認できたもの。
-
7)薬効分類はWHOの下記Webサイトを参照し、各品目のThe Anatomical Therapeutic Chemical code(ATC code)をもとに行った。
ATC/DDD Index 2021 -
8)モダリティはCortellis Competitive Intelligenceの各品目にある"Technology" をもとに著者による分類を行った。
-
9)医薬産業政策研究所「創薬モダリティ別医薬品開発パイプラインから見た新規医薬品の創製企業(Originator)に関する調査」政策研ニュースNo.61(2020年11月)

