Points of View 医薬品開発パイプラインのモダリティと適応症に関する調査
医薬産業政策研究所 主任研究員 鍵井英之
1 はじめに
近年、核酸医薬品、遺伝子治療、遺伝子細胞治療など、新しい創薬モダリティを活用した医薬品が登場し、これまで治療が困難であった、がんや遺伝性疾患、直近では新型コロナウイルスなどの疾患領域で大きなインパクトをもたらしている。
いわゆる新規モダリティと呼ばれる新規技術では、低分子医薬品や抗体医薬品に比べると、薬物送達性や製造方法、製造コストなど、それぞれ技術的進展の余地が多く残されているものの、多様な疾患・創薬ターゲットに対して複数のモダリティから最適な治療薬を戦略的にデザインできる時代が到来したといっても過言ではない。
そこで今回、現在の医薬品で主要なモダリティである低分子医薬品および抗体医薬品に加え、近年実用化が進んでいる比較的新しいモダリティとして核酸医薬品、遺伝子治療、腫瘍溶解性ウイルス1)、遺伝子細胞治療、細胞治療に着目し、それらの開発パイプラインがどのような適応疾患を対象としているか調査した。
2 調査方法
医薬品データベースEvaluatePharmaの収載情報(2021年1月16日出力)より、新有効成分含有医薬品(New Molecular Entity:NME2))を対象とした。臨床開発段階(P1~P3)および申請段階における開発品に関して、モダリティ別に疾患領域に関する情報を抽出した。既に上市・承認されているNMEが適応追加のために臨床開発が実施されている場合、そのNMEについても分析対象としたが、既に承認されている適応については、分析対象外とした。
①適応疾患領域の分類・階層および該当成分数のカウント
EvaluatePharmaでは、医薬品および開発品の適応疾患を、Indication level 1(20疾患領域)、同2(98疾患区分)、同3(946適応症)の3段階で階層化しており、本稿ではlevel 1~3をそれぞれ"大分類"、"中分類"、"小分類"とした。
1成分が複数の疾患領域で開発されている場合、分析対象とする階層において、それぞれ重複してカウントしている。例えば大分類の分析を行う場合、1つの成分が"がん"および"免疫"領域で開発されていればそれぞれを1とカウントしているが、中分類である"固形がん"、"血液がん"、あるいは小分類である"肺がん"、"大腸がん"などに複数の適応があったとしても重複してカウントしていない。
②モダリティ分類
本調査のモダリティ分類は、EvalluatePharma の分類と以下のように対応している3)。
- 低分子薬品
- Small molecule chemistry
- 抗体医薬品
- Monoclonal antibody, Monoclonal antibody (Conjugated)
- 核酸医薬品
- DNA & RNA therapeutics(mRNAワクチンやDNAワクチンは含まない)
- 遺伝子治療
- Gene therapy, Genome editing
- 腫瘍溶解性ウイルス
- Oncolytic virus
- 遺伝子細胞治療
- Gene-modified cell therapy4)
- 細胞治療
- Cell Therapy5)
③対象となる有効成分(品目)数
本調査で対象とする開発段階と有効成分(品目)数は表1の通りである。1成分において複数の適応や開発段階で開発が進められている場合、最も進んだ開発段階でカウントしている。本調査においては、P1~申請段階をまとめて"開発段階"として扱っている。
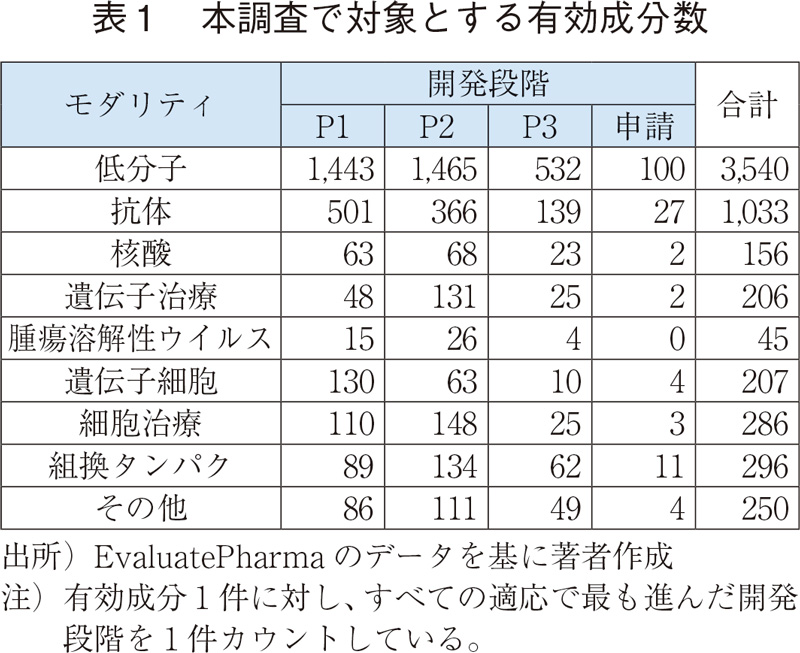
3 結果
3.1 モダリティ別・開発品の適応疾患領域(大分類)
表1の開発品について、適応疾患領域の内訳を図1に、モダリティ別の内訳を図2に示す。全体ではがん領域の開発品が最も多く、これは、個別のモダリティにおいても同様であった。
特に抗体医薬品、遺伝子細胞治療では、開発品の60%以上でがん領域での開発が進められている。遺伝子細胞治療は、CAR-T細胞療法やT細胞受容体(TCR)療法など、がんをターゲットとした開発品が中心である。また、腫瘍溶解性ウイルスはその特性上、がん領域の適応が100%である。
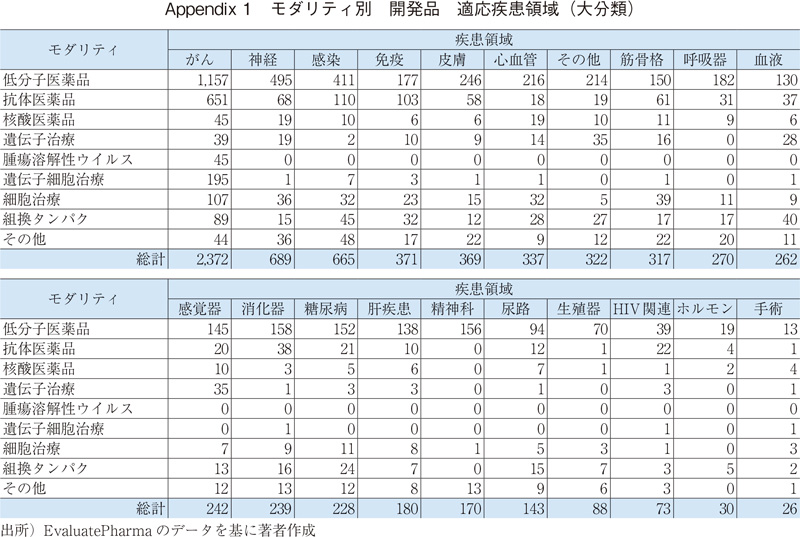
遺伝子治療では、がんで開発されている有効成分の割合は遺伝子治療全体の20%以下であり、他のモダリティと比べると低く、"その他"(主にはライソゾーム病が含まれる。Appendix 1参照)、"感覚器"の開発数が多い。特定の遺伝子や遺伝性疾患をターゲットとすることで、幅広い疾患領域での開発が進んでいると考えられる。
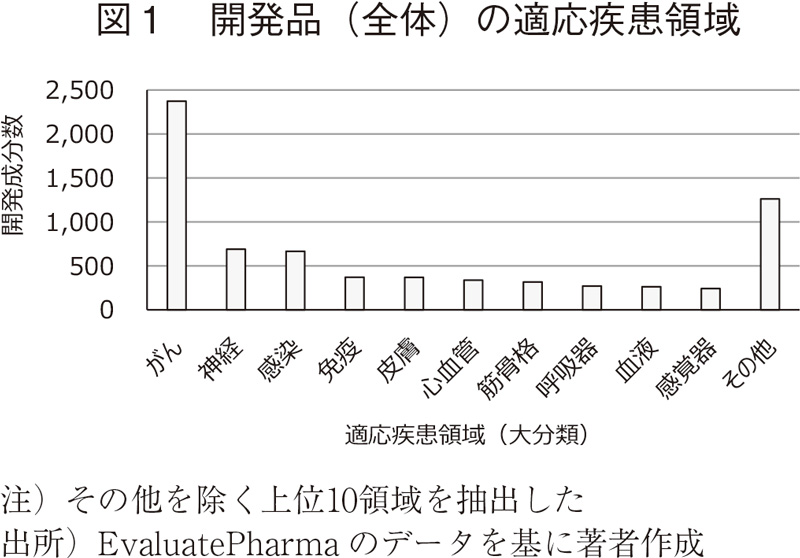
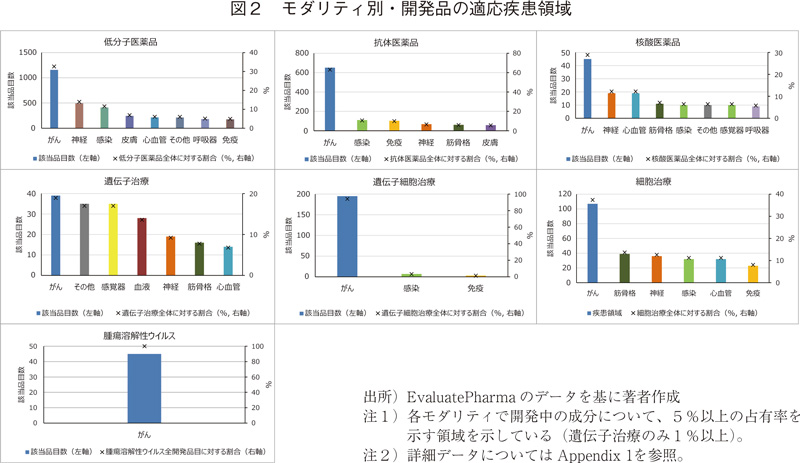
3.2 既承認の低分子医薬品および抗体医薬品の適応疾患領域(大分類)
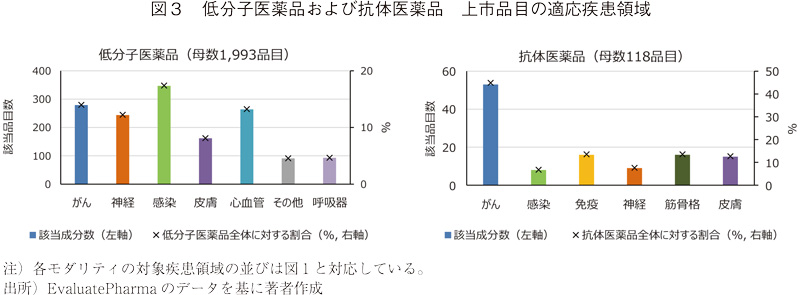
低分子医薬品、抗体医薬品については、多くの医薬品が上市されていることから、これら2つのモダリティについて、既承認(承認および上市)品目の適応疾患領域を調査した(図3)。
低分子医薬品では、感染症領域や心血管(循環器)領域の割合が高くなっている。既承認の抗体医薬品では、がんの適応を有する品目の割合は開発品(図2、63.1%)と比べるとやや低く44.9%であり、"免疫"、"筋骨格"などの割合が高くなっている。
3.3 疾患領域(大分類)から見た開発品のモダリティ内訳
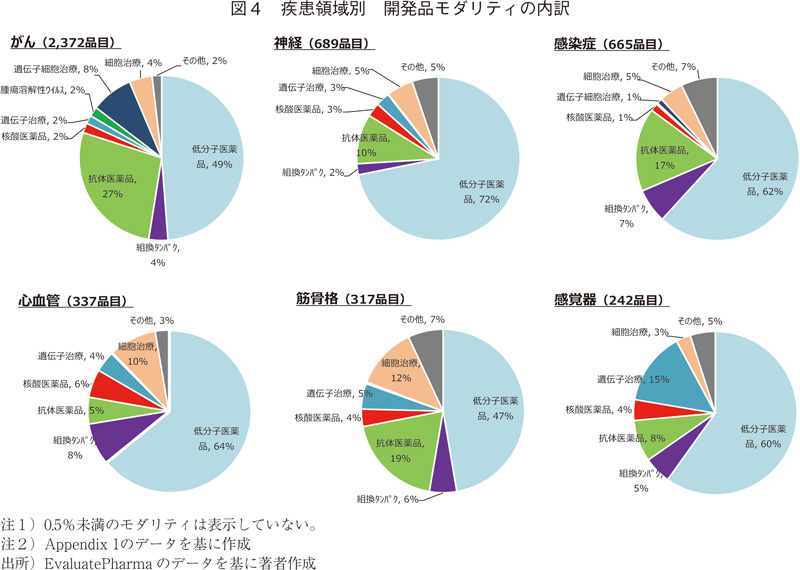
次に、疾患領域別に、開発品のモダリティ分類の内訳を示す。ここでは、開発品目数が上位の3領域(がん、神経、感染症)に加え、新規モダリティとして核酸医薬品、細胞治療、遺伝子治療の割合がもっとも高い疾患領域としてそれぞれ、心血管、筋骨格、感覚器領域を示す。(図4、他の疾患領域についてはAppendix1参照)
がん領域では、低分子医薬品は概ね半数であり、他の領域と比較すると抗体医薬品や遺伝子細胞治療などバイオ医薬品の割合が高くなっている。神経領域では、低分子医薬品の割合が高いが、これは中枢神経系への薬物送達性の点で優れていることが理由の一つと考えられる。また、心血管領域では、核酸医薬品の占める割合が他の領域に比べて高いが、疾患ターゲットや作用メカニズムなどは他のモダリティと異なる(3.4項にて後述)。細胞治療は組織の再生などの点から筋骨格領域、遺伝子治療では局所投与が可能な感覚器領域など、適応疾患領域によって、開発されている個々のモダリティの占める割合が異なることが確認された。
3.4 モダリティ別・開発品の疾患領域(中分類、小分類)
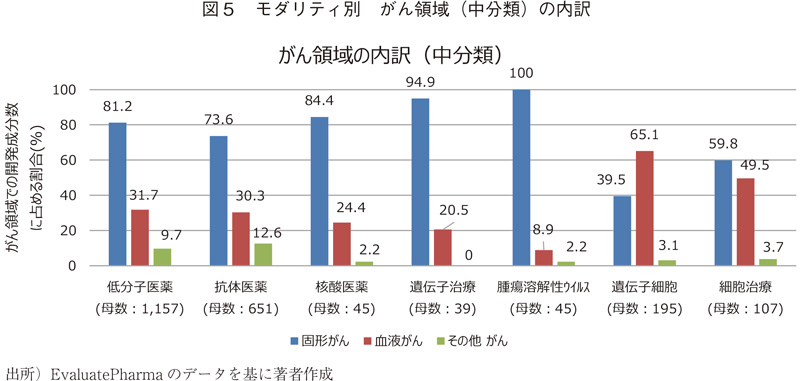
中分類
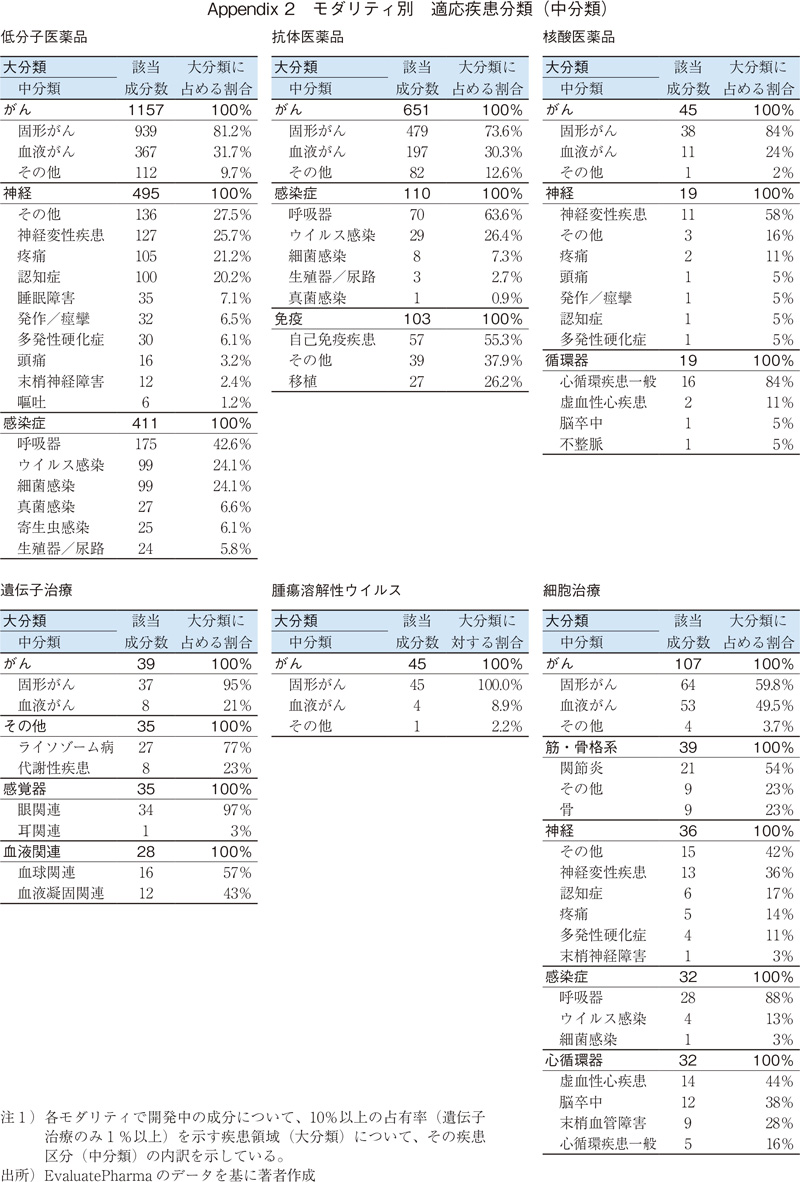
いずれのモダリティでもがん領域に適応を有する成分の割合が多いが、その内訳(中分類)は図5の通りである。低分子医薬品、抗体医薬品、核酸医薬品、遺伝子治療、腫瘍溶解性ウイルスでは固形がん、遺伝子細胞治療では血液がんの割合が大きい。細胞治療は概ね同程度である。がん以外の疾患領域(中分類)については、Appendix2にデータを掲載した。
小分類
モダリティ毎に、開発品目数が多い適応疾患(小分類)を、"がん領域"および"がん領域以外"それぞれについて表2に示す。
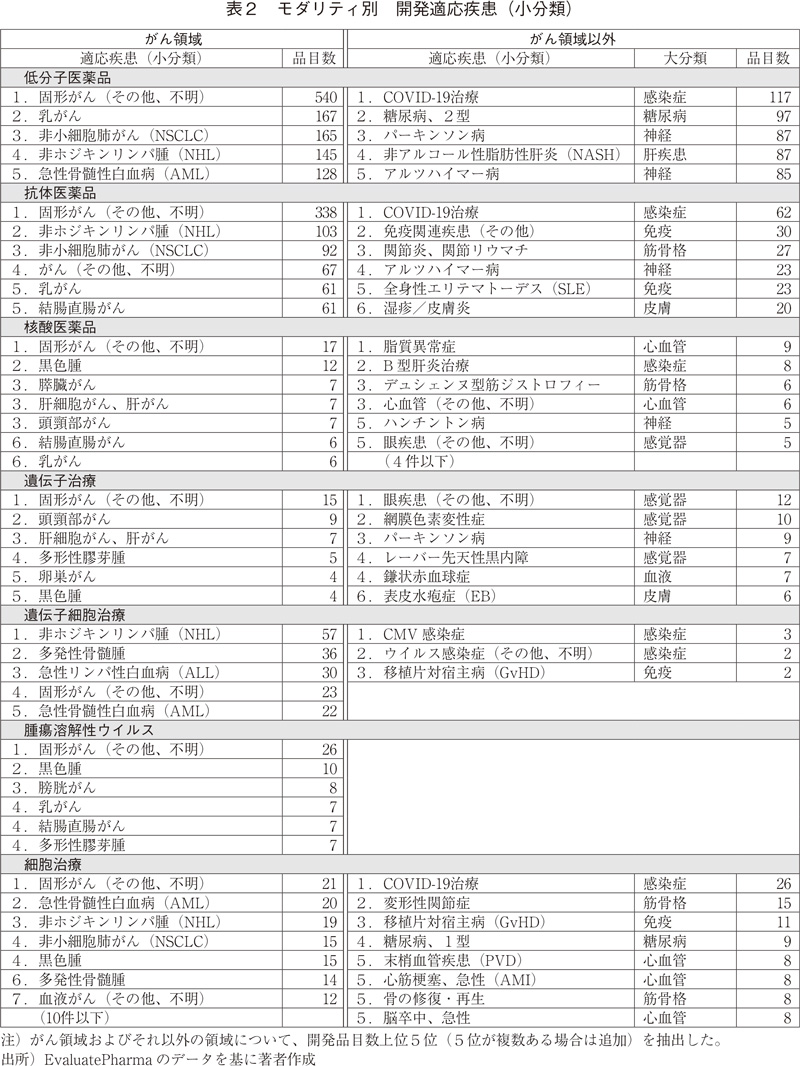
がん領域では、個別の疾患名が確認できるものでは、乳がん、非小細胞肺がん、非ホジキンリンパ腫、急性骨髄性白血病の開発品が多いが、核酸医薬品や腫瘍溶解性ウイルス、細胞治療では、黒色腫、頭頚部がんといった低分子医薬品や抗体医薬品とは異なる疾患が見られる。
がん領域以外の疾患では、低分子医薬品、抗体医薬品に共通するものとしてCOVID-19、パーキンソン病やアルツハイマーなどの神経領域、抗体医薬品では、リウマチや全身性エリテマトーデスなど自己免疫疾患が含まれる。なお、COVID-19に関しては、既承認薬からのドラッグリポジショニングが多く含まれている。
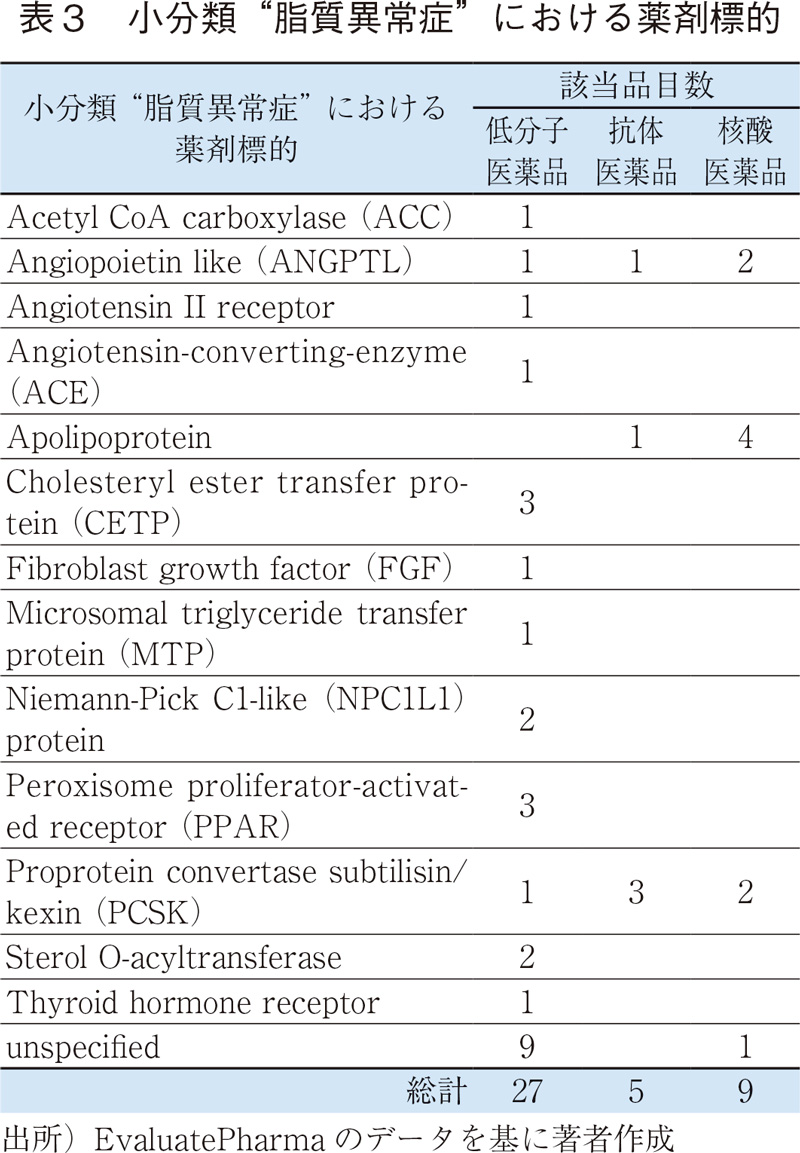
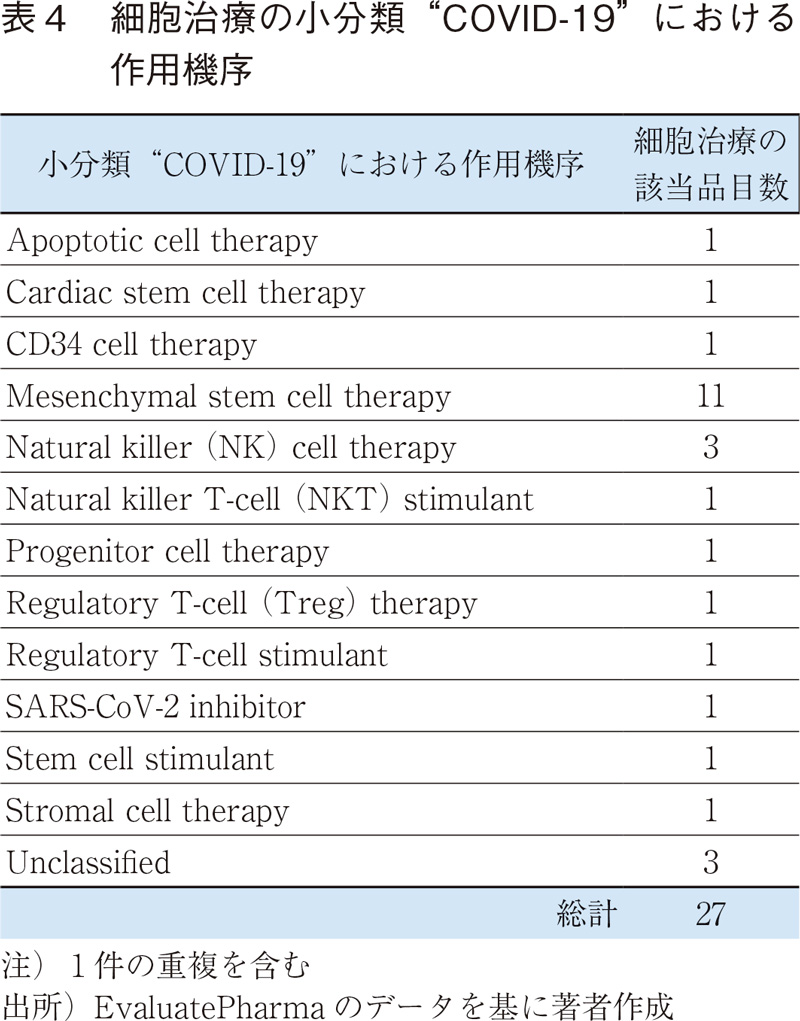
核酸医薬品では、"脂質異常症"が最も多いが、これは脂質代謝に関連した特定の遺伝子(ApoC3、ANGPTL3、PCSK96)など)を標的としたRNA干渉(RNAi)もしくはアンチセンス核酸であり、ターゲット分子は低分子医薬品とは異なるが、抗体医薬品とは概ね共通している(表3)。他にもB型肝炎など、肝臓に関連した疾患が上位に見られるが、これは核酸医薬品(アンチセンス核酸)が肝臓に到達しやすいという薬剤送達上の性質7)が影響していると考えられる。遺伝子治療では、眼科関連の疾患が多いが、これは局所投与することで薬物送達性や全身性の副作用リスクを軽減できること、投与量も全身投与に比較して少量で済むなど遺伝子治療のターゲットとして適していることが挙げられる。細胞治療ではCOVID-19の開発品が多いが、コロナウイルスそのものをターゲットとしたものではなく、サイトカインストームに対する免疫抑制作用を期待した間葉系幹細胞(MSC)の活用が中心である(表4)。
4 まとめと考察
本稿では現在開発中のパイプラインについて、創薬モダリティと適応症に着目して調査した。
いずれのモダリティでもがん領域が最も多かったが、その理由としては、アンメットメディカルニーズが大きいことに加え、固形がんや血液がんなど領域自体の幅が広い、上市品からの効能追加の余地が他の疾患領域に比べて大きい、新たな標的分子の発見などが考えられる。
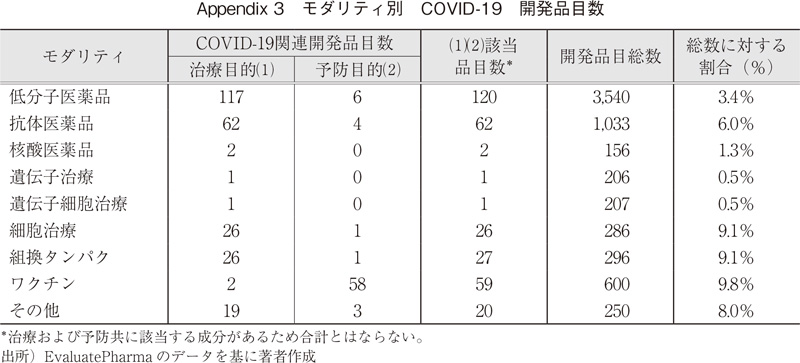
現在の医薬品の市場全体で見ると、抗体医薬品をはじめとするバイオ医薬品の割合が増加しているが、疾患領域によって、開発パイプラインのモダリティは異なる。低分子医薬品や抗体医薬品など従来のモダリティではアプローチが困難な、アンメットニーズの高い難治性のがんや遺伝性疾患、組織再生などの領域では新規モダリティの活用比率が高い。また、COVID-19を対象とした開発品も多く、例えば細胞治療では、286品目中26品目(9.1%)、抗体薬品では1,033品目中62品目(6.0%)が相当する8)。このように新型コロナウイルスのパンデミックが医薬品開発にも大きな影響を与えていることがわかる。
低分子医薬品と抗体医薬品では、既承認品目の適応疾患領域についても調査した。既承認品目では、がん領域の割合が開発品に比べると低く、また低分子医薬品で感染症領域の割合が高いなどの違いが見られた。
上市品と開発品の適応疾患領域の変化は、新たな治療薬が上市されたことによるアンメットメディカルニーズの変化、特定の領域における創薬ターゲットの枯渇、また抗菌薬の領域では事業予見性の課題がある9)など、複数の要因が考えられる。一方、新規モダリティでは、技術的に解決されていない課題も多く、患者一人当たりの開発・製造費用が高額となる傾向があり、それ故にターゲットにできる疾患が限られていることも想像できる。今後、このような課題が解決されることで、各モダリティの適応疾患が新たな領域に広がっていくことを期待したい。
おわり
-
1)腫瘍溶解性ウイルスは遺伝子治療に含める場合もあるが、本稿では適応疾患をより明確に分析するために個別のモダリティとして扱った。
-
2)EvaluatePharmaの区分に基づく。New Chemical Entity(NCE)およびBiologics License Applications(BLA)を含む。
-
3)Evaluateでは、他にBioengineered vaccine、Protein extract、Plasma-derived therapy、Recombinant productなどの分類があるが、本調査では分析の対象としていない。
-
4)CAR-T療法やTCR療法など、患者から取り出した細胞をex-vivoで遺伝子修飾を行い、再度患者に投与するもの。
-
5)間葉系幹細胞や細胞シートなど、遺伝子改変をしていない細胞を用いた治療。
-
6)ApoC3(アポリポ蛋白 C3)、PCSK9(Proprotein convertase subtilisin/kexin type 9)、ANGPTL3(Angiopoietin-Like Protein)
-
7)井上貴雄「核酸医薬品の開発動向と規制整備の現状」 PHARM TECH JAPAN Vol.35 No.13 2019 p.7-11
-
8)表1のモダリティ合計および2のCOVID-19該当数より算出。モダリティ別のCOIVD-19の開発品目数はAppendix3を参照のこと。
-
9)舘田一博「抗菌薬開発停滞の打破へ向けて」日本内科学会雑誌 Vol.102 No.11 2013 p.2908-2914

