Points of View HTA機関における意思決定要因の解析
東京大学大学院薬学系研究科医薬政策学 研究員 廣實万里子
医薬産業政策研究所 主任研究員 中野 陽介
東京大学大学院薬学系研究科医薬政策学 客員准教授
横浜市立大学医学群健康社会医学ユニット 准教授
五十嵐 中
1.はじめに
費用対効果評価の政策応用、いわゆる狭義のHTA(Health Technology Assessment)は、限られた予算を様々な医療サービスに適切に配分するための優先順位付けを目的に世界の各国において実施されている。多くの国(例えば、英国、北欧諸国、オーストラリア、スウェーデン、韓国、タイ)では医療技術の給付の可否の判断にHTAを用いており、HTA機関の判断は、その国の医療プログラムの選択肢に大きく影響する。給付の可否の判断にHTAを用いる以上、薬事申請で認可されたが、HTA機関の判断により非給付となるケースが生まれるのは必然である。反面、「HTA機関の判断で非給付とされる」ことは、「費用対効果が悪いために非給付とされる」こととは必ずしも同義ではない。どのような判断基準によって「非給付」の決定が下されたのかを検証することは、広く医薬品の価値を吟味していく際の参考になる。そこで本稿では、HTAを医薬品の給付の可否に用いている国において、非給付の理由についても比較的詳細な情報公開をしている機関としてオーストラリアPBACに着目し、HTA機関における医薬品の給付可否に関する分析を行い、そこから得られた知見をまとめた。
2.オーストラリアにおけるHTA機関PBAC
オーストラリアの公的医療制度は税金ベースで運営されている。
処方せん医薬品は、まず保健省内にあるTherapeutics Goods Administration(TGA)という組織において承認を受けた後、Australian Register of Therapeutic Goodsに登録されることで使用が可能になる。その後、公的医療制度であるPharmaceutical Benefits Scheme(PBS)への収載を申請する。
HTA機関であるPharmaceutical Benefits Advisory Committee(PBAC)は保健省(Department of Health and Ageing)内の組織であり、処方せん医薬品について企業から提出されたデータを年3回レビューし、PBS収載・すなわち保険償還の可否を決定する。1993年以降、PBSでの給付を希望する際には費用対効果のデータの添付が必須となっている。なお、病院内でのみ用いられる医薬品は、入院治療をカバーする制度が州政府管轄となるため、連邦管轄のPBACの範疇外となる。PBACのレビューの結果として非給付と判断された際には、その判断理由が提示され再度企業は新たなデータをPBACに提出し、再レビューの機会を得ることが出来る。
3.PBACにおける非給付判断とその理由
PBSのウェブサイトで、医薬品ごとのPublic summary documentの結果が公開されている1)。この公開資料をもとに、PBACの評価結果とその内容を分析した。2008年から2019年までの期間に評価された1,485件の評価結果が対象となった。英国NICEと同様、同じ医薬品であっても複数の適応がある場合には、適応症ごとにデータを提出し、収載の可否が判断される。そのため、ある医薬品においてひとつのレビューで非給付と決定されても、他の適応では給付が認められるケースや、いったん非給付とされた適応について再申請を行い、最終的に給付が認められた例も多く存在する。
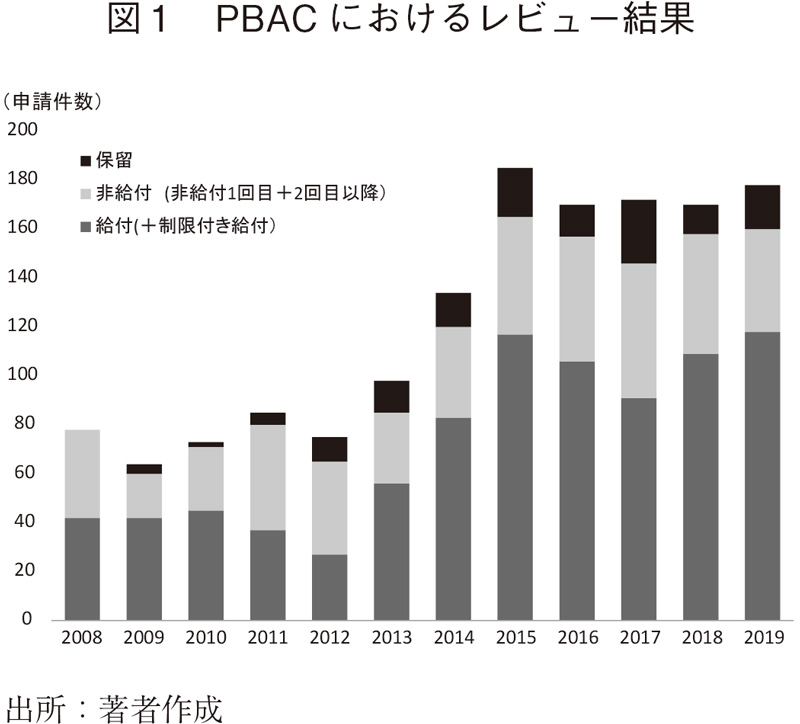
図1には、PBACにおけるレビューの結果を示す。結果は、給付、非給付、保留があり、給付の割合は各年異なるものの最近5年間でみると62%程度であり、申請された約4割のレビューにおいて非給付という判断が下されている。あわせて、非給付とされたレビューに着目し、どのような要因が非給付という判断につながったかを検証した。PBACにて公開されているレビューには、非給付と判断した理由が記載されている。この記載内容から、非給付になった理由を"有効性"、"比較対照薬"、"安全性"、"価格"、"費用対効果の不確実性(変動幅が大きい)"、"費用対効果が悪い(増分費用効果比ICER値が大きい)"の問題に分類し、要因分析を行った。申請書によっては、複数の項目が指摘されることで非給付と判断されているケースも多く存在した。又、"価格"に関する指摘は、既存薬と比較して高すぎる、治療に必要な付加的費用の組み入れ可否に対する批判等があり、価格単独に対する言及を対象とした。本分析では、1,485件の申請件数のレビュー内容を確認し、そのうち非給付と判断された474件について更なる解析をおこなった。
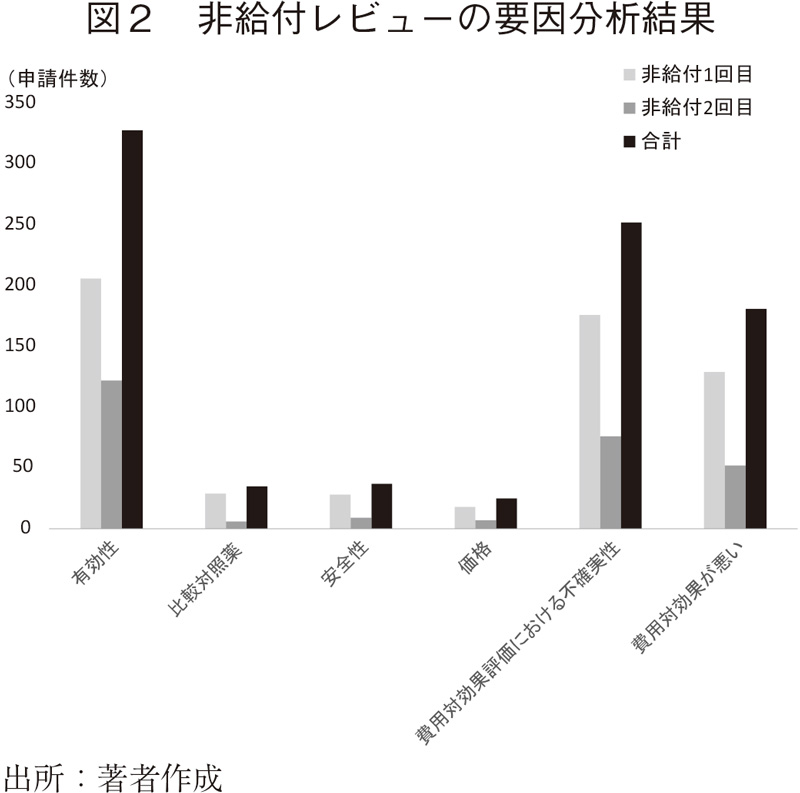
結果を図2に示す。非給付となった理由として多くみられたのは、相対的"有効性"の問題と"費用対効果評価の不確実性"であった。すなわち、「費用対効果が悪い」こと以外の要素も、PBACにおける非給付の判断に大きく寄与していることが明らかになった。
"有効性"に関する指摘の多くが、既存薬を比較対照とした臨床データの不足を問題視していた。HTAのプロセスにおいて、対照薬の効果と費用のデータを用いICER(増分費用効果比)を算出するが、治験時はプラセボとの比較データで解析されている、重篤な疾患においてはシングルアームでの臨床試験が実施されることから、データ不足が指摘されるケースが多く存在した。
一方で費用対効果の不確実性に関する指摘(変動幅が大きいことの指摘)では、対象となる患者集団における臨床的有用性を示すデータの不確実性(アウトカムデータやデータソースの選択基準の問題)、解析法に関する不確実性(どの分析モデルを用いるかなど)が主に指摘されていた。
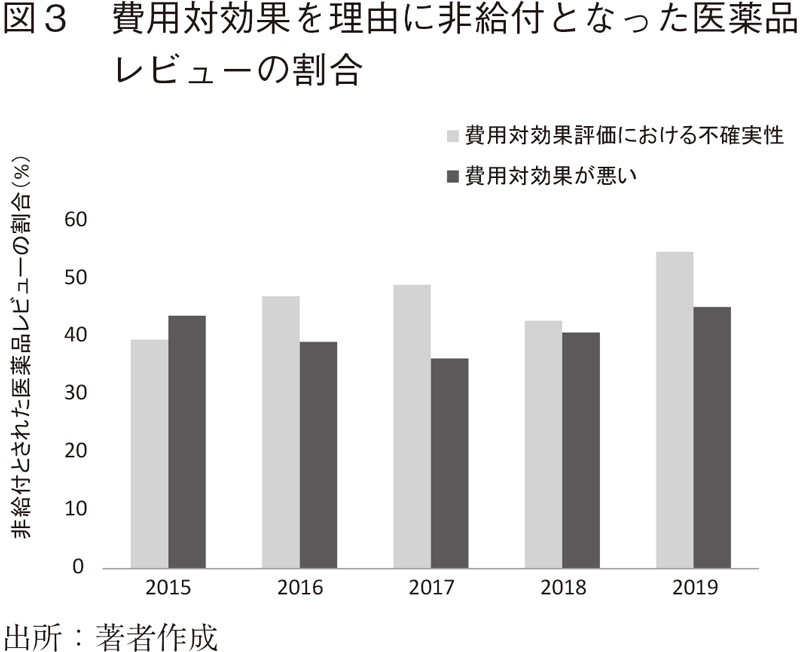
後者の不確実性の問題は、過去5年間のデータを見た場合、一貫して40%を超える割合を占め、近年では「費用対効果が悪い」を上回っている(図3)。
以上の結果から、HTA機関において非給付と判断された医薬品は、費用対効果が悪いという結果のみならず上記に挙げたようなそれ以外の理由も影響していることが明らかになった。
4.相対的有効性、不確実性への対応と示唆
近年、医薬品の対象疾患がより細分化され、バイオマーカーなどにより選択された癌や、希少疾患の治療薬が増えていることから、今後HTAにて相対的有効性や不確実性の指摘を受けることは多くなることが予想される。これらの医薬品の臨床試験は、患者数が少ないことから、シングルアームで実施されることや、Active comparatorなしのプラセボ対照で行われることが多い。薬事承認が絶対的有用性、すなわち無治療やプラセボと比較した有効性と安全性の観点から行われた場合でも、給付の可否につながる費用対効果評価の場面では、相対的(追加的)有用性のデータの不足等により有効性やそれに伴う不確実性の問題が指摘される。
上記課題についてどのような議論がされているかを紹介する。まず、臨床試験の評価機関とHTA機関(オーストラリアの場合TGAとPBACに相当)の判断や評価軸のギャップの存在は、複数の国で指摘されており、両機関の連携等が課題として挙げられている2)、3。また、早期の段階からHTAの不確実性を低減させるような臨床試験のデザイン、分析法を、関連するステークホルダーとの対話を通じて検討していくことが今後求められる。さらに償還時にManaged entry agreementにより上市後の医薬品のリアルワールドエビデンスを用いた再解析やValue-based contractの実施、英国のCancer Drugs Fundsのように、追加的なデータを取得する間は臨時予算によって暫定的に給付する手法は、アクセス遅延の問題を回避しつつ不確実性を最小化する取り組みといえ、近年このような特別措置が取られるケースも増加している。個別化医療にシフトしている世界において、償還の対応も多様化しており、国際的な見解では、単一的な方法をとるのは難しいと議論されている4)-6。
日本においても、医療費の高騰が問題視される中で各治療の価値をどのように判断するかという議論が必然的に起きている。一部の医薬品に対して、価格調整を目的に費用対効果評価が実施されているが、今後も多様化していく治療法に対して、不確実性を含めてどのように評価していくかという課題は、より重要になることを意識していきたい。さらに、医薬品の多面的な価値を評価していく際にも比較対照薬や解析手法に関する課題が想定されるため、医薬品のタイプに応じて検討していく必要がある。
-
1)
-
2)Health Policy. 2016 Oct;120 (10):1104-1114. doi: 10.1016/j.healthpol.2016.08.006. Epub 2016 Aug 31.
-
3)Clin Pharmacol Ther. 2020 Aug;108 (2):350-357. doi: 10.1002/cpt.1835. Epub 2020 Apr 20.
-
4)BMJ. 2020 Jan 2;368:l6435. doi: 10.1136/bmj.l6435.
-
5)BMC Health Serv Res. 2018 May 31;18 (1):393. doi: 10.1186/s12913-018-3162-2.
-
6)Orphanet J Rare Dis. 2015 May 3;10:53. doi: 10.1186/s13023-015-0269-y.

