Topics 新薬の比較薬に対する価格プレミアム:日米欧のマッチト・サンプルによる分析
医薬産業政策研究所 客員研究員、学習院大学教授 西村淳一
医薬産業政策研究所 所長、東京経済大学教授 長岡貞男
創薬イノベーションへのインセンティブにおいて、薬価制度は中核的な役割を果たす。革新性が高い新薬は、既存の比較薬に対する価格差が大きく、より高い収益が得られると予想され、その結果、革新的な医薬品を生み出す不確実でコストの高い研究開発への取り組みが促される。新薬の比較薬に対する価格プレミアムの国際的比較研究は、新薬の既存比較薬に対する付加価値を各国の薬価制度でどの程度評価しているかについて具体的エビデンスを提供し、創薬イノベーションを促進する政策制度を分析する観点からも重要なデータである。しかし、これによる国際的比較研究はほとんど例が無い2)。
例外として、Comanor他(2018)の先行研究は、NICE(National Institute for Health and Care Excellence)による医薬品の費用対効果と公的調達機関が価格決定に大きな役割を果たしている英国と、医薬品の効果の評価と価格交渉が民間機関に委ねられている米国における新薬の既存比較薬に対する価格プレミアム(新薬の比較薬に対する価格上昇率)を比較し、米英の間では価格プレミアムは平均的にみてほぼ等しく、英国の政府機関による費用対効果に依る規制価格が米国の市場原理による価格決定と大きく異なる結果をもたらしていないと結論づけている3)。
本稿では、Comanor他(2018)の研究を、以下の三つの点で拡張する。第一に、米国を基準国として、日本、独、英、仏の4ヶ国をほぼ同じデータセットで比較することで、米国市場における新薬の価格プレミアムを、日欧各国の新薬の価格プレミアムがどの程度反映しているかを計測する。補論1に示すように、これによって各国市場で、新薬の既存薬に対する医療上の効果が、新薬の価格上昇率に、米国と比較してどの程度反映されているかを知ることができる。ただし、薬価の上昇額は、このような価格上昇率の他に、価格水準自体を決める要因(支払意思額等)にも依存することに留意する必要がある。
第二に、Comanor他(2018)では、各国における新薬の評価(薬価)がもっぱら費用対効果を反映していると仮定されているが、日本及び欧州では、海外との新薬価格差も、直接あるいは間接に重要な要因となっている可能性があり、その影響を分析に取り入れる4)。補論1に示すように、比較薬における基準国(米国)と当該国の価格差(対数での差)を、説明変数として追加すれば、その係数の推定値が各国におけるこの要因の重要性を示す。本稿では、このようにして、新薬の価格プレミアム決定における、米国との新薬の価格水準の差の影響も分析する。
第三に、上市時点のみではなく、その後の動態を把握するパネル・データの平均値で比較分析する。価格の動態は各国で大きく異なり、初期価格の分析のみでは、イノベーションへのインセンティブの不十分な分析となってしまう可能性がある。
データの構築
本稿では様々なデータソースを用いて分析データセットの構築を行った5)。構築手順は以下の通りである。まず、我々がIQVIA社からライセンスしている『Pricing Insights』には、日米独英仏の5か国2010年7月~2019年3月における上市医薬品について月次レベルで価格情報がある(ただし、日本については価格情報が2010年は欠損値)。『Pricing Insights』には流通の各段階での価格情報が収載されているが、本稿では、各国における実勢価格に最も近いと想定される薬局購入価格(PPP)を用いて分析している6)。この基本データベースから、一般成分名、国際商品名、剤形及び強度の全てを共通とする医薬品単位で各国の価格情報をマッチングし、各国における四半期ベースで価格データを単純平均したデータベースを作成した。この価格データについて、OECDより2015年時点における各国GDPデフレーターと購買力平価の情報を入手し、2015年価格で実質化し、購買力平価で換算したドルベースの価格データを作成した。次に、IQVIA World Review Analyst 2018の売上上位300の医薬品リストと日本の中医協の薬価算定情報より特定した、その上位医薬品と対応する比較薬のリストを作成し、『Pricing Insights』より構築したデータベースと接続作業を行った。
最終的に、日本で上市され、比較薬価ベースで新薬の薬価が決定され、かつ米国及び欧州(独、英、仏)3ヶ国のいずれかでも上市されている医薬品69成分(類似薬効比較方式で算定された新薬69成分それぞれに対応する比較薬のデータ)を抽出した。加えて、これらの分析対象となる医薬品は一般成分名、国際商品名、剤形及び強度全てにおいて各国共通の薬剤が存在することも条件となっている。この中で、観測期間中に初期価格が存在する医薬品は約30である。
さらに、新薬と既存比較薬との、治療単位での価格比を計算するために、本稿では中医協の薬価算定資料から各医薬品の一日薬価の情報を用いて、各国における新薬の比較薬に対する価格プレミアム(価格比の対数値、新薬の比較薬に対する価格上昇率)を測定した7)。
分析の基本モデル
Comanor他(2018)では、英国と米国それぞれにおいて、標準治療単位での新薬と既存比較薬との(新薬の)上市時点の価格比(UK ratioとUS ratio)を計算し、その対数値をとることで、単純なクロスセクション回帰分析を行っている。本稿でも同様に、一日処方量で換算した一日薬価で計算される新薬の価格プレミアムを以下の通りに定義した。
新薬の価格プレミアム=ln(新薬の一日薬価)-ln(比較薬の一日薬価)
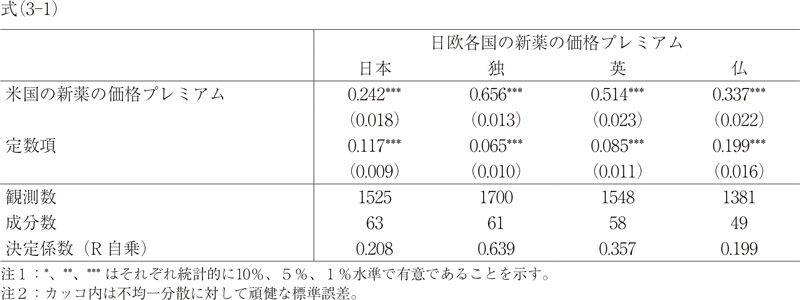
本稿では、Comanor他(2018)の回帰分析と同じく、以下のモデル式(1)の推定をまず行った8)。
日欧各国の新薬の価格プレミアム i=定数項+β/β*(米国の新薬の価格プレミアム i)+εi (1)
ここで i は医薬品成分、β/β*は推定パラメータである。ここで関心のある係数値はβ/β*の値であり、これは補論1に示すように、米国と比較して日欧各国において、新薬の健康上の効果が高いことが、その薬価の上昇率にどの程度反映されるかを示している。この数値が1と等しい場合は、その反映されている程度が米国と同等であることを意味する。1を上回る場合は、米国よりも反映していることを意味し、1を下回る場合は、米国よりも反映していないことを意味する。なお、(1)式はComanor他(2018)と同様にクロスセクション・データによる推定で、本稿では、各国における新薬の上市時点の薬価を用いて、比較分析のため日欧4か国にサンプルを分割して、それぞれ推定した。
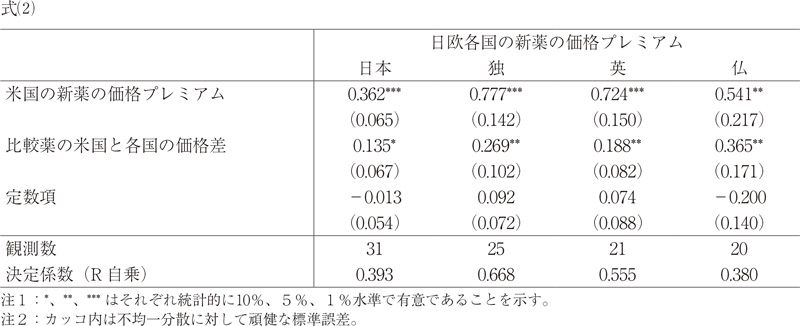
新薬の価格決定においては、新薬の比較薬に対する相対的な費用対効果のみではなく、外国平均価格調整や参照価格制度のように、海外との新薬価格差も影響すると考えられる。そこで、本稿では(1)式に、この要素を加えた以下のモデル式(2)の推定を行った。
日欧各国の新薬の価格プレミアム i =定数項+A(米国の新薬の価格プレミアム)i +(1-θ)ln(米国の比較薬の一日薬価/日欧各国の比較薬の一日薬価) i -4+ε i (2)
補論1に示すように、比較薬における米国と日欧各国の価格差(対数)を、説明変数として追加すれば、その係数の推定値(1-θ)が各国における米国との価格差の重要性(日本の場合は外国平均価格調整の利用確率)を示すことになり、新薬の価格プレミアム決定における外国平均価格調整等の影響の有意性も分析することができる。また、(2)式のAは米国の新薬の価格プレミアムの係数値であり、これはθβ/β*+(1-θ)に等しい。よって、(1-θ)の係数値を得ることで、モデル式(2)におけるβ/β*の値を計算して求めることができる。(2)式では日欧各国の比較薬の一日薬価が左辺と右辺の第二項に入っており、潜在的な同時性の問題を避けるため、右辺では1年前の比較薬の一日薬価比の対数を利用している9)。
Comanor他(2018)の分析データは上市時点のみのクロスセクション・データであったが、本稿では医薬品69成分に関して2010年7月~2019年3月までの四半期パネル・データを用いて、価格プレミアムの動態を分析する。各国でこの動態は異なり、この分析は重要だと考えられる。例えば、米国の場合、新薬の戦略的な価格設定として、浸透価格戦略を行うケースもあり、市場に普及するにしたがって、徐々に新薬の価値が認識され、薬価が上昇していく。このような新薬の価値に対する評価の高まりを反映する仕組みは、日本には無く、欧州でも限定的である。
パネル・データで推定するモデル式は以下である。
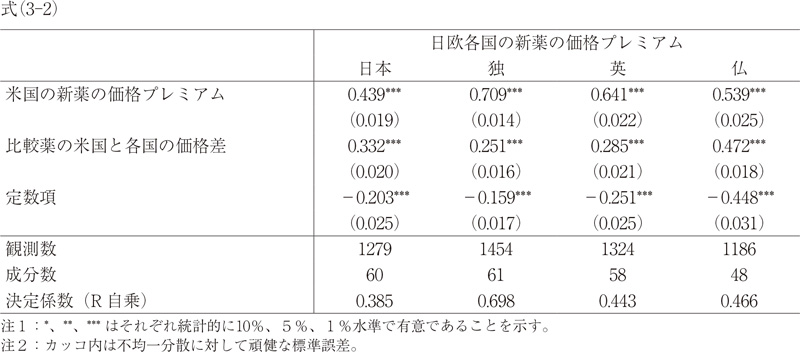
日欧各国の新薬の価格プレミアム it=定数項+β/β*(米国の新薬の価格プレミアム)it+εit (3-1)
日欧各国の新薬の価格プレミアム it=定数項+A(米国の新薬の価格プレミアム)it+(1-θ)ln(米国の比較薬の一日薬価/日欧各国の比較薬の一日薬価)it-4+εit (3-2)
式(3-1)は式(1)に、式(3-2)は式(2)に対応し、初期値ではなく、パネル・データの平均値で、同じモデルを推計した結果を示し、頑健チェックとも言える。いずれもパネル・データより推定されるが、本稿では固定効果推定は行っていない。新薬の価格プレミアムは新薬と比較薬との価格比より計算されるものであり、新薬と比較薬で共通する固有効果(例えば、適応症や薬理作用、対象疾患の需要や競争の状況等)は既に除去されている。
推定結果と分析
先のモデル式(1)~(3)にしたがって、最小二乗法による推定を行った。主に関心がある係数値の推定結果をまとめたのが以下の表である10)。詳細は補論2に示しているが、推定された係数値はいずれも統計的に強く有意であった。
まず、式(1)の推定結果についてみると、米国における新薬の価格プレミアムの係数β/β*については、日欧4か国いずれも1より低い係数値となっていた11)。この結果から、日欧各国は新薬の比較薬に対する健康上の効果(=比較薬の効果と比較した改善率)を、その薬価の上昇率に、米国ほど反映していないことを示す。さらに、β/β*の係数値については、式(1)~(3)のいずれをみても、独、英、仏、日本の順で大きく、日本は欧米と比較して、新薬の健康上の効果をその薬価の上昇率に反映していないことがわかる。米国で30%の新薬価格プレミアムがある場合、日本では9%、独では23%、英国では20%の価格プレミアムがある。
次に、決定係数であるR自乗も記しているが、式(1)が示すように、米国の価格評価の変動は共通であり、当該国でβ/β*の係数値が大きいほど、また、新薬の付加効果の価格評価における当該国のバラツキが小さいほど、この値は大きい。日本と仏では、独や英と比較して、R自乗が小さくなっていることは、β/β*の係数値が小さいことと価格評価のバラツキが大きいことの二つの潜在的な原因があるが、表1に示すように、日本ではもっぱら最初の要因が重要であり、仏では二つとも重要である。すなわち、仏では日本よりβ/β*が大きいが、日本よりもR自乗は小さくなっており、これは仏の方が価格評価のバラツキが大きいからである。
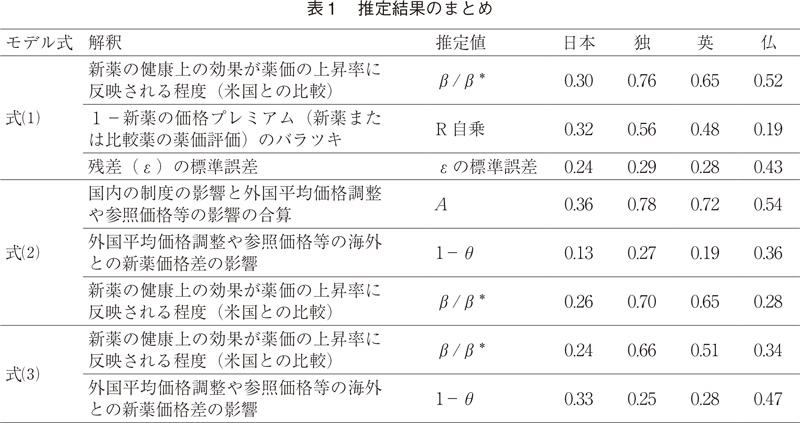
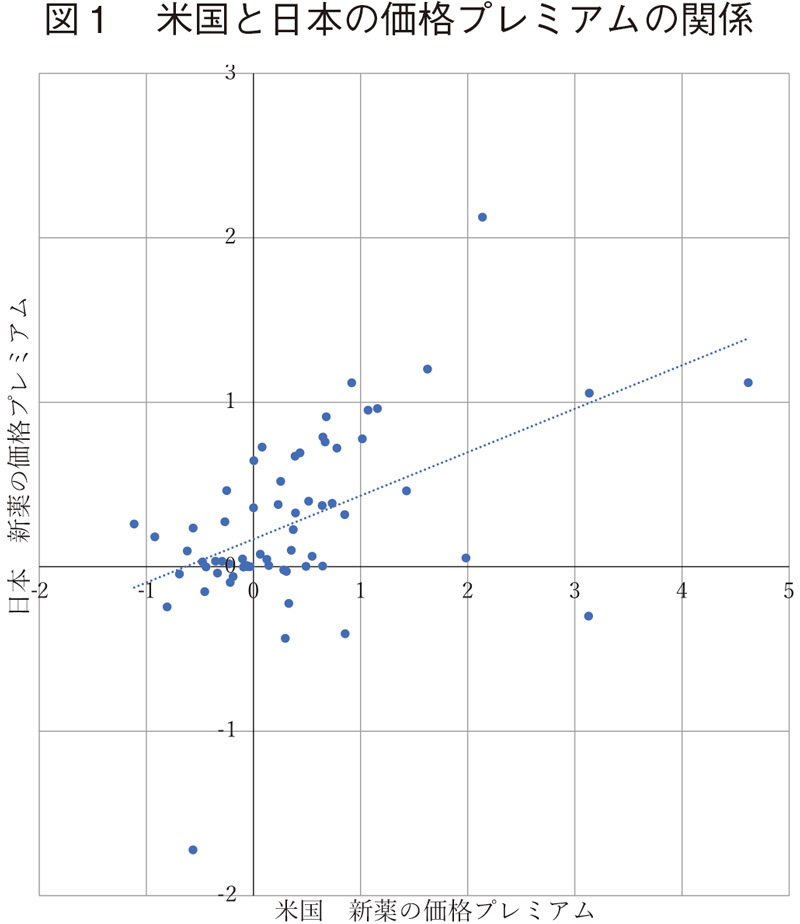
以上の結果は、図1と図2からもわかる。図1は横軸に米国の価格プレミアムを、縦軸に日本の価格プレミアムをとり、2019年1~3月時点の数値で散布図を描いたものである。同様に、図2は横軸に米国の価格プレミアムを、縦軸に独の価格プレミアムをとったものである。推定されたβ/β*の係数値から予測されるように、独の方が日本の場合と比べて傾向線(点線)の傾きが急であり、45度線に近い。日本の傾向線の傾きが小さい一つの原因は図1が示しているように、原点を通る水平線上あるいはその近傍にかなりの数の医薬品が分布しているからである。他方、傾向線からのバラツキは、日と独はほぼ同じ程度である。
次に、式(2)の結果から、比較薬における米国と日欧各国の価格差(対数)の係数(1-θ)の推定値が得られている。この係数値は、各国において米国との価格差が価格プレミアムの決定における重要性(日本においては外国平均価格調整が利用される確率)を示しており、新薬の価格プレミアム決定における同制度等の影響をみることができる。例えば、日本の場合、(2)式の推定では、係数値は0.13となっており、(2)式の推定に用いた31成分のうち、13%が外国平均価格調整を受けたことを示唆している。実際に、31成分のうち、どの程度外国平均価格調整を受けたかを調べると、19%であり、近い値である。式(3)ではパネル・データで同様に(1-θ)の係数値を得ているが、この場合、日本では理論値で33%となっており、実際に外国平均価格調整を受けた成分を調べると32%と非常に近い結果となっていた。これらの日本の推定結果は、(3-2)式によって、米国価格との差の影響度を推定できることを証明する結果となっている。
この係数は、日欧各国とも正で有意となっている。大変興味深いことに、英国でも(1-θ)は有意になっており、0.19と日本より高い数値を示している。英国では正式な参照価格制度は無いが、米国価格の水準が間接的にその薬価プレミアムに反映されていることを示唆している。また、新薬の評価(薬価)がもっぱら費用対効果を反映して行われていることを仮定して推定を行ったComanor他(2018)の研究に重要な歪みがあることも示唆している。次に、(1-θ)の係数値からθを求め、米国における新薬の価格プレミアムの係数β/β*を計算した。結果は先に述べたように、日欧4か国いずれも1より低い係数値となっており、独、英、仏、日本の順で大きい数値となっている。各国で式(1)の推定式から得られた値に近いが、より小さい。(1)式ではβ/β*は過大に評価される傾向がある。
最後に、パネル・データを用いた式(3)の結果の中で、表に示しているβ/β*は式(3-1)の係数値である。これは、パネル・データであり、推定に用いた対象医薬品成分が増加しており、上市時点も異なるため、式(1)のβ/β*とは数値が異なるが、傾向は同じである。これまでと同様に、日欧4か国いずれも1より有意に低い係数値となっており、独、英、仏、日本の順で大きい数値となっていた。ただし、いずれの国でも、米国の新薬の価格プレミアムの係数は小さくなる傾向があり、新薬プレミアムが米国と比較して日欧では新薬のライフサイクル経過によって低下する傾向があることを示唆している。日本では、今回分析対象となっている医薬品成分のほとんど(69成分中67成分)は新薬創出加算による加算対象となっており、新薬の価格は上市後も維持されている傾向があると予想されるが、米国と比較して価格プレミアムは低下している。
また、(1-θ)の係数値は式(3-2)より得られた数値であるが、先に述べたように、日本において外国平均価格調整の影響を良く反映しており、実績と推定値の整合性が高い。欧州各国については、式(2)による初期価格による推定値と、式(3-2)によるパネル・データによる推定値と比較的に近く、有意であり、パネル・データで見ても、結果的に欧州各国において米国の価格プレミアムに加えて、米国における価格水準自体も影響を与えていることが示唆される。
結語
本稿では、新薬の既存比較薬に対する付加価値を、日欧各国の薬価制度が米国と比較してどの程度評価しているかを、新薬の比較薬に対する価格プレミアムのデータを構築して分析した。Comonar他(2018)の研究を主に3つの点で拡張した。主要な知見と示唆は以下の通りである。
第一に、米国の新薬価格プレミアムは日独英仏の新薬価格プレミアムを有意に予測しているが、その程度は各国とも有意に1より小さい。米国の価格プレミアム(対数)を横軸、当該国の価格プレミアム(対数)を縦軸とした傾向線の係数の大きさは、独、英、仏、日本の順で大きく、日本は欧米と比較して、新薬の健康上の効果をその薬価の上昇率に反映する程度が小さいことが示唆される。同時に、日本と仏では独や英と比較して、新薬プレミアムの変動を米国の新薬プレミアムの変動で説明できる程度が小さいが、日本では傾向線の傾きが小さいことが主因であるのに対して、仏ではそれに加えて国内の価格プレミアムのバラツキの程度が大きいことも重要な原因である。
第二に、各国の価格プレミアムには、米国の価格プレミアムをコントロールしても、米国における比較薬薬価の日欧各国の薬価に対する水準が有意に影響を与えている。その係数の推定値は、日本の場合、外国平均価格調整の利用頻度と非常に近い結果となっており、このような推定によって、各国の薬価形成における外国価格の影響を評価できることを示唆している。この係数は、日欧各国において、正で有意となっており、興味深いことに、正式な参照価格制度が無い英国でも有意になっており、英国でも、米国価格が間接的に反映されていることを示唆している。したがって、新薬の評価(薬価)がもっぱら費用対効果を反映していることを根拠に推定を行ったComanor他(2018)の研究には重要な歪みがあることも示唆している。
最後に、初期価格ではなくパネル・データで推定しても、上記とほぼ同じ結果が得られた。ただし、日欧各国で、米国の新薬価格プレミアムの係数は小さくなる傾向があり、米国と比較して新薬プレミアムが日欧では新薬のライフサイクル経過によって低下する傾向があることを示唆している。
これらの結果は、日独英仏各国の規制価格が、米国の市場原理による価格決定と有意に類似はしているものの、同時にかなり異なる結果をもたらしていることを示唆している。また、各国で既存比較薬に対する付加価値だけではなく、米国との価格差も有意な影響が検出され、それが新薬の価格プレミアムについて日欧と米国を接近させる一つの要因となっていることも重要な発見であった。
今後の研究課題は多い。第1に、我々は米国の薬価をベンチマークとした。市場原理に基づく価格決定は、競争を反映し、製品の革新性を反映した効率的な価格設定となると考えられるからである。しかし、有効な競争が必ずしも機能していない場合も考えられ、米国における新薬の価格プレミアムが十分に医薬品の革新性を反映したものであるかについても検証をしていく必要がある。第2に、Comanor他(2018)による米英の30医薬品成分を用いて上市時価格の分析を行った結果では、傾きはほぼ1であり、我々の結果と大きく異なっており、その原因の分析が重要である(彼らの研究では価格比が100を超えている場合があり、これらが推定結果を決めている可能性がある)。
補論1 価格の推定モデル
新薬 iとその既存比較薬の健康上の効果は、同じ基準で測定され、それぞれqiとq0, iだとする。これらは、薬を投与しない場合と比較したQALY(Quality Adjusted Life Years)の改善度合いと考えてもよい。比較薬の薬価は、その国の健康改善への支払い意欲wに比例し、また当該疾患特有の事情(治療に対する需要等)αi、及び当該医薬品の効果を反映して以下のように決定されるとする。
p0, i=wαi (q0, i)β (1.1)
ここでβ≥0であり、もしβ=1、αi=1であれば、比較薬の薬価は、その健康上の効果に等しく比例的に設定されるということになり、β=0なら価格は健康上の効果を反映しない。新薬も比較薬と同じフォーミュラ(方程式)を利用し、同時にその効果の高さを反映して決定されるとすると、
pi=wαi (qi)β (1.2)
(1.1)と(1.2)式の両辺に対数をとって新薬と比較薬の差分をとると、新薬の価格プレミアム(比較薬に対する価格上昇率)は、この場合
premiumi=lnpi-lnp0, i=β(lnqi-lnq0, i) (2)
となる。基準国(米国)でも同じように薬価が決定されているとすると
premiumi*=lnpi*-lnp0, i*=β*(lnqi-lnq0, i) (3)
となり、この場合、国内の価格プレミアムと基準国の価格プレミアムとの関係は
lnpi-lnp0, i=β/β*(lnpi*-lnp0, i*) (4)
となる。
(4)式(本文のモデル式(1)に対応)を推定することによって、ある国が基準国と比較して、新薬の健康上の効果が高いこと(qiが大きいこと)が、その薬価の上昇率にどの程度反映されているかを知ることができる。ただし、新薬の薬価と比較薬の薬価の差は、以下に示すように、薬価の水準自体を決める要因wαiとの大きさとの積で決まり、(4)式にはこれは反映されていないことに留意する必要がある。
pi-p0, i=wαi{(qi)β-(q0, i)β}=p0, i{(qi/q0, i)β-1} (5)
何らかの理由で新薬や比較薬も全般に薬価が低い場合でも(αiがどの疾患でも小さい)、βは大きいことも十分ありうる。
新薬の薬価が比較薬との比較ではなく、日本の外国平均価格調整のように、海外の薬価を参照して決められている場合、
pi=γpi*、0 < γ ≤ 1 (6)
となる。ここでγは一定値だとする(日本の外国平均価格調整の場合、pi*が非常に高いと、当該国は価格調整において除外されるため、低くなる内生性があり、これは以下の推定式では、外国平均価格調整の影響を小さくする傾向にある)。これを新薬の価格プレミアムを左辺にするように書き直すと、
lnpi-lnp0, i=(lnpi*-lnp0, i*)+(lnp0, i*-lnp0, i)+lnγ (7)
となる。すなわち、外国平均価格調整の場合、基準国での価格プレミアムがフルに反映され、また基準国と比べた比較薬の薬価差も解消されるように、薬価が決定されると理解して良い。欧州では、外国平均価格調整は考慮事項の一つであり、新薬の価格プレミアムは(4)式と(7)式のハイブリッドで決定されており、それぞれのウエイトをθと1-θとすると、
lnpi-lnp0, i=(θβ/β*+(1-θ))(lnpi*-lnp0, i*)+(1-θ)(lnp0, i*-lnp0, i)+(1-θ)lnγ (8)
(8)式は一般化した推定式であり、推定された基準国と比べた比較薬の薬価差の係数値(1-θ)が基準国の薬価が参照される程度を示す。また、その係数値を用いて、新薬の価格プレミアムが当該国に反映される程度を、国内の制度の影響(θβ/β*)と外国平均価格調整(海外との価格差)の影響(1-θ)に分けて分析することができる。
-
1)本稿の研究には医薬産業政策研究所の研究員各位から有益なコメントを頂いたことに感謝申し上げたい。本研究は、佐藤一平氏との共同研究(医薬産業政策研究所リサーチペーパーNo.74「日米欧における薬価の構造とダイナミクス:革新性の反映」)で構築したデータを更に発展させたものである。科研費基盤B(「創薬イノベーションとインセンティブの研究」、18H00854)の支援を受けて実施した。
-
2)医薬産業政策研究所リサーチペーパーNo.74「日米欧における薬価の構造とダイナミクス:革新性の反映」において、米国薬価を基準とした薬価水準の国際比較分析を行っている。しかし、新薬と比較薬との価格比である価格プレミアムを考慮した分析は行っていない。
-
3)Comanor他(2018)は米英30医薬品成分の上市時の初期価格プレミアムに限定した分析で、その主要な結果は以下の推定結果である:ln(UK ratio)=0.292+0.988 ln(US ratio)。t検定の結果、US ratioの係数値=1を棄却できない。この結果は、比較薬に対する新薬の(相対的な)費用対効果の評価は米英で同等であり、NICEが存在することで市場原理による医薬品価格決定構造を大きく歪めないと解釈されている。しかし、本稿で示すように、新薬の比較薬に対する価格の上昇幅は、このような価格プレミアムに加えて、比較薬の価格水準自体にも依存することに留意する必要がある。
Comanor, W.S., Schweitzer, S.O., Riddle, J.M., Schoenberg, F. 2018. "Value based pricing of pharmaceuticals in the US and UK: Does centralized cost effectiveness analysis matter?" Review of Industrial Organization 52, 589-602. -
4)日本では外国平均価格調整が海外との新薬価格差を日本における初期薬価に反映させる役割を果たしている。独、英、仏の中で、英国では外国価格は明示的に考慮される仕組みは無いが、独、仏では外国価格は考慮される仕組みとなっている(岩井, 2018;Maini and Pammolli, 2020)。欧州で外国価格が価格に反映されるメカニズムは複数あり得る。保険償還における上限価格に、外国価格が反映されている場合、企業は外国価格を参考として申請価格を設定すると考えられる。また、英国のように、企業に価格決定の自由度がある場合も、米国の市場価格は国内での価格決定の重要な参考情報となると考えられる。
岩井一郎(2018).各国の薬価制度と日本への示唆.小黒一正・菅原琢磨(編)『薬価の経済学』日本経済新聞出版. p. 129-146.
Maini, L., Pammolli, F. 2020. "Reference pricing as a deterrent to entry: Evidence from the European pharmaceutical market" Available at SSRN: https://ssrn.com/abstract=3694471 or http://dx.doi.org/10.2139/ssrn.3694471 -
5)主に用いたデータソースは以下である。①IQVIA. Pricing Insights、②サンエイレポートの特許保護期間や再審査期間情報、③中医協の薬価算定情報から構築した医薬産業政策研究所作成の薬価情報(加算率、外国平均価格調整率等)、④OECDのGDPデフレーターと購買力平価情報、⑤IQVIA World Review Analyst 2018の売上上位医薬品情報。
-
6)『Pricing Insights』には主に以下の3つの価格情報がある。メーカー出荷価格(『Pricing Insights』における表記ではMSP:Manufacturer Selling Price)であり、製薬会社から卸への販売価格である。次に、卸販売価格あるいは薬局購入価格(PPP:Pharmacy Purchase Price)である。最後に、消費者価格あるいは税込薬局小売価格(RPP:Retail Public Price)である。『Pricing Insights』の価格情報の詳細については医薬産業政策研究所リサーチペーパーNo.74「日米欧における薬価の構造とダイナミクス:革新性の反映」を参照。米国のPPPは領収書ベースの価格を収集しているMIDASがデータ源である。
-
7)Comanor他(2018)では、新薬と比較薬のStandard Course of Treatmentから価格比を計算している。本稿では一日薬価(一日処方量)から価格比を計算しており、本稿で計算される価格比はComanor他(2018)と基本的に同じように構築されていると考えられる。
-
8)各推定モデルの理論的背景については補論1を参照。
-
9)比較薬の薬価が完全に外生変数であれば、同一時点の説明変数でも、問題は発生しない。
-
10)以下の図表では、中医協の薬価算定資料およびCopyright©2021 IQVIA. Pricing Insights およびIQVIA World Review Analyst 2018 をもとに作成(無断転載禁止)
-
11)これらの係数値が1に等しいかどうかの検定も行ったが、いずれも帰無仮説は棄却されたため、1を下回ることがわかる。

