目で見る製薬産業 日米欧の新薬承認状況と審査期間の比較 -2019年承認実績を中心に-
医薬産業政策研究所 主任研究員 吉田昌生
主任研究員 澁口朋之
医薬産業政策研究所では、日本、米国、及び欧州の医薬品の承認情報及び審査期間に関して、独立行政法人医薬品医療機器総合機構(PMDA)、U. S. Food and Drug Administration(FDA)、及びEuropean Medicines Agency(EMA)がそれぞれホームページ等で公表している情報をもとに、継続的に収集、分析している 1)。政策研ニュース第58号 2)では2018年の承認実績を中心に、日米欧の新薬承認状況と審査期間の比較を、政策研ニュース第59号 3)では2019年に日本で承認された医薬品情報に関する分析結果を報告した。今回のニュースでは、2019年に日本、米国、および欧州で承認された新薬の承認品目数、審査期間等に関して調査した。
調査方法
PMDA、FDA及びEMAのそれぞれのホームページに公表されている情報をもとに、標準的な統計解析ソフトStata/IC 14.0 for Windows(Stata Corp LP, College Station, TX, USA)を使用し、審査期間は承認申請日から承認日までの期間として算出した。
日本は、政策研ニュース第59号と同様、対象はPMDAホームページの「新医薬品の承認品目一覧」 4) に掲載されている医薬品とし、品目数は審査報告書ごとにカウントすることを基本に、同一成分の品目を複数企業が同時申請した場合や併用薬物療法にて複数成分が承認された場合は1品目として集計した。New Molecular Entity(NME)の集計は、申請区分が新有効成分含有医薬品に該当するものを対象とした。
米国は、FDA Center for Drug Evaluation Research(CDER)が承認した「CDER Drug and Biologic Approvals for Calendar Year」 5)に掲載されているNew Drug Application(NDA)及びBiologic License Application(BLA)に該当する医薬品を対象とした。NMEの集計は、「New Molecular Entity(NME) Drug & Original BLA Calendar Year Approvals」に掲載されている医薬品を対象とした。
欧州は、EMAが中央審査方式にて承認し、「European Medicines Agency Annual Reports」 6)に掲載された医薬品を対象とした。NMEの集計は、「New active substance」に分類されている医薬品を対象とした。
また、薬事上の特別措置として、日本では優先審査、迅速審査、希少疾病用医薬品、先駆け審査指定制度を、米国ではPriority Review、Accelerated Approval、Orphan、Fast Track、Breakthrough Therapyを、欧州ではAccelerated Assessment、Orphan、Conditional Approval、Exceptional Circumstances、Priority Medicine(PRIME)を対象に集計した。各薬事上の特別措置の内容は補足にまとめた。
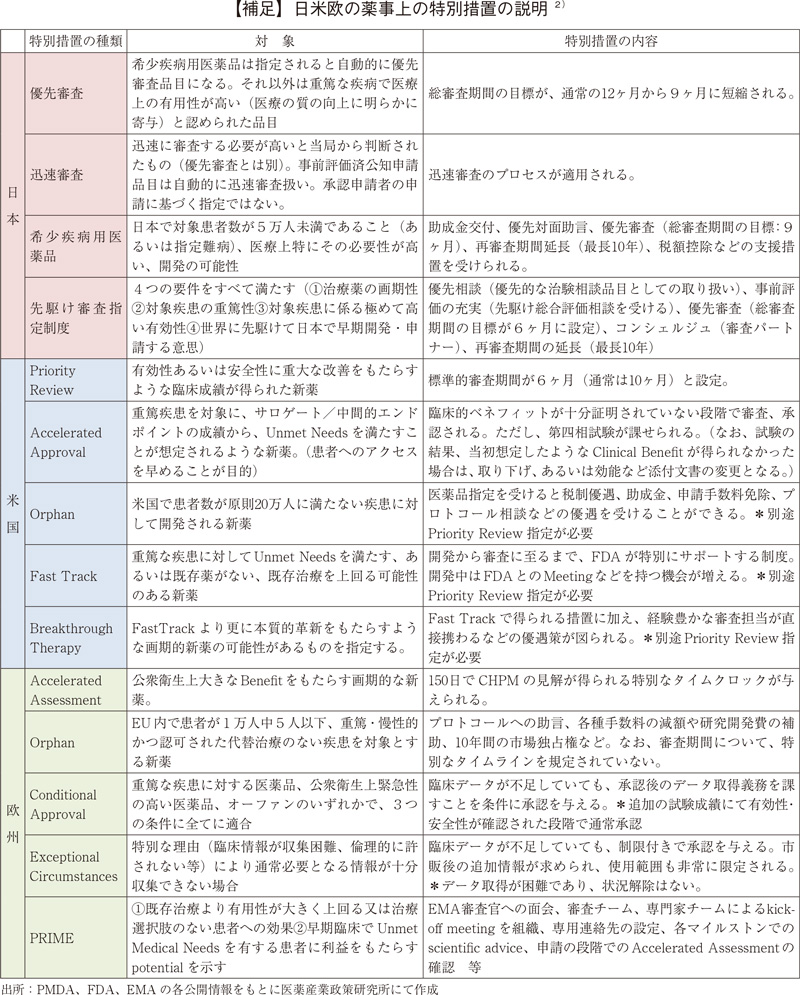
新医薬品の承認品目数の日米欧比較
過去5年間(2015~2019年)の日本、米国、及び欧州で承認された新医薬品の承認品目数を図1に示した。日本で2019年に承認された新医薬品の品目数は130品目で、2018年より21品目増加し、過去5年間で最も多かった。そのうち、NMEは39品目が承認され、2018年と比較し2品目増加した。それに対し、米国では承認品目数が116品目、NMEが48品目と、承認品目数の多かった2018年よりいずれも少なく、NMEは2015年や2017年と同程度であった。欧州は2019年の承認品目数が111品目、NMEが28品目であり、過去5年間で最も少ない品目数であった。
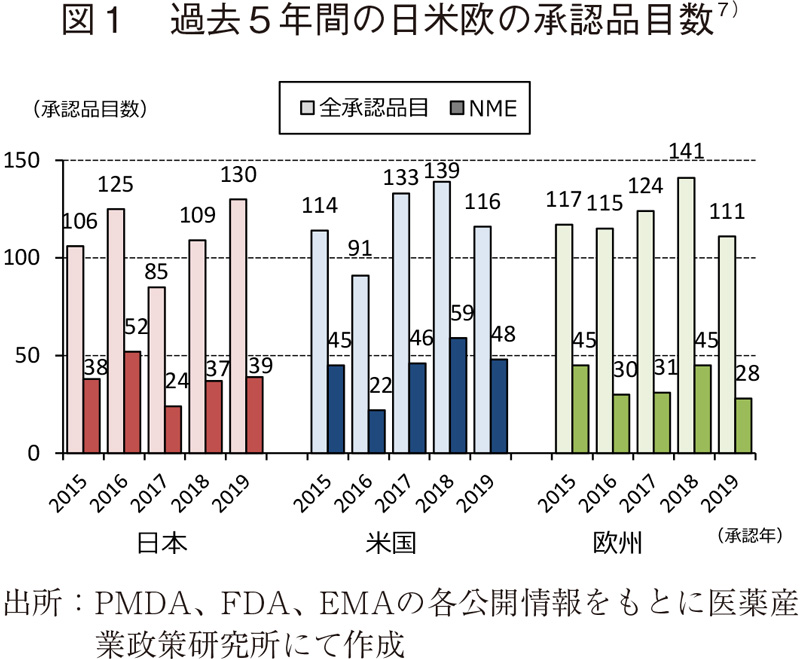
薬事上の特別措置を受けた承認品目数(NME)
日米欧で過去5年間(2015~2019年)に承認されたNMEのうち、各地域の薬事上の特別措置を受けた品目数とその割合について調査した(図2)。
2019年に日本で承認されたNME 39品目中、優先審査(希少疾病用医薬品を含む)は14品目(35.9%)、迅速審査(優先審査を除く)は1品目(2.6%)、希少疾病用医薬品(先駆け審査指定制度の指定品目を含む)は12品目(30.8%)、先駆け審査指定制度の指定品目は1品目(2.6%)であった。優先審査、希少疾病用医薬品は2013年以降それぞれ35~45%、30~35%程度の割合で推移していた。また、迅速審査(優先審査を除く)でNMEが承認されたのは2012年以来であった。
米国では、2019年承認されたNME 48品目中、Accelerated approvalを受けた品目が9品目(18.8%)と2011年以降で最多の品目数であり、割合としても2016年に次ぐ高い水準であった。また、Priority reviewは28品目(58.3%)、Orphan指定品目は21品目(43.8%)、Fast Track指定品目は17品目(35.4%)、Breakthrough Therapy指定品目は13品目(27.1%)であった。Priority reviewは、2014年以降、全体の割合が常に55%を超えて推移していた。
欧州については、2019年に承認されたNME 28品目中、Conditional approvalを受けた品目が7品目(25.0%)と、2016年と同程度の高い割合を示した。また、欧州の新薬開発促進の措置として開始されたPRIMEの指定品目が2018年に続いて2品目(7.1%)承認された。一方、Accelerated Assessmentについては3品目(10.7%)と2018年同様の低い水準であり、Orphan指定品目は6品目(21.4%)と過去5年間で最も低い割合、Exceptional Circumstancesについては該当する品目がなかった。
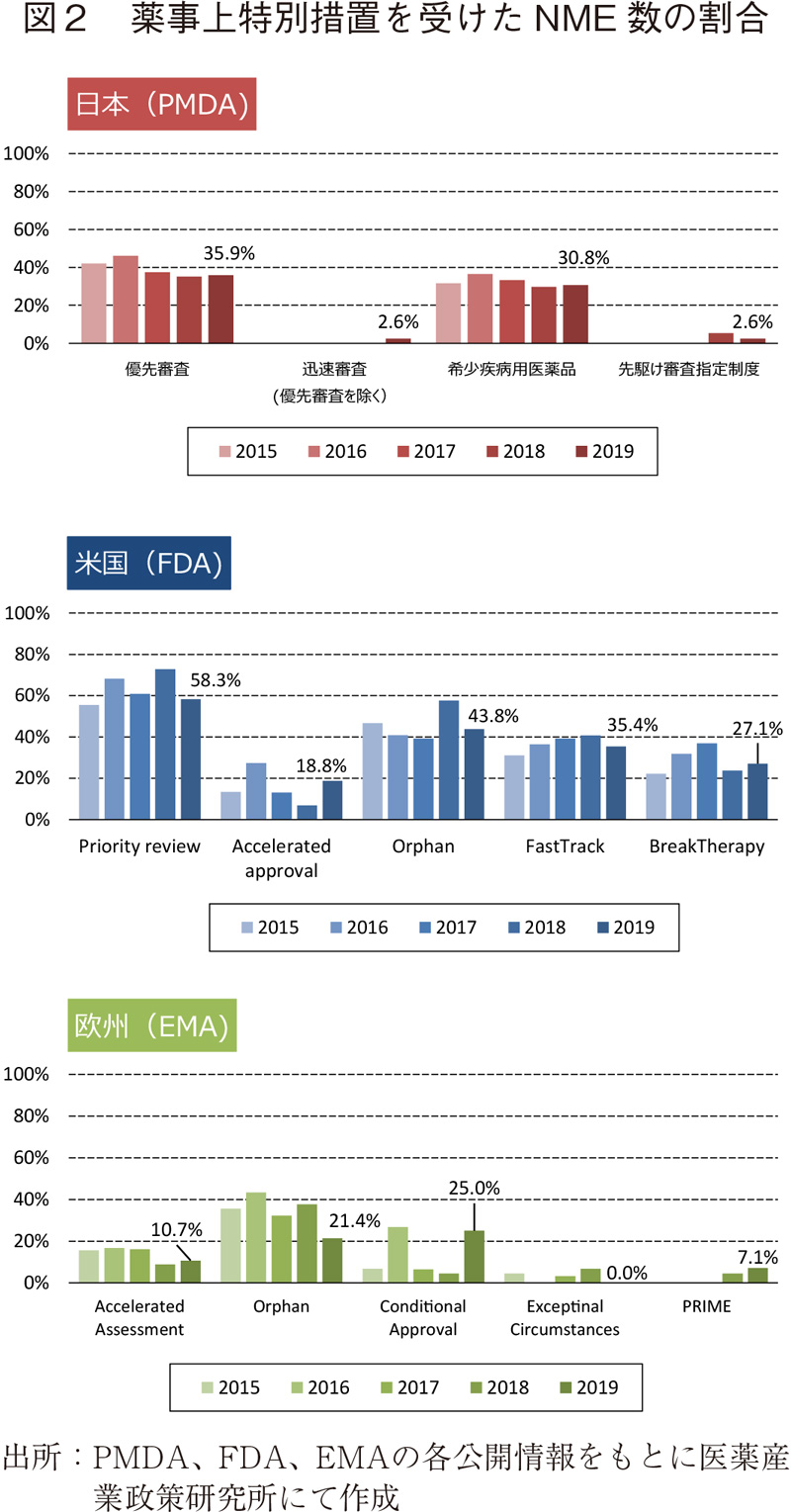
新医薬品の審査期間の日米欧比較
日米欧で2019年に承認された新医薬品の審査期間(月数)を表1に示した。2019年承認品目のそれぞれの審査期間(中央値)は日本9.9ヶ月、米国9.9ヶ月、欧州11.9ヶ月であり、日本、米国が同様で欧州が長く、2018年と同様の傾向であった。NMEに関しては、2019年承認品目の審査期間(中央値)は、日本10.0ヶ月、米国8.0ヶ月、欧州13.8ヶ月であった。日本は米国より2.0ヶ月長く、欧州より3.8ヶ月短く、こちらも2018年と同様の傾向であった。
薬事上の特別措置を受けた品目の審査期間
2019年承認品目のうち、審査期間の短縮を目的とした薬事上の特別措置(日本:優先審査、先駆け審査指定制度、迅速審査、米国:Priority review、Accelerated Approval、欧州:Accelerated Assessment)を受けた品目について表2に示した。
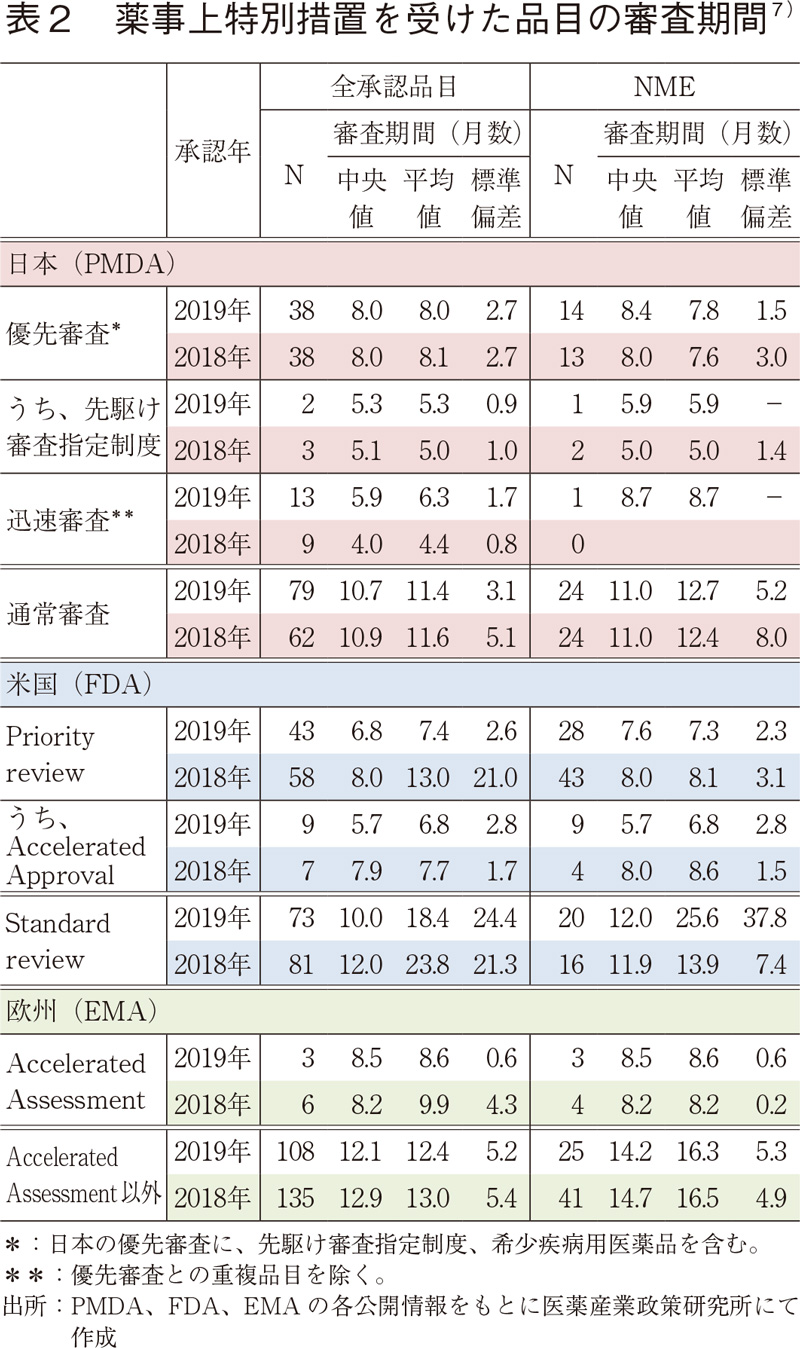
審査期間上位5品目による日米欧比較(NME)
2019年に承認されたNMEのうち、日本、米国、及び欧州での、審査期間が最も短い上位5品目に絞り、薬事上の特別措置との関係を調査した(表3)。
日本では、審査期間上位5品目全て薬事上の特別措置を受けており、それらの中には先駆け審査指定の対象品目も含まれていた。上位5品目の審査期間は3.4~8.0ヶ月とNME 39品目の審査期間の中央値10.0ヶ月と比較して非常に短かった。
米国では、審査期間上位5品目全て複数の薬事上の特別措置指定を受けており、それらの審査期間は3.1~5.1ヶ月と、NME 48品目の審査期間の中央値8.0ヶ月はもとより、Accelerated approvalを受けたNME 9品目の審査期間の中央値5.7ヶ月よりも短かった。
対して欧州では、審査期間上位3品目のみ、審査期間の短縮を目的とした薬事上の特別措置であるAccelerated Assessmentの指定を受けていた。上位3品目については10ヶ月より短い審査期間となっていたが、5位以降のNME 24品目は1年以上の審査期間がかかっていることが確認された。
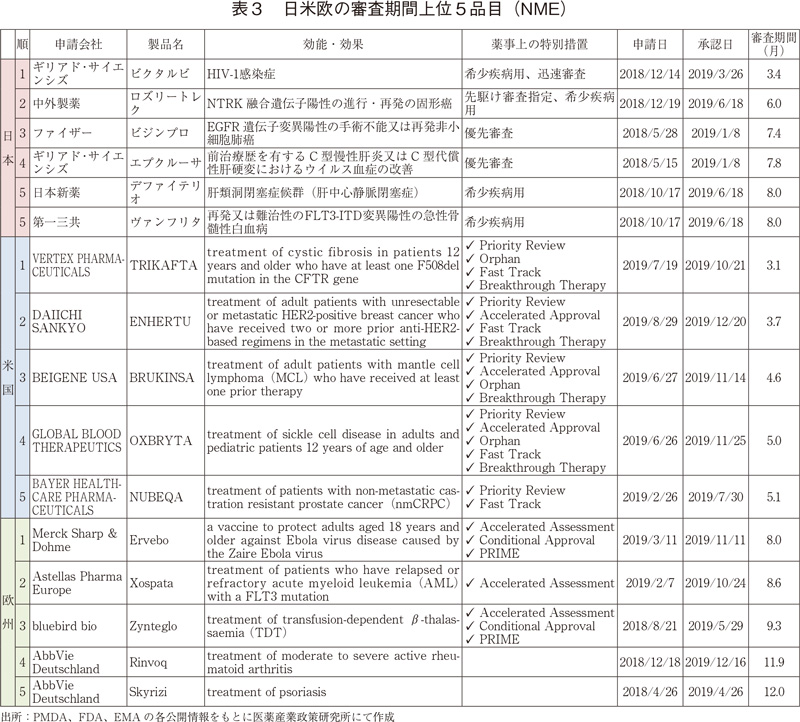
また、米国と欧州の上位5品目の中に日本発の新医薬品がそれぞれ1品目(ENHERTU、Xospata)ずつ含まれていた。それらの品目は、薬事上の特別措置の文言(補足参照)を参照すると、重篤疾患への本質的革新をもたらすような画期的新薬、または、公衆衛生上大きなベネフィットをもたらす画期的新薬として認可されたことが確認できた。
審査期間の中央値の年次推移(日米欧)
日本、米国、及び欧州で承認された医薬品の承認年毎(2000~2019年)の審査期間(月数)を表4に、審査期間の中央値の年次推移を図3に示した。
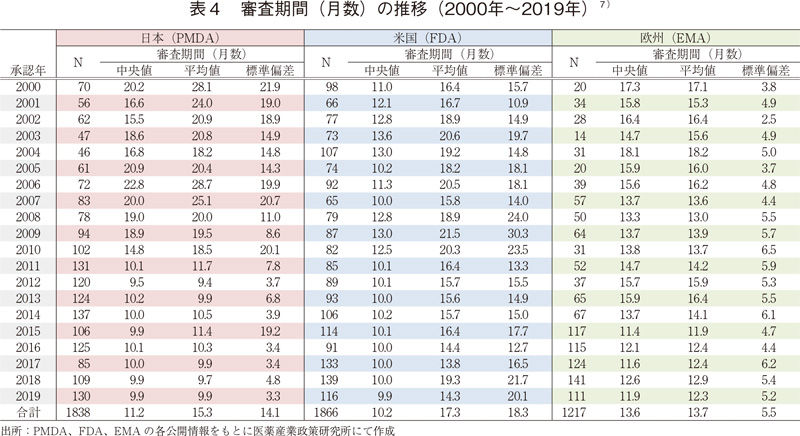
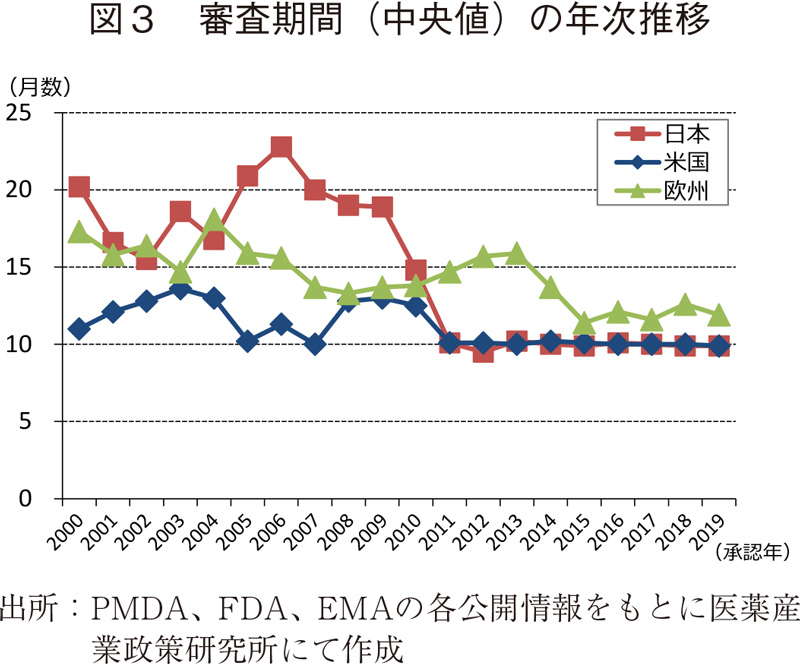
調査対象の全期間における審査期間の中央値は、日本11.2ヶ月、米国10.2ヶ月、欧州13.6ヶ月であった。年次推移を見てみると、2000~2010年までの期間は概ね米国、欧州、日本の順に審査期間が長い傾向であったが、2011年に日本では大幅な審査期間の短縮を認め、それ以降、日本と米国の審査期間の中央値は同様(約10ヶ月)、続いて欧州の順に審査期間が長くなっていた。欧州も2015年からは審査期間の短縮を認め(約12ヶ月)、以降、2019年まで同様の審査期間で推移していた。また、審査期間のばらつき(標準偏差)を経年で見ると、日本の審査期間は米国や欧州と比べて品目ごとのばらつきが比較的小さく安定していることが確認された。
考察とまとめ
本稿では、日本、米国、及び欧州で2019年に承認された新医薬品の承認品目数および審査期間について、それぞれの規制当局の公表情報を元に集計、比較調査した。
2019年の承認品目数は、日本は過去5年間で最も多かったものの、米国および欧州は2018年と比較してともに減少していた。このことは、米欧の2018年の承認品目数が過去最多であったことも影響していると考えられた。また、NMEの承認品目数と薬事上の特別措置品目についての調査からは2つの特徴が見られた。1つ目の特徴は、米国でのAccelerated approvalと欧州でのConditional approvalの承認品目数が過去最高水準であったこと。これらの特別措置は、重篤疾患、公衆衛生上緊急性の高い医薬品やオーファンへの患者アクセスを早めることが目的となっている措置である。2つ目は、日本の希少疾病用医薬品、米国のOrphan指定品目の承認数は直近5年間、高い割合で推移し続けていたことである。これら2つの特徴から考察すると、世界の各企業が希少疾病用を含むアンメット・メディカル・ニーズの高い医薬品の開発に対して引き続き積極的に投資していることが考えられた。
新医薬品の審査期間については、日本の審査期間(中央値)は米国と同様であり、欧州より短い傾向を示し、2011年以降続くこの傾向は2019年も持続していた。NMEに限定した場合は、米国の審査期間(中央値)が最も短く、日本、欧州の順となっており、2018年と同様であった。この差を詳細に理解するために、日本のNMEに占める優先審査指定品目の割合や審査期間を米国や欧州と比べると、米国ではNMEに占めるPriority review指定品目の割合が日本と比べて高いだけでなくその審査期間も短い。一方、欧州のNMEではAccelerated Assessment指定品目の審査期間自体は日本と同等であるものの指定品目の割合が大幅に低く、かつ、Accelerated Assessment以外のNME審査品目の審査期間が長い。以上のことから、各地域のNMEの審査期間(中央値)の差が出ていることがわかる。また、2019年に承認された日米欧の審査期間上位品目(NME)も合わせて見ることにより、各地域で画期的な治療法の早期実用化に向けての制度が活かされ、審査期間の短い品目は概ね複数の薬事上の特別措置にまたがって指定を受けている状況が確認できた。
現況、日本(PMDA)、米国(FDA)、及び欧州(EMA)ともに、患者さんへの革新的な医薬品のアクセスを早めることを主眼に審査期間の短縮を目的とした特別措置を整備し、企業がそれら制度を戦略的に活用し投資を継続することでその目的を果たし、患者さんの健康や公衆衛生上の課題に貢献をするというサイクルがうまく回っていると考える。医薬品の研究開発が多様化・高度化する中、その時代に見合った制度がさらに整備されていくことを期待する。
-
1)医薬産業政策研究所.「日本における新薬の臨床開発と承認審査の実績」リサーチペーパー・シリーズ No.69(2016年11月)
-
2)医薬産業政策研究所.「日米欧の新薬承認状況と審査期間の比較-2018年承認実績を中心に-」政策研ニュース No.58(2019年11月)
-
3)医薬産業政策研究所.「2019年に日本で承認された新医薬品とその審査期間」政策研ニュース No.59(2020年3月)
-
4)独立行政法人医薬品医療機器総合機構 承認情報:Accessed on Sep 28, 2020.
-
5)Food and Drug Administration(FDA). Drug and Biologic Approval Reports:
https://www.fda.gov/drugs/drug-and-biologic-approval-and-ind-activity-reports/nda-and-bla-approvals Accessed on Sep 28, 2020. -
6)European Medicines Agency Annual Reports: Accessed on Sep 28, 2020.
-
7)日本の全承認品目数を再集計し、公表データ 2)を一部修正した。
-
8)2019年にConditional approvalを受けたNME 7品目の審査期間(月数)は、中央値 15.7、平均値 16.5、標準偏差 8.4 であった。

