Topics 日米のSoftware as a Medical Deviceの新たな規制枠組み構築動向
医薬産業政策研究所 主任研究員 枡田竜育
はじめに
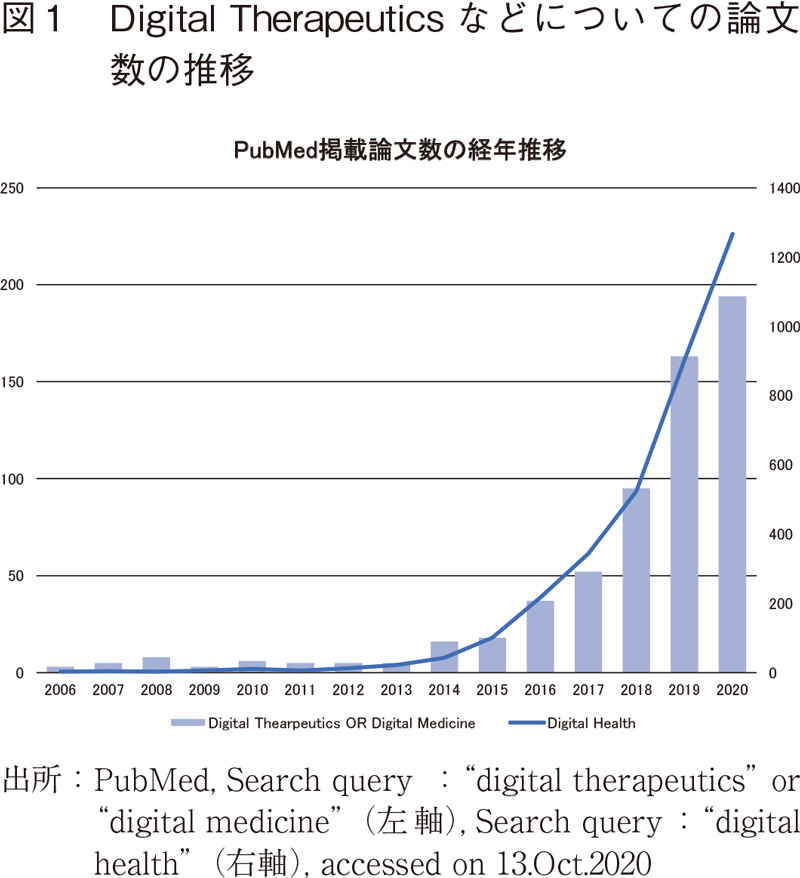
近年、Digital Therapeuticsが注目を集めている。2010年にWellDoc社が糖尿病管理用アプリ"BlueStar"の承認をFood and Drug Administration(アメリカ食品医薬品局 以下、FDA)から取得して以降、主に米国でDigital Therapeutics(以下、DTx)の開発が加速しており、最近では2020年6月に小児のADHD(注意欠如・多動症)の注意機能を改善するゲームベースのDTxであるAKL-T01がFDAに承認1)されるなど、ユーザーインターフェースへも多様化の様相を見せている。
我が国においても、2020年8月21日にニコチン依存症治療アプリCureapp2)が治療アプリとしては初めて医療機器として薬事承認を受け、国内初の「デジタル薬」と報じられる3)など注目を集めている。
DTxの多くは、米国薬事規制上はSoftware as a Medical Device(プログラム医療機器、以下、SaMD)に該当するものである。国際的には2013年にIMDRF(International Medical Device Regulators Forum)が、増加しつつある単体で医療機器として機能するソフトウェアをSoftware as a Medical Deviceと定義し、従来から広く使われている医療機器の一部の役割を担うソフトウェアと明確に区別した。SaMDは、すでに世界で診断や疾病の治療、管理の一翼を担っているし、今後の期待も少なくない。近年はAI(人工知能)を搭載したSaMDも登場している。
とりわけML(Machine Learning)/DL(DeepLearning)を搭載したSaMDでは、使用を通じて持続的にデータを収集・分析し、その結果をアップデートして機能に反映することによる性能の持続的な変化が期待されるものもある。従来の医療機器あるいは医薬品を念頭に置いた薬事規制を、性能が速やかに変化しうる、あるいは変化すること自体が価値となりうるSaMDの特性を反映した体系に再構築していくことが求められており4)、その特性に沿った新たな薬事制度が展開されている。
本稿では、SaMDの規制体系の動向に関し、米国のDigital Health Software Precertification Program(以下、本稿ではPre-Cert表記する)、および我が国のImprovement Design within Approval for Timely Evaluation and Notice(以下、IDATEN)の動向を概説する。"性能が速やかに変化しうる、あるいは変化すること自体が価値となりうる"SaMDの特性は、アップデートが行われない、あるいはその頻度が緩やかである従来の医薬品・医療機器にはない価値を創出する可能性があるため、国内外問わず製薬企業は、自社医薬品を中心とするトータルソリューションとしてデジタルヘルスをサービスに取り入れたり、医薬品にとどまらずSaMDを含めDigital Healthを事業ドメインの一つとして展開したりする企業がある。あるいはSaMDをいわばデジタル薬とみて、従来医薬品を送達しえなかった患者へ治療ソリューションを届けられる可能性がある点や、患者との接触頻度を高められる点などを考慮し、ある種のCompetitorと捉える考え方もありうる。
いずれにしてもSaMDの規制体系の動向は、製薬企業にとって注視すべき動向と言えるだろう。
デジタルヘルスとSaMD
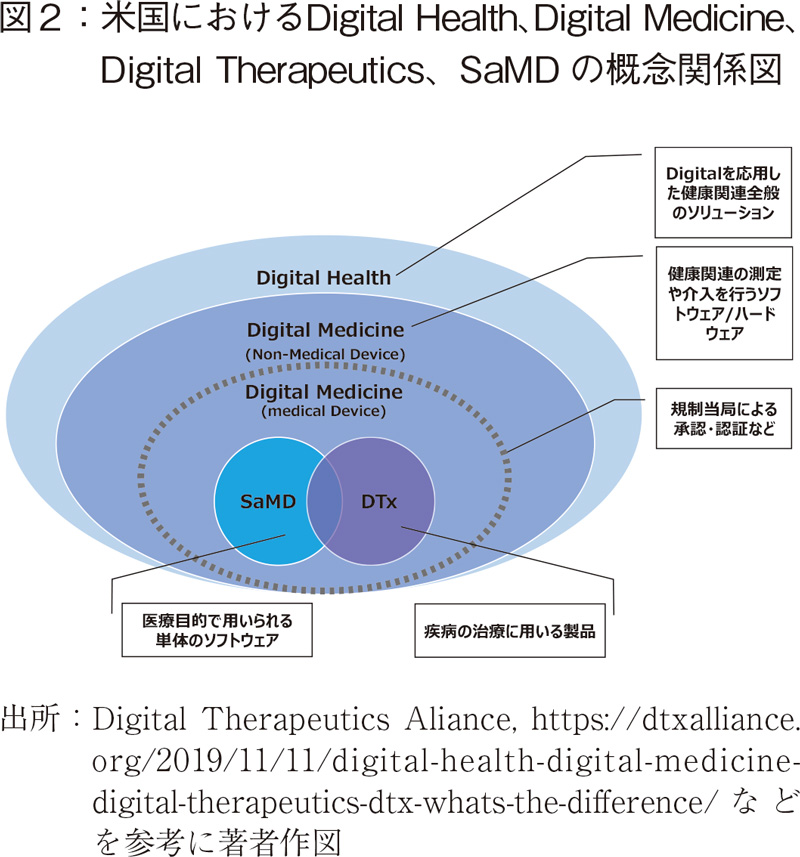
念のため、用語の定義に関しての確認を行っておく。まず"デジタルヘルス"については、様々な機関が定義や解釈を示しているが、統一的とはなっていない5)。FDAは、デジタルヘルスをモバイルヘルス、テレメディスンなどを含む幅広い概念であるとしている。SaMDは、デジタルヘルスに含まれる概念であり、IMDRFが2013年に医療目的で用いられる単体のソフトウェアである6)と、定義づけている。米国のDigital Therapeutics AllianceはDTxの定義についてエビデンスを有し規制当局に承認などを得たソフトウェアあるいはハードウェアとしている7)。
各用語は、おおむね以下のように整理できると考える。
製薬企業がBeyond-The-Pillとしてデジタル技術を応用したソリューション、サービスの事業化を考える際には、上記概念に照らし、業許可の取得あるいは事業ドメインを再定義する必要が生じるケースもあろう。
米国医療機器の申請プロセス
冒頭記した通り、薬事規制を、性能が速やかに変化しうる、あるいは変化すること自体が価値となりうるSaMDの特性を反映した体系に再構築していくことが重視されており、米国においても体系の整備が進められている8)。ここでは米国の医療機器の承認プロセスを俯瞰する。
FDAは医療機器を人体に対するリスクの高さによってクラスI~IIIに分けている。
我が国の高度管理医療機器にあたる米国のクラスⅢに相当する医療機器やハイリスク10)の新医療機器は、治験を実施し最も厳しいPMA(Premarket Approval)の承認を受ける必要がある。また我が国の管理医療機器に相当するクラスⅡと我が国の一般医療機器に相当するクラスⅠに位置付けられる医療機器は、PMAの必要はないがFDAによる実質的同等性(Substantially Equivalent)の実証を受ける510(k)(Premarket Notification)のクリアランスを受ける必要がある11)。さらに、ハイリスクでない新医療機器でリスクⅠとⅡに位置付けられ、比較に有効な同等機種が存在しない場合には、De Novo申請を行うことができ、PMAに比べれば短期間に審査を受けることができる。

課題となってくるのは、とりわけML/DLを応用したSaMDである。ML/DLは人工知能のプログラム自身が学習する仕組みであり、このようなSaMDは、医療機器としての性能、用いられるデータ、使用目的がアップデートされうる。新たな規制の体系を構築していくべく米国で試行されているのがThe Software Precertification(Pre-Cert)Programである。
Pre-Certの概要
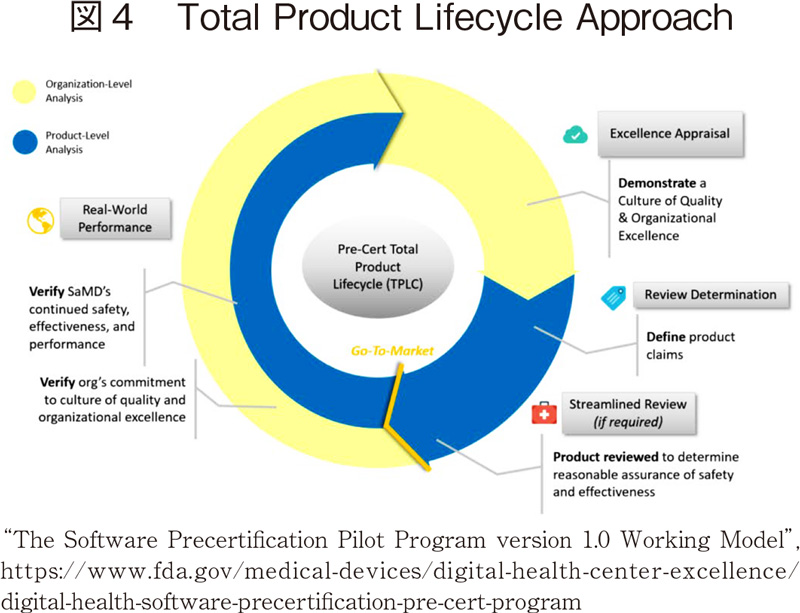
Pre-Certの意図は、SaMDの承認においてSaMDそのものではなく、SaMD開発企業に着目し、その企業が品質に対するロバストな文化・風土と組織的な卓越性を有しかつ、SaMDの上市後もその実使用下での性能に責任をもって監視している場合には、当該企業のSaMDに対し、より迅速かつ効率的な規制監査を行うことにある12)。現在試行中であるPre-Certの試行に参加する企業は、FDAが、経営状態が良好でありFDAコンプライアンスを遵守していること、ソフトウェア製品分野で実績のある企業で製品の品質と組織の卓越性が評価できること、市販後実績や品質管理体制に関する情報をFDAへの提供しFDAとの協議、また現地視察に応じることといった条件に合致しているとする企業である。現在、Apple、Fitbit、Johnson & Johnson、Pear Therapeutics、Phosphorus、Roche、Samsung、Tidepool、Verilyの9社がパイロットに参画している。
このPre-CertにはSaMDに対する新しい規制の考え方が取り入れられている。(図4)Total Product Lifecycle Approach(TPLC)がその一つであり、製品に対する審査と開発企業に対する審査を並走し、上市後も有効性や安全性をモニターしていくアプローチとなっている。
既にPEAR THERAPEUTICSが慢性不眠症患者の治療に用いるSOMRYST™について、FDAによるPre-Certでのレビューを経た初めてのSaMDとして認可を得たとしている13)。Pre-Certには企業の要件を満たすハードルが高すぎるといった批判もあるが、現行の510(k)やDeNovoより迅速な審査方法が構築されることへの期待がある。FDAは、2020年9月にPre-Certプログラムの進捗を更改しており、今後についてプログラムのテストを拡大し、試行的なパイロットから移行していくことを目指すとしている。
IDATENの概要
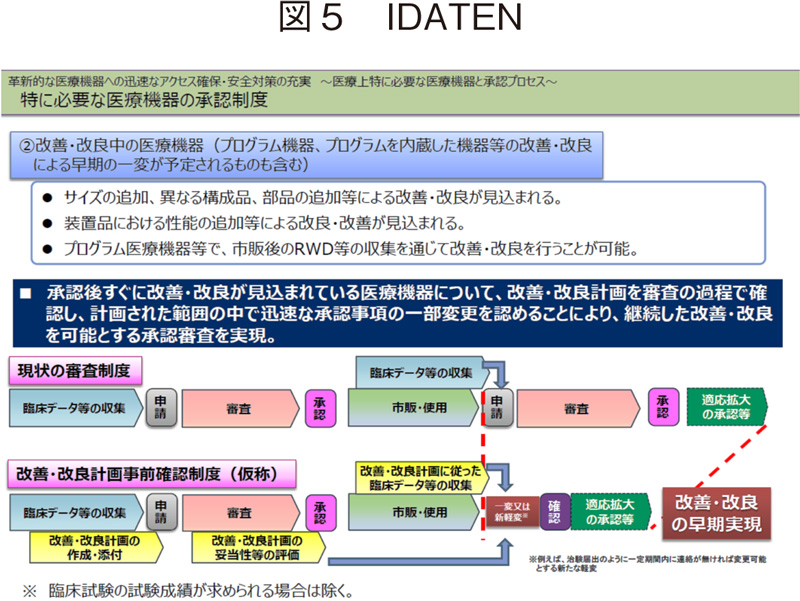
日本においても、医療機器の多様性と絶え間ない改善を踏まえたレギュレーションを整備していくべく、2019年薬機法改正において先駆的医療機器の開発に関わる法改正がなされた。先駆け審査指定制度や条件付き早期承認制度の法制化に加えて、医療機器の特性に応じた新たな承認制度として、「医療機器等の変更計画の確認及び計画に従った変更に係る事前届出制度」が導入されている。これは、改良が見込まれている医療機器について、変更計画を審査の過程で確認し、計画された範囲の中で迅速な承認事項の一部変更を認めることにより、継続した改良を可能とする承認審査制度である。通称IDATEN(Improvement Design within Approval for Timely Evaluation and Notice)とされている。
これまでの適応拡大等の手続では、必要なデータが全て集まってから承認事項の一部変更申請を行うが、IDATENの制度化により、人工知能関連技術を用いて市販後に恒常的に性能等が変化する医療機器や、市販後に収集されるリアルワールドデータを利用した医療機器の改良、使用性向上のためのオプション部品等の追加等に対し、承認事項をより迅速に行う仕組みが取り入れられたこととなる。人工知能関連技術を用いた医療機器についてIDATENを利用する際には、変更計画の作成やその妥当性確認や変更計画で示された変更が実施されていることを確認するために必要な手順などを記した「変更計画の作成及び実施に関する手順」及び、市販後に性能が変化することが想定される医療機器においてその性能を管理するために必要な手順を記した「その他人工知能関連技術の適正かつ円滑な管理に必要な資料」の添付が義務付けられている14)。使用されることにより性能等が常に変化するが、性能等が落ちることは許されないとの考え方に則っており、性能等にバラツキが生じないよう、製造販売業者等による管理が特に重要と位置付けられ、性能等の向上が絶えず維持されるようなプロセスを構築し、そのプロセスが妥当であると評価される必要があるとされている15)。
まとめ
冒頭に述べたとおり、医療機器の分野では、更新頻度の高いプログラムの薬事規制に関する新たな試みが進んでおり、医療の質の向上への更なる貢献が期待されていると言えよう。また、SaMDの枠組みの外、図1で示したDigital Healthについても、今後、飛躍的に事業者やソリューションが増加していくだろう。
しかしながら、対象が患者であれ健常者であれ、薬事規制の範疇かいなかに関わらず、品質、有効性、安全性を確保し、消費者に有益なソリューションを届けていくことは、ヘルスケア分野に参入し事業を行っていくものの最低限の責務であることは言うまでもない。こうした「信頼性」の要素と頻繁なアップデートとをどう両立していくかは、デジタルを用いたヘルスケアソリューションの大きな課題となろう。
IDATENが施行された日本においても、米国で試行されているPre-Certの運用状況を注視しつつ、事業者に何を求めるかをあらためて整理していく必要があるだろうし、医療機器プログラムに搭載される人工知能や教師データの品質に関する規制等にも踏み込んで検討することが求められるだろう。
製薬企業には医療用医薬品製造販売業にとどまらず、いわゆるBeyond-The-Pillの分野に新たな事業機会を求める動きもある。医薬品市場をヘルスケア分野の一構成要素と見たとき、たしかに製薬企業には医療、患者に価値を提供し続けてきた多くの蓄積があるが、Digital関連の技術を社会に実装していく流れが加速しつつある中、Digital×ヘルスケアの制度面の整備状況についても、注視していく必要があるだろう。
-
1)https://www.shionogi.com/jp/ja/news/2020/06/200624.html(Accessed on 1.Oct.2020)
-
2)
-
3)「国内初の『デジタル薬』が承認、禁煙治療向け」、日本経済新聞、2020/8/21(Accessed on 1.Oct.2020)
-
4)
-
5)「デジタルヘルスの進歩を見据えた医療技術の保険償還のあり方に関する研究会からの提言」報告書、医療機器産業研究所、2020年8月、(Accessed on 1.Oct.2020)
-
6)The term"Software as a Medical Device"(SaMD)is defined as software intended to be used for one or more medical purposes that perform these purposes without being part of a hardware medical device."Software as a Medical Device(SaMD): Key Definitions", The International Medical Device Regulators Forum, 2013.12,(Accessed on 1.Oct.2020)
-
7)https://dtxalliance.org/aboutdtx/(Accessed on 1.Oct.2020)
-
8)"Developing the Software Precertification Program: Summary of Learnings and Ongoing Activities", FDA, Sep.2020,(Accessed on 1.Oct.2020)
-
9)「米国医療機器市場動向調査(2017年3月)」(Accessed on 1.Oct.2020)
-
10)a high risk device(supports or sustains human life, is of substantial importance in preventing impairment of human health, or presents a potential, unreasonable risk of illness or injury)
-
11)ただし、FDAはほとんどのクラスⅠの医療機器について510(k)の承認を免除している。(Accessed on 1.Oct.2020)
-
12)
-
13)
-
14)「医療機器の計画変更の確認申請の取扱いについて」(薬生機審発0831第14号)
-
15)

