目で見る製薬産業 バイオ医薬品のドラッグラグに関する一考察
医薬産業政策研究所 統括研究員 村上 直人
はじめに
バイオ医薬品は、化学合成によって製造可能な低分子医薬品とは異なり、生物工学的に製造したタンパク質や生物由来物質などよりなる医薬品で、最近では、従来の低分子医薬では治療が困難ながん、免疫疾患、希少疾病などに汎用されている。医薬産業政策研究所(政策研)の赤羽によると、バイオ医薬品の実用化は1980年代から始まり、徐々に製品数が増加してきたが、医療用医薬品の売上高に対するシェアは、2000年にはわずか10%程度であった。その後拡大基調が続き、2016年におけるバイオ医薬品の売上げ高シェアは約32%を占めるに至っている1)。
政策研の澁口は、2018年の医療用医薬品世界売上高上位100品目に占めるバイオ医薬品のシェアは、品目数が41品目で、売上高合計は49.5%であったと報告しており2)、バイオ医薬品の医療上の価値が世界中の患者さんに広くもたらされていることが窺える。しかしながら、これら41品目の中で日本の製薬企業が創出したものは2製品にすぎず、かたや、低分子医薬品59品目中の日本企業創出製品数が8品目であったことと対比すると、現状、世界に大きく後れをとっていると言わざるを得ない。この立ち遅れの要因として、田中は、日本の製薬企業がバイオ医薬品分野への参入に必要となる新技術導入やインフラ整備に要する大きな資源投入に対する強いリスク意識と相俟って、低分子医薬品からバイオ医薬品への研究開発シフトが欧米に比べて立ち遅れてしまったため、と考察している3)。
その結果として、海外企業創出医薬品の比率が高まり、日本国内の患者さんのバイオ医薬品へのアクセスが海外主要国と比べて大きく立ち遅れてしまう、所謂ドラッグラグに繋がっているとすると、それは、国民の健康維持に不利益をもたらすことになりかねず、その最小化が求められる。
ドラッグラグに関しては、独立行政法人医薬品医療機器総合機構が2006年度から毎年、当該年度に承認されたすべての新有効成分含有医薬品のドラッグ・ラグの試算結果を公表している4)。ここでは、ドラッグラグの定義を米国と比較した申請時期の差と承認審査に要した時間の差の合計値としており、2006年度では2.4年であったところ、2018年度では0.9年に短縮していた。この結果では開発着手のタイミングの差と開発開始後申請までに要した期間は考慮されていない点に注意を払う必要がある。
辻は、米国、EUと日本におけるすべての新有効成分含有医薬品の承認状況を比較し、1999年から2007年の間にいずれかの地域で承認された製品数合計に対して、各地域で承認されている割合を絶対的ドラッグラグ、世界で初めて上市された日を基準として、当該地域での上市日との差を相対的ドラッグラグとして分析を行っている5)。相対的ドラッグラグの構成要素として、開発着手の時期、開発期間、および審査期間を挙げ、これらに対して薬剤の創出国、医療ニーズ(臨床的重要性)、開発・申請企業の状況のほか、適応症、薬剤特性、また治療対象となる患者数と市場性などの要因による影響の可能性を検討しているが、主要因は、開発着手時期の遅れであるとしている。
今回、バイオ医薬品に焦点を絞り、日本で承認された新有効成分含有バイオ医薬品に関して、日米欧における上市状況を踏まえ、主に相対的ドラッグラグについて調査、分析し、その現状について検討した。併せて相対的ドラッグラグに影響を及ぼし得る要因に関して若干の検討を加える。尚、以降の記述では、特記しない限り相対的ドラッグラグをドラッグラグと称することとする。
調査方法
医薬品データベースEvaluatePharma(EvPh)および「明日の新薬」を用いた。日本、米国、欧州において上市されている、バイオテクノロジーの技術分野に分類される新有効成分含有医薬品を対象として、それら3地域における初上市日(欧州に関しては、対象国のうちもっと早い上市日)を調査した(EvPh;2020年4月10日調査)。
また、日本における上市製品について、その承認時効能の独占販売期間にかかる特許の延長期間を含む特許満了日を、サンエイレポート「単品別再審査期間と医薬特許期間延長(医療用)」(2019年4月版)より入手した。
日米欧で上市されているバイオ医薬品
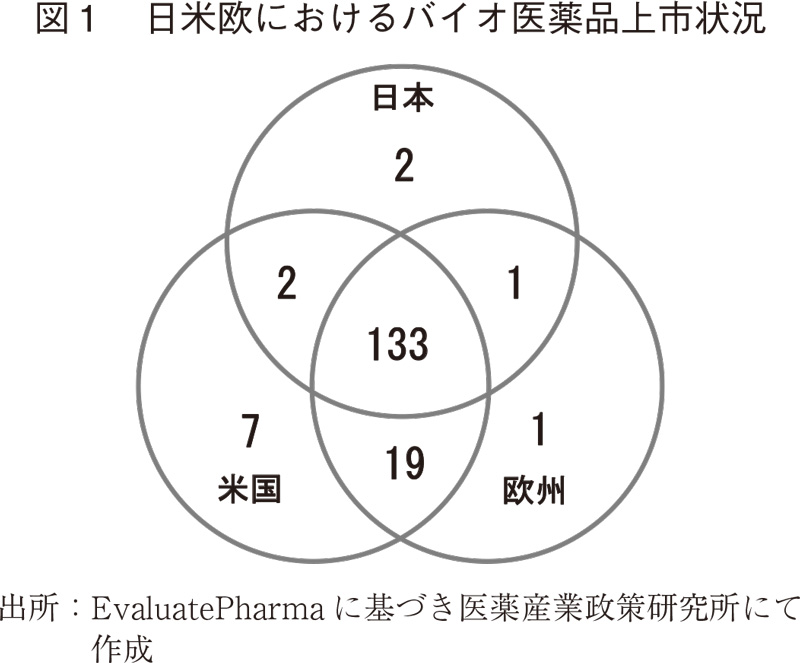
日米欧いずれかの地域で上市されているバイオ製品(ワクチンを除く)のうち、上市日が確認できる製品は165製品であった。そのうち日本で上市されている製品は、138製品であった(図1)。138製品中、抗体医薬品は59製品、それ以外のバイオ医薬品は79製品で、うち本社所在地を日本とする国内製薬企業が創出したものはそれぞれ6製品、4製品であった。また、138製品中133製品が日米欧3地域において上市されていることが確認できた。
海外既上市製品のうち日本未上市の27製品が、今後新たに日本で上市されることが想定され、以下で述べる各海外上市年における相対的ドラッグラグの状況が長期化する方向に変化する可能性があることに留意する必要がある。尚、27製品のうち海外初上市年が1999年以前の製品は1品目、2000年以降5年毎に2004年までに2品目、2009年までに0品目、2014年までに4品目、2015年以降に上市されたものが20製品となっており、20製品中では15製品が国内においてPhase 3試験中あるいは申請済みの段階にあることから、特に今後の動向を注視する必要がある。
日本で上市されているバイオ医薬品
国立医薬品食品衛生試験所が公開している「日本で承認されているバイオ医薬品(バイオ後続品および配合剤を除く)」のリスト(2020年5月1日作成)6)によると、酵素製剤 19品目、血液凝固系関連因子製剤 19品目、血清タンパク質製剤 1品目、ホルモン製剤 25品目、インターフェロン類製剤 8品目、エリスロポエチン類製剤 4品目、サイトカイン類製剤 7品目、抗体製剤 62品目、融合タンパク質製剤 5品目、合計150製品が日本で承認を受けているとされており、データベースEvPhにより92%の製品が抽出されていたことを確認した。尚、EvPhで抽出した133製品の初上市日の中に承認時効能に対する上市日であるか否かが不明確なもの等が9製品あったため対象から除外し、124製品を今回の調査対象とすることとした。
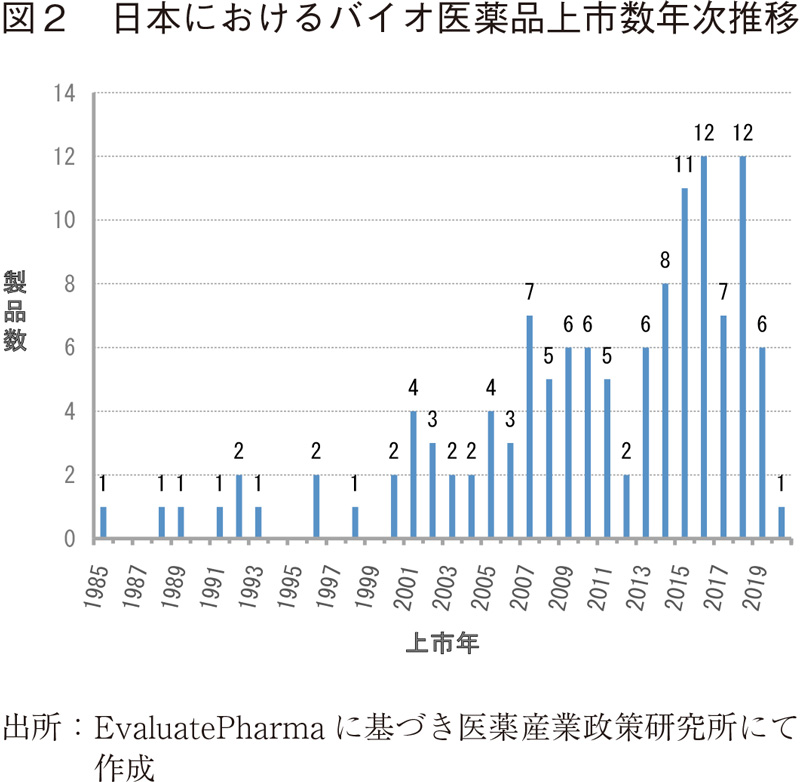
これら124製品について、日本における上市年毎に製品数を図2に示したが、2000年代初頭より上市製品数が漸増していることが見てとれる。
日本におけるバイオ医薬品のドラッグラグ
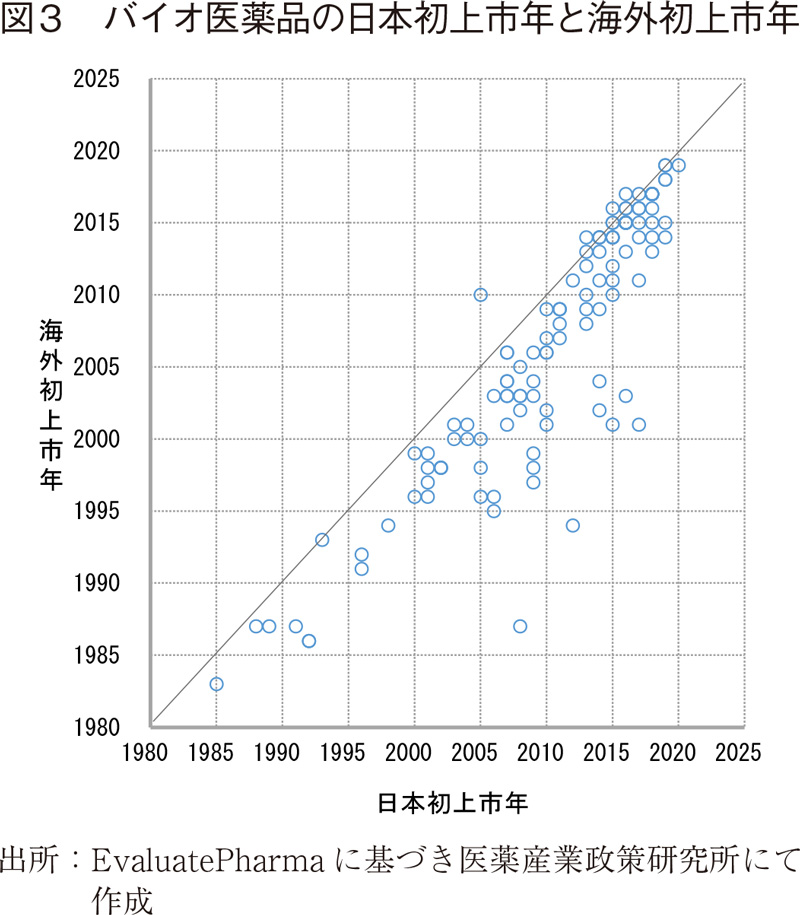
調査対象のバイオ医薬品124製品について、米国と欧州の初上市日のうちいずれか早い日を海外初上市日とし、上市年単位で日本での上市年との比較を散布図を用いて行った(図3)。
年単位で比較すると、124製品中4製品が海外初上市年より早い年に、12製品が同じ年に日本において上市されていたが、個々の製品を示す点のほとんどが同じ上市年を示す補助線の下に位置しており、日本で上市された大多数のバイオ製品がドラッグラグを有していたことが見てとれる。尚、同じデータ値の製品が複数あり、そのため点が重複していることに留意いただきたい。
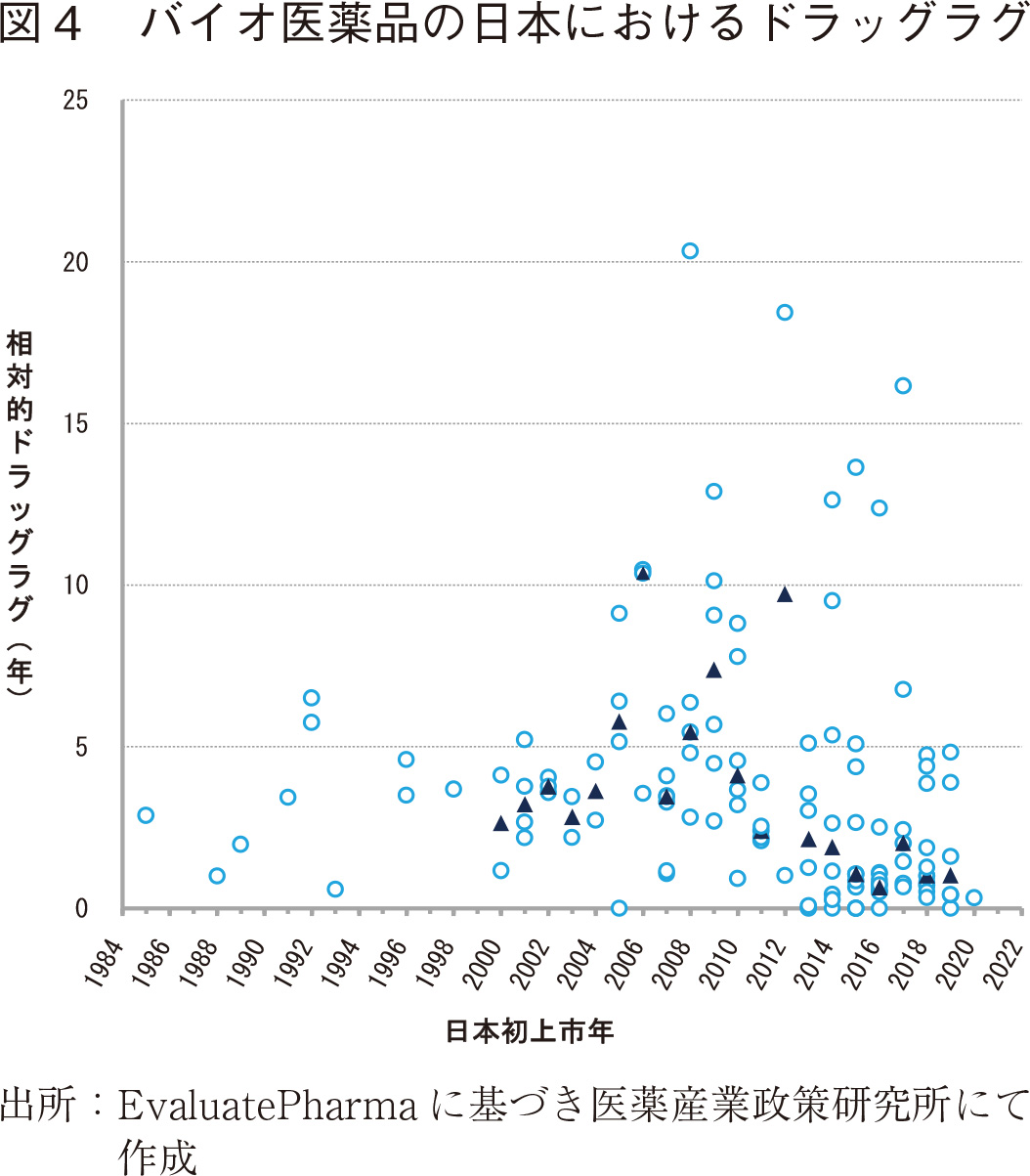
全対象製品毎のドラッグラグを目視的に捉えるために、日本における上市年別にドラッグラグを年数単位でプロットした(図4)。2000年代半ば以降上市品目の増加と相俟って、ドラッグラグが7年を超える製品の上市が目立つが、▲で示す中央値の推移に注目すると2010年以降、個別製品のバラツキはあるものの、ドラッグラグが縮小傾向にあるように見受ける。
ドラッグラグのバラツキの多くが7年を超える海外では古い上市製品であること、また、2013年頃よりドラッグラグが0~2.5年程度の海外でも上市年の新しい製品の上市が数多く目立つようになってきたことから、海外初上市年が新しい製品のドラッグラグが古い製品よりも短縮していることが推定された。そこで、海外初上市年の視点から製品毎のドラッグラグの推移を確認することとした。
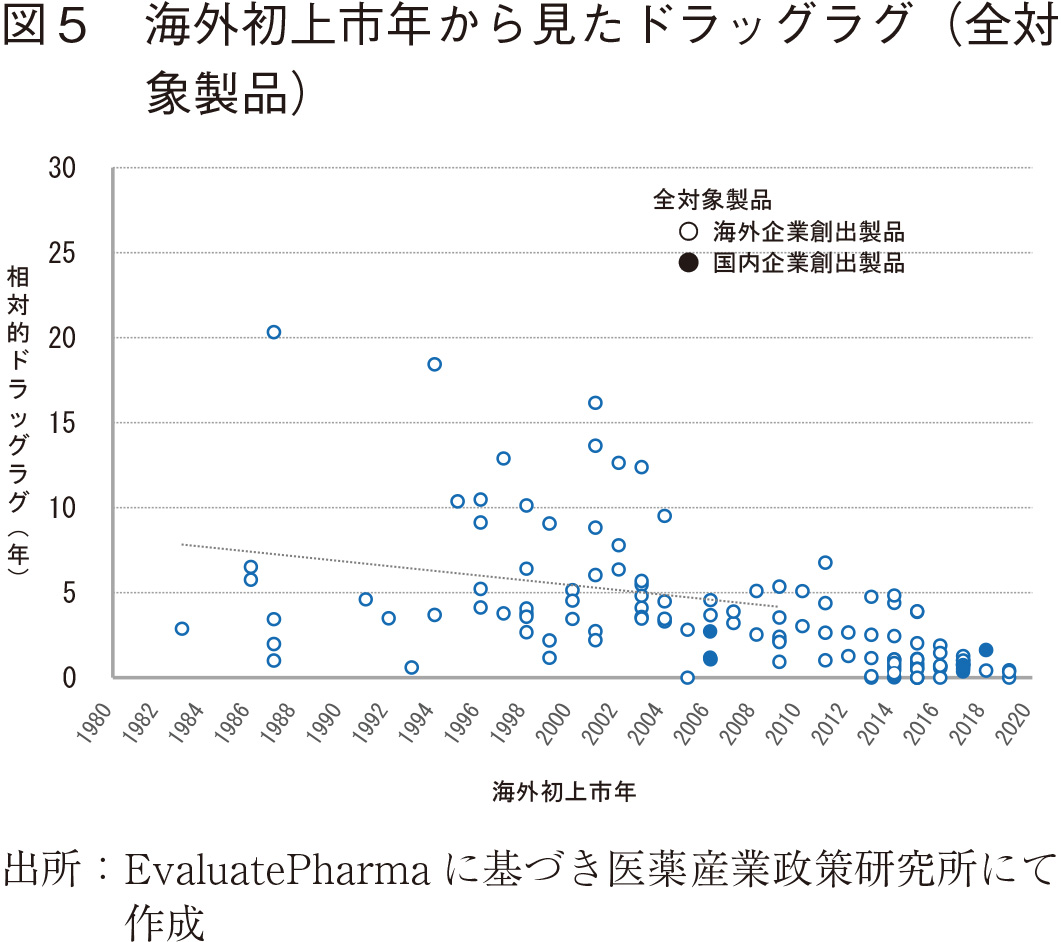
その結果を散布図として、日本未上市製品の国内新規上市の影響が限定的な2009年までの期間の線形近似の近似曲線と共に図5に示すが、1990年後半以降、ドラッグラグが徐々に縮まっている様子が見て取れ、近年、新規バイオ医薬品の患者アクセスが改善傾向にあることが窺われた7)。尚、参考データとして海外初上市年2010年以降の製品のドラッグラグも示しているが、これらを含めた全製品中、日本における上市日が欧米よりも早い製品が7製品、同日上市の製品が1製品認められ、これらのうち日本製薬企業創出製品は1製品であった。図5の中で塗りつぶした点は日本企業創出製品を示しているが、それらを見ると必ずしもすべての製品で日本が初上市国となっているわけではないものの、全体として、ドラッグラグが小さいことが分かる。
希少疾病用医薬品とドラッグラグ
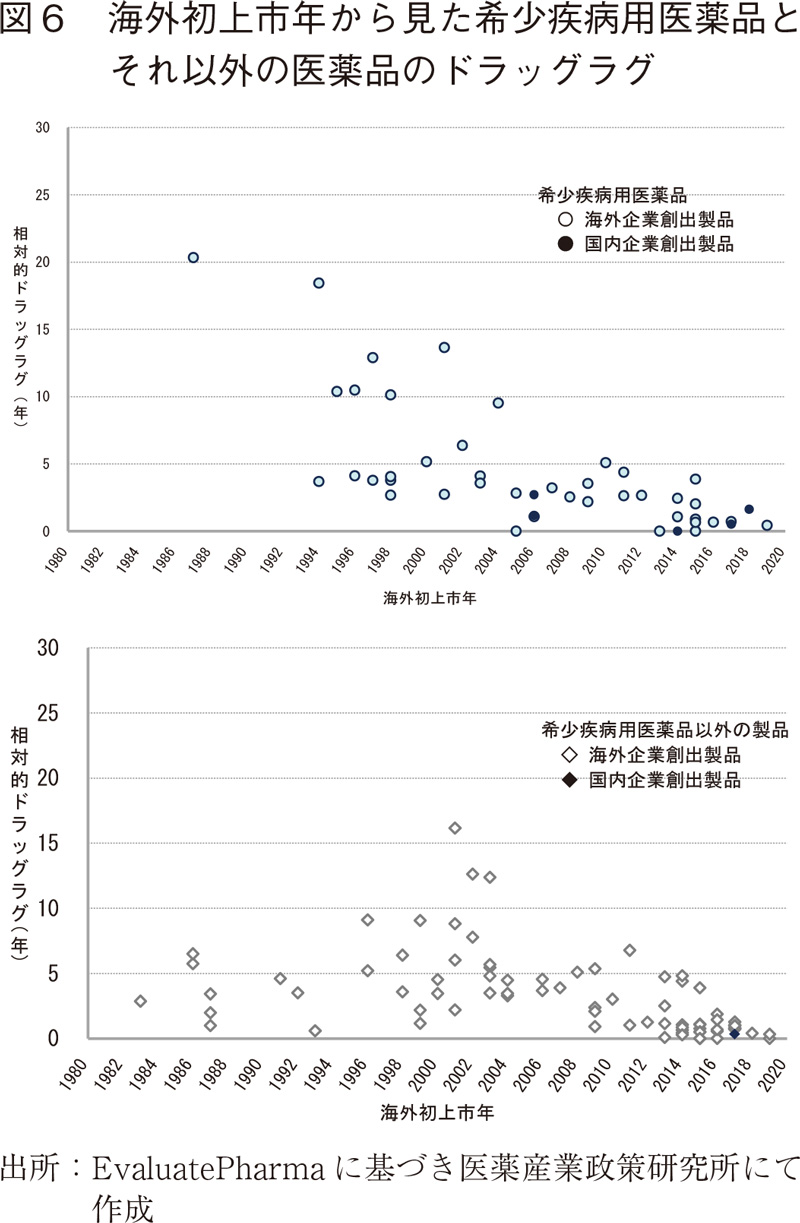
相対的ドラッグラグに対して影響を及ぼす要因として薬剤の創出国、医療ニーズ(臨床的重要性)、開発・申請企業の状況のほか、治療対象となる患者数と市場性などが想定される中で、医療ニーズが高く、患者数と市場性が限定的であるという点で影響を受けることが想定される希少疾病用医薬品について、そのドラッグラグの状況を検討した。
今回の調査対象124製品中、日本において希少疾病用医薬品として承認を受けたものは46製品と全体の3分の1強を占めていた(これらのうち7製品は「未承認薬」8)として開発・申請された後、上市されている)。これらについて、製品毎に海外初上市日と日本におけるドラッグラグとの関係を散布図として図6上段に示し、同様に希少疾病用医薬品以外の対象製品について図6下段に示した。希少疾病用医薬品では、対象製品数が少ないにもかかわらず10年以上のドラッグラグをもって日本で上市された製品数が多いように見受けられるが、それらの海外初上市年は2000年代初頭よりも前に限られ、本検討の時点では、2002年以降1製品を除く全ての製品でドラッグラグが5年を超えるものはなかった。これに対して希少疾病用医薬品以外の製品群では、2000年代初頭以降、5年を超えるドラッグラグをもって国内に上市された製品数が希少疾病用医薬品群よりもやや多い状況であったが、この期間では、希少疾病用医薬品であるか否かによる明らかなドラッグラグの差を見出すことはできなかった。
バイオ医薬品のドラッグラグに影響を与え得るその他の要因
辻が述べているように開発着手時期の差は、ドラッグラグの構成要素として重要であるが5)、開発着手日を特定することは容易ではない。今回、政策研が有する企業アンケート調査に基づく承認品目に関する1次データベースや、EvPhを含む開発パイプラインや承認医薬品に関する市販データベースを用いて検索を行ったが、特に欧米における初上市日に対応する開発着手の時期を網羅的に入手することは困難であった。
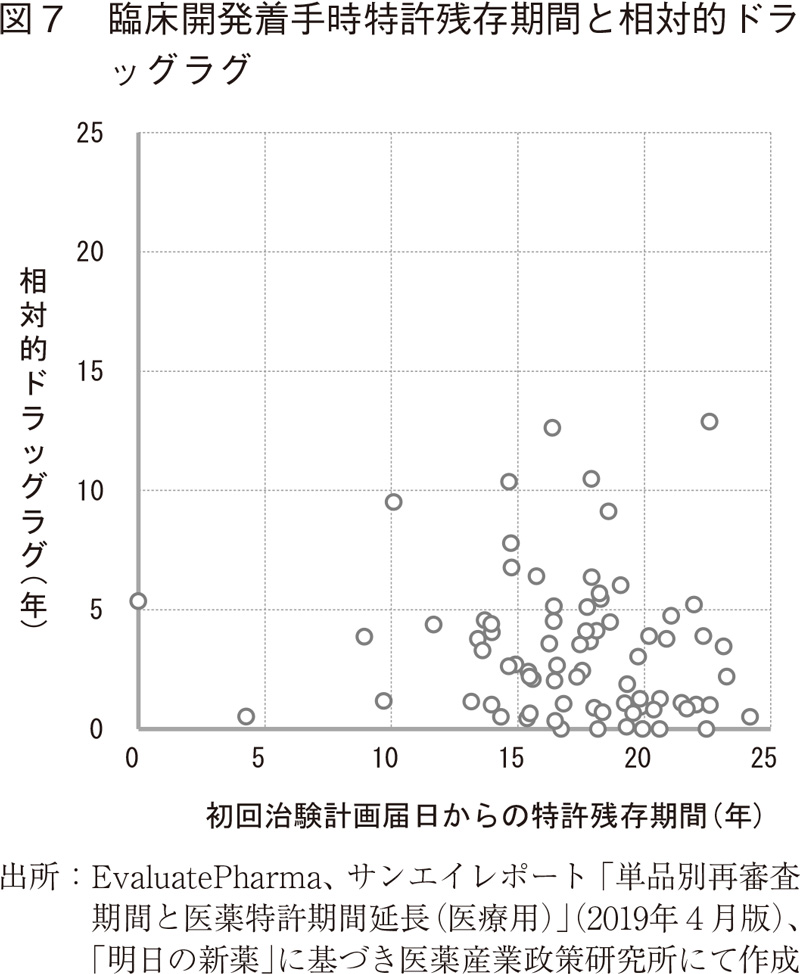
企業は、ある地域で新薬開発の開始を決定するため、開発、製造、販売、財務など多面的な観点から事業可能性を検討する。その中でも特に投資回収の時期と回収後の収益性は重要な指標のひとつと言え、その検討に当たって必要な売上予測の必須情報として、当該地域における想定する独占販売期間が挙げられよう。新薬の9割近くの製品では、延長期間を含む特許期間が独占販売期間を規定しているとの報告を踏まえ9)、海外初上市日、日本における臨床開発着手時点における残存特許期間とドラッグラグの関連性について検討した。ここで、臨床開発着手時点は初回治験計画届日としたが、当該日が確認できない場合にはPhase I試験開始日(年月までしか確認できない場合には、暫定的に15日と見做した)で代替した。
対象124製品のうち、特許満了日のデータが入手可能であった91製品について、海外初上市日における国内特許満了日までの期間とドラッグラグとの関連性を散布図で検討したが、一定の傾向は見いだせなかった。
更に臨床開発着手日のデータも入手可能であった76製品について、初回治験計画届日から特許満了日までの期間(特許残存期間)とドラッグラグとの関係を散布図で検討したところ(図7)、開発着手時点における特許残存期間とドラッグラグの間に明らかな相関関係を認めなかった。他方、大多数のバイオ医薬品において、開発を着手する時点における特許残存期間が10年以上、87%の製品で14年以上であったことが明らかとなった。これは、日本における新薬開発着手を決定するにあたり、臨床試験を開始する時点で予定する承認取得までの期間を考慮して一定の独占販売期間が見込めることを一つの判断指標としていることを示唆しているのではないかと考えられ、興味深い。
おわりに
現在、世界中でがんや免疫系疾患を中心に治療薬としての存在感が高まっているバイオ医薬品について、日米欧3地域における承認・上市動向と、日本における相対的ドラッグラグの状況とドラッグラグの要因について検討を行った。
EvPhで抽出した日米欧いずれかの地域で上市されているバイオ医薬品のうち、約80%が日本で上市されていた。これらの大部分のバイオ医薬品の創出企業所在国が海外企業であることから、85%を超える製品で大なり小なり相対的ドラッグラグが認められた。バイオ医薬品が世界で上市され始めた1980年代後半から2000年代半ば頃までの間は、5年以上のドラッグラグをもって日本に上市される製品は少なくなかったが、本調査時点においてはそれ以降、5年を超えるものは稀となり、バイオ医薬品の患者アクセスが改善する傾向が示唆された。この点は、日本の真の医療の向上にとって非常に重要な変化であると捉える。その理由を特定することは容易ではないが、2000年前後にバイオ医薬品の規格及び試験方法に関するガイドラインなど、ICH(日米EU医薬品規制調和国際会議)合意に基づく諸規制が相次いで発出されたことはその一要因ではないかと推測された。
辻は、日本において海外企業が創出し開発する医薬品におけるドラッグラグの主要因が臨床開発の着手時期の遅れにあると報告している5)。また、工藤らは、日本におけるドラッグラグと承認取得までの臨床試験成功確率には正の関係があり、ドラッグラグが企業にとって合理的な選択である可能性が示唆されたと報告している10)。即ち、欧米など海外地域での新薬開発を先行させ、一定の許容可能なリスクテイクを前提として新薬開発の事業可能性の目処がついた段階で日本での臨床開発を着手するという、開発戦略あるいは経営戦略的に合理的な決定プロセスの結果がドラッグラグを生じせしめていることが示唆されている。
今回、これら戦略的判断の指標となり得る日本における臨床開発着手時点における特許残存期間と相対的ドラッグラグの関連性について検討したところ、相対的ドラッグラグの長短との間に明確な関係は認められなかったものの、同時に9割近くの製品において臨床開発着手時点での特許残存期間が14年以上であることが分かった。臨床開発開始から上市までの期間は対象疾患領域や薬剤特性などによって異なり4~8年程度を要することから11)、大多数の製品では臨床試験着手の段階で少なくとも上市後6~10年間の特許に基づく独占販売期間が見込まれていたことになる。視点を変えると、事業可能性判断を行う時点で、この要件に満たない場合には、新薬の患者アクセスが断たれてしまう、所謂絶対的ドラッグラグに繋がる可能性が示唆されていることに気づく。
2000年代後半以降、相対的ドラッグラグが短縮傾向となってきた事由のひとつとして、前段でICHガイドラインの整備を指摘したが、この時期には2007年の再審査期間の延長、2010年の新薬創出・適応外薬解消等促進加算といった制度上の変化が起こっており、バイオ医薬品の国内臨床開発着手という判断に影響を与えてきた可能性は否定できない。特に再審査期間は現行制度下、実質的な独占販売期間の最低期間を規定しており、その期間の延長により、絶対的ドラッグラグの改善につながることが期待される。
謝辞
本調査では、対象となるバイオ医薬品の日本国内における承認時効能の独占販売期間にかかる特許満了日調査について、日本製薬工業協会知的財産委員会の有志メンバーの協力を得た。ご協力に対して深謝いたします。
-
1)医薬産業政策研究所、「バイオ医薬産業の課題と更なる発展に向けた提言」リサーチペーパー・シリーズ No.71(2018年3月)
-
2)医薬産業政策研究所、「世界売上高上位医薬品の創出企業の国籍 2018年の動向」、政策研ニュースNo.58(2019年11月)
-
3)田中裕、「バイオ医薬品への期待と課題」、医療と社会 p.159 - 170、Vol.24 No.2、2014
-
4)独立行政法人医薬品医療機器総合機構、「ドラッグ・ラグの試算について」(2020/05/29参照)
-
5)辻香織、「日本におけるドラッグラグの現状と要因」、薬理と治療 p.457 - 495、15(1)、2009
-
6)国立医薬品食品衛生試験所 生物薬品部、「Table 1 日本で承認されたバイオ医薬品(バイオ後続品および配合剤を除く)」(2020/05/29参照)
-
7)2015年以降に海外初上市の20製品中、現時点で既に5年間以上のドラッグラグを生じ得る製品が今後日本で上市される可能性がある一方、2018年以降に海外で初上市された15製品の8割は日本で申請中やPh3段階にあり、ドラッグラグが5年を超えない可能性が高い。2014年以前の7製品が今後日本で上市された場合、より長期のドラッグラグを生じ得、「各海外上市年における相対的ドラッグラグの状況」を近似線の傾きで示す時、現時点で観察される右肩下がりの傾きが今後の時間経過とともに平坦化(長期化)するか、逆にさらに傾きを増す(短縮化)か、予測は困難である。
-
8)「未承認薬」 国内で医療上の必要性が高い未承認医薬品、適応外医薬品、その他の医療上の必要性が特に高いと認められる医薬品
-
9)医薬産業政策研究所、「新有効成分含有医薬品の特許期間と再審査期間の比較-2」、政策研ニュースNo.56(2019年03月)
-
10)工藤広平ほか、「新薬臨床開発におけるドラッグラグの合理性(How comfortable is "drug lag" in Japan for the industry?)」、日本薬学会年会ポスター発表(第129年会;2009年3月)
-
11)日本製薬工業協会、「てきすとぶっく(2018-2019)」(2020/06/09参照)

