目で見る製薬産業 新薬の小児適応に関する日米比較
医薬産業政策研究所 統括研究員 村上 直人
医薬産業政策研究所 主任研究員 粟村眞一朗
医薬産業政策研究所 主任研究員 橋本絵里子
医薬産業政策研究所 主任研究員 澁口 朋之
はじめに
医薬品の特性として、期待される効能発揮のベネフィットと健康上好ましくない作用(有害事象)発現リスクが共存しており、患者にとってベネフィットとリスクのバランスを最適化することが重要となる。近年、複数の病気に罹患する高齢者において、それぞれを治療するために投与された複数の薬剤同士で薬物相互作用が起こり、有害事象が発生するといった事例報告が増えており、ポリファーマシーと呼ばれているが、このような事例を回避するために高齢者における医薬品の適正使用の一層の促進が、とりわけ重要視されている。
一方、高齢者とは対極にある小児においても、予てより、医薬品の適正使用の観点から医薬品の適応外使用が大きな課題として取り上げられている。これは、ポリファーマシーの例とは背景が異なり、成人に処方可能な既承認医薬品の中で、小児に対する適応がない、あるいはその添付文書に小児における用法・用量の記載がないにもかかわらず小児に対して使用されているものがあるという事実に起因している。心身共に成長過程にある小児では、医薬品に対する反応が成人とは異なるケースが少なからずあり、医学、薬学的なエビデンスに基づいたリスクとベネフィットのバランスの最適化がより厳密に求められる。即ち、ICH(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use;医薬品規制調和国際会議)ガイドラインE11(小児集団における医薬品の臨床試験に関するガイダンス)およびE11(R1)(同補遺)において推奨されているように1)、成人用途の適応取得を目的とする新薬開発中または既承認医薬品について、小児の適応取得、用量設定等のための適切な臨床試験の実施を含む、最適な方法による小児における使用経験の情報の集積が望まれている。
小児における適応外使用に対する取り組み
小児における医薬品の適応外使用は、日本だけの課題ではなく、欧米においても1960年代頃から問題視されてきた。特に米国では問題解決のための施策がいち早く整備され、現在欧米では、行政機関が企業に対して小児を対象とする医薬品開発の要請権を持つと共に、企業に対して小児用医薬品の開発実施に対するインセンティブの付与2)を規定している。その結果、小児に対し適応追加された医薬品数の増加とそれに伴う適応外使用の減少や、小児を対象とする臨床試験の増加を示唆する報告がある3)。
本邦においても、医師、日本小児科学会を始めとするアカデミア、規制当局、業界団体といったステークホルダーによる取り組みにより、小児における適応外使用の是正に向けた施策が整備され始め、是正の促進が図られつつある。その結果、医薬品の全承認件数における小児の使用に係る承認件数の比率が、2010年以降年々増加傾向にあると報告されている3)。
しかしながら、欧州医薬品庁(EMA)によると、2007年から2015年の間に日米欧で承認された小児に対する適応を有する医薬品と既承認医薬品における小児に対する追加効能数の合計は、それぞれ50、249、221と報告されており4)、本邦における小児を対象とした適応取得に対する取り組みが、米欧と比較して低調であることが窺われた(欧州の値は、中央審査方式、非中央審査方式、相互承認方式および国別審査方式のいずれかで承認を受けたものの合計である)。その背景として、特定の地域特有の適応疾患である可能性や日本では臨床試験の実施に足るだけの患者数が確認できない可能性また、臨床開発着手の遅延などが想定される。今回、臨床開発着手状況に注目し、小児に対する適応取得と臨床開発実施の有無を単一国地域である米国との間で比較し、本邦における小児適応取得に対する臨床開発面からの取り組み状況を調査した。
調査方法
FDA(米国 食品医薬品局)のホームページ上で入手可能なOrange Book(オレンジブック;医療用医薬品品質情報集)5)電子版データファイル(2019年5月版)に掲載された、米国で承認済み医療用医薬品(バイオ医薬品は非掲載)のうち、小児用途の臨床試験実施に基づき独占販売期間が延長(Pediatric Exclusivity)された製品を対象とした。
これらの製品について、日本で承認されているか否か、小児適応を有するか否かについて、PMDA(独立行政法人医薬品医療機器総合機構)のホームページ上で利用可能な検索ツール、医療用医薬品の添付文書情報などにより調査した。また、日本国内における臨床開発の実施状況についての調査は、臨床試験に関するウェブ情報検索ツール、ClinicalTrials.gov(提供 National Library of Medicine;米国 国立医学図書館)あるいは臨床試験情報(Japic Clinical Trials Information、提供 一般財団法人日本医薬情報センター)を用いて実施した。
米国既承認医療用医薬品の日本国内小児適応取得または臨床試験実施の状況
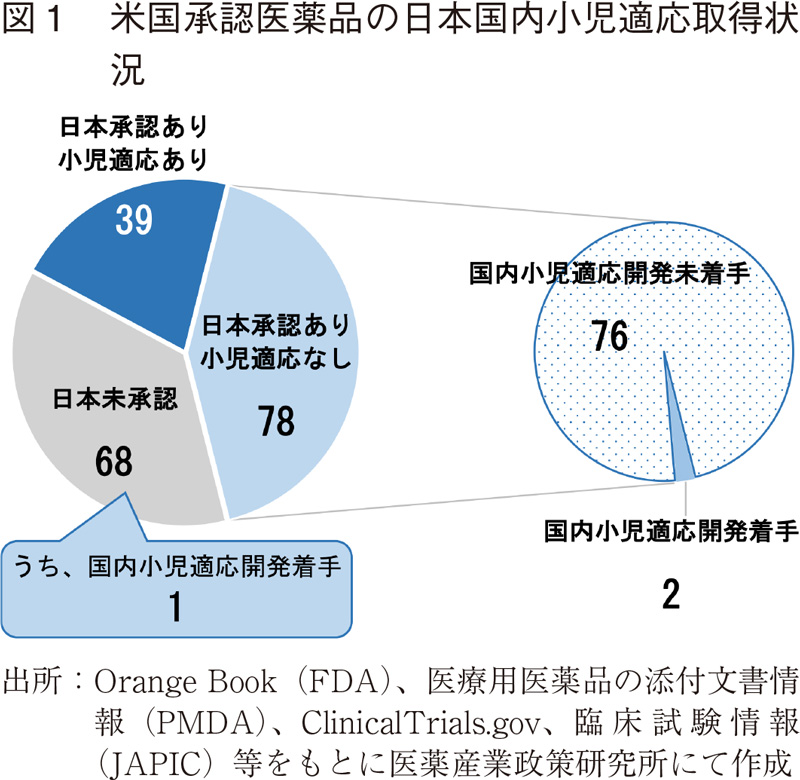
図1に示すように、2019年5月版Orange Bookに収載されている米国の既承認医療用医薬品(低分子医薬品)のうち、Pediatric Exclusivityが適用されたものは185製品であった。
これら185製品のうち、日本で承認されていたものは約6割に当たる117製品で、残りの68製品は日本において未承認の医薬品であった。また、117製品中、小児適応を有するものは3分の1に当たる39製品で、全体の約2割であった。
国内未承認の68製品と小児適応のない国内既承認医薬品78製品について、日本における小児対象の臨床試験実施状況を調査したところ、未承認薬68製品中1製品、既承認薬(小児適応なし)78製品中2製品においてのみ着手していることが確認できた(図1)。即ち、小児を対象とする臨床試験を実施した米国既承認医薬品のうち、日本国内で小児の適応を取得した、あるいは臨床試験を着手している医薬品は、185製品中の約23%に当たる42製品にとどまっていた。
おわりに
日本においても医薬品の適正使用促進の観点より、小児の適応外使用を是正する取り組みとして、既承認薬の小児を対象とする臨床試験を実施する際の再審査期間の延長、小児に対する効能効果や用法、用量が含まれる場合の薬価加算、医療上の必要性の高い未承認薬・適応外薬検討会議の設置、AMED臨床研究治験推進研究事業「小児領域における新薬開発促進のための医薬品選定等に関する研究」に基づく小児医薬品開発ネットワーク構築あるいは、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部改正による特定用途医薬品の優先審査適用の明確化など、多様な施策が段階的にとられてきた。その効果を評価するには時期尚早のものも一部あるが、殊小児を対象とする臨床試験の実施数という観点では、欧米の実績に水をあけられていることは否めない4)。
小児の適応外使用の一層の是正のため、すべてのステークホルダーが引き続き協力してより効果的な対策のアイディアを出し、行動に移すことが求められる。
謝辞
本調査では、対象となる医薬品の日本国内における小児を対象とする臨床開発状況について、可能な範囲で最新情報とする目的で、日本製薬工業協会知的財産委員会の有志メンバーにClinicalTrials.govおよび臨床試験情報で調査した結果の校閲の協力を得た。ご協力に対して深謝いたします。
-
1)
厚生労働省ホームページ ICH-E11 臨床試験(2020/01/20参照)
-
2)一例として、米国では小児対象臨床試験の実施報告書を提出することなどを条件として独占販売期間が、欧州では、新薬の場合、小児対象臨床試験の実施計画書を提出することなどを条件として特許期間が、180日間延長される。
-
3)中川雅生ほか「本邦における小児医薬品開発推進のための提言」、日本小児科学会雑誌120巻10号1453~1461(2016年)
-
4)
-
5)

