目で見る製薬産業 希少疾病用医薬品(Orphan drug)の開発動向 FDAで承認されたOrphan drugの日本での開発状況の分析
医薬産業政策研究所 主任研究員 粟村眞一朗
主任研究員 橋本絵里子
主任研究員 澁口 朋之
統括研究員 村上 直人
医薬産業政策研究所では、規制当局の公表情報等をもとに、日本、米国および欧州の新医薬品の承認情報や審査期間に関して継続的に収集、分析している1)。政策研ニュース第58号2)では2018年までの日米欧の新医薬品の承認状況を比較し、近年、米国(FDA)にてOrphan Drugの指定を受けた品目の承認件数が増加し、2018年承認の新有効成分含有医薬品(New Molecular Entity, NME)の57.6%を占めていたことを報告した。一方で、日本では、希少疾病用医薬品(Orphan drug)の指定を受けた医薬品の承認件数がNMEに占める割合は3割程度に留まっており、その傾向には違いがみられる。そこで今回、日本でもOrphan Drugの承認割合が米国と同程度の水準まで増加していくのかを予測するため、近年FDAで承認されたOrphan Drugの日本での開発状況を調査した。
日米のOrphan Drugの承認状況の推移
直近10年間(2010年~2019年)の日米のOrphan Drugの指定を受けた品目の承認件数およびNMEに占める割合について示した(図1)。
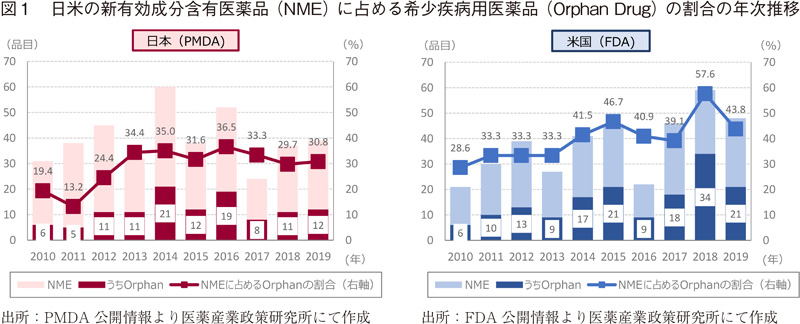
その結果、日本では過去10年間でNME396品目中Orphan Drugは116品目(29.3%)であるのに対し、米国では378品目中158品目(41.8%)であった。Orphan Drugの指定基準の違いはあるものの、米国の方がその割合は高い。また、日本では、近年、その割合は3割程度(29.7~36.5%)で平均的に推移しているのに対し、米国では、2014年以降は39.1%~57.6%と高く、Orphan Drugが占める割合が日本より高いのが特徴である。
まず、日米のOrphan drugの指定基準、優遇措置の内容の違いについて見てみる。
Orphan Drug指定制度の違い
表1に日米のOrphan Drugの指定基準および優遇措置等をまとめた。

日本では、対象が5万人未満(全人口に占める割合は0.04%)であるのに対し、米国は20万人未満(全人口に占める割合は0.06%)と、対象患者数だけで比較すると、米国の方が広く希少疾病の定義を判断していることがわかる。また、指定の基準の中で、日本では、医療上の必要性(疾患の重篤度)や開発可能性が含まれているのに対し、米国では開発コストを米国で回収できないという項目が含まれている。
一方、優遇措置の内容としては、助成金交付、税制優遇が日米ともに設定されており、医薬品開発に関して優先的に相談が可能という点では両者共通である。審査については、日本では、希少疾病用医薬品の指定ととも優先審査が適用されるのに対し、米国は別途Priority reviewの指定を受ける必要がある点が異なっている。また、承認後の優遇措置として、日本では、再審査期間が最長10年間(新有効成分含有医薬品の再審査期間は8年間)まで延長され、再審査期間中のジェネリック医薬品の参入を防いでいるのに対し、米国では7年間のデータ保護期間が設定され、市場独占権が認められている。
なお、米国では"Rare pediatric disease priority review voucher program"を設置し、主に18歳までに発症し、米国の患者数が20万人未満の疾病に対する医薬品に対し、優先審査バウチャーを発行して、小児科領域の希少疾患治療のための新薬開発を促す制度を開始している。
Orphan Drugの日本での承認・開発状況
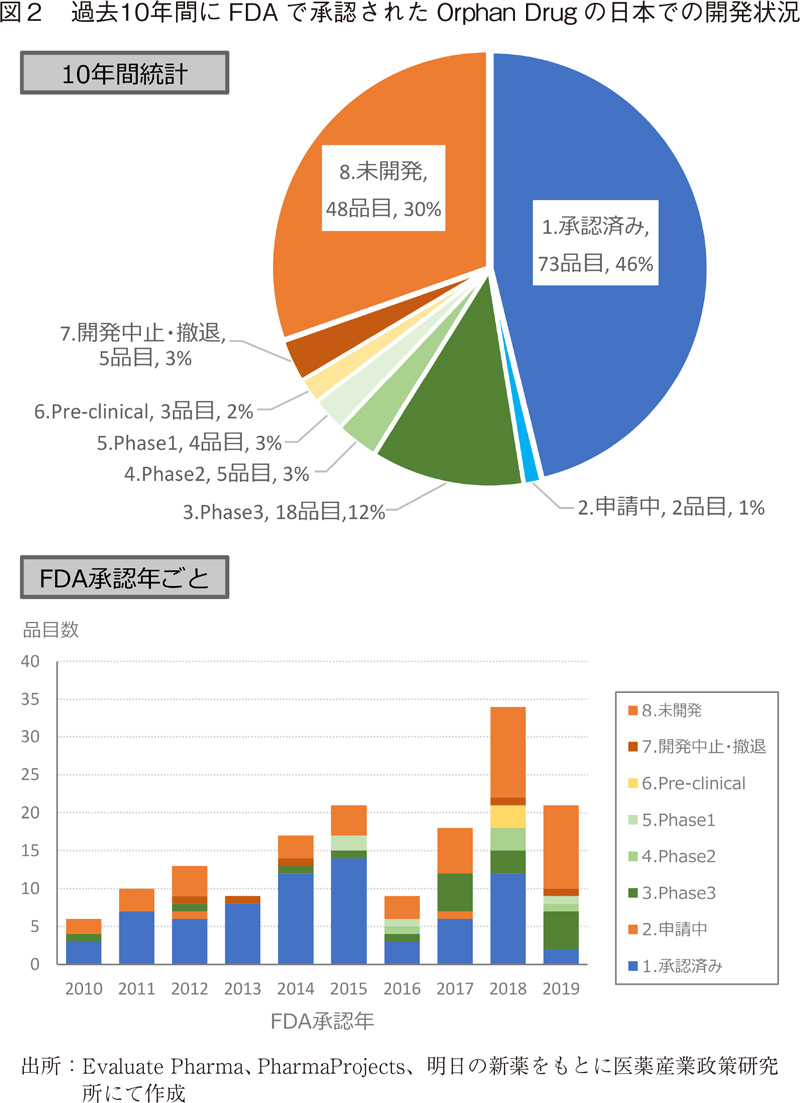
直近10年間(2010年~2019年)にFDAで承認されたOrphan Drug158品目について、日本での承認および開発状況を、Evaluate Pharma、PharmaProject、明日の新薬のデータベースを用い、調査した(図2)。2019年12月末現在、73品目(46%)3)が承認され、29品目(18%)が申請中あるいは臨床試験段階にある一方、48品目(30%)が日本での開発状況が確認されなかった。2018年、2019年はOrphan Drugの品目数は34品目、21品目と多いが、それぞれ12品目、11品目が日本で未開発であり、今後開発が開始される可能性はあるものの、日本で未開発のOrphan drugの割合は高くなっていた。
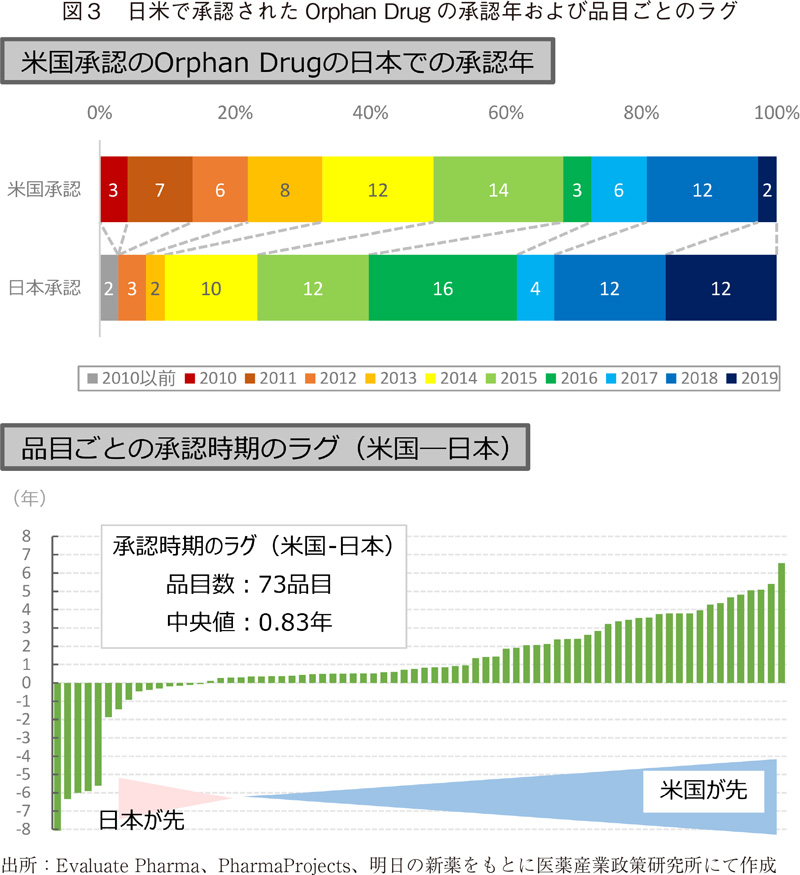
過去10年間にFDAで承認されたOrphan Drugの日本の承認時期とそのラグ
過去10年間(2010年~2019年)にFDAで承認されたOrphan Drug158品目のうち、日本でも承認されている72品目について、日米それぞれの承認時期と品目ごとのラグを示した(図3)。72品目中、日本の方が先に承認されたのは15品目(21%)4)で、残り58品目(79%)は米国が先に承認されていた。米国と日本の承認時期の差(中央値)は、0.83年5)であり、日本が米国より3年以上遅れている品目も19品目認められた。Orphan Drugの承認時期のラグを考慮すると、現在、日本で開発段階にある品目については、数年の間に、日本での承認申請等が行われることが予想された。
日本未開発のOrphan Drugの内訳
直近10年間(2010年~2019年)にFDAで承認されたOrphan Drug158品目のうち、日本の開発情報が確認されなかった48品目について、FDAが公開している効果効能をもとに、どのような疾患が多いのか調査した(表2)。その結果、日本で未開発の48品目のうち、遺伝性疾患が15品目(欧米と比較し日本人の患者が著しく少なく治験が実施できない等)、感染症・熱帯病11品目(マラリア等、日本ではほとんど発生しない感染症)の順に多かった。

日本未開発の医薬品の中には、日本で発生例がない、患者数が著しく少ない等で開発が困難な疾患も含まれており、これらの品目のすべてを米国と同様に開発することは困難であると考えられた。したがって、近年のFDAでの承認数の増加が必ずしも日本でのOrphan drugの承認数の増加につながるわけではないと考えられた。
まとめ
従来、難病、エイズ等を対象とする医薬品は、医療上の必要性が高いにもかかわらず、患者数が少ないこと等により、十分にその研究開発が進んでいなかったが、米国では1983年に、日本ではその10年後の1993年にOrphan drugの開発促進のための制度が法制化され、その後、製薬企業、規制当局が協力して、これらの医薬品の開発に取り組んできている。また、日本では、2010年より医療上の必要性の高い未承認薬・適応外薬検討会議を開催し、希少疾病を含め、医療上の必要性の高い未承認薬に対する開発促進(公知承認)の取り組みも実施し、これらの医薬品のドラッグラグ解消が進んできた。
今回、近年、日本と比べ米国でのOrphan drugの承認件数が多いことに注目し、米国で近年承認されたOrphan drugの内訳、日本での開発状況を調査した。その結果、過去10年間に米国で承認されたOrphan drugの約2/3が承認済みあるいは開発段階にあることがわかった。また、日本で未開発(開発情報が確認されない)の品目の中には日本での発生例がない、患者数が著しく少なく開発が困難な疾病も一部含まれていた。指定基準の違いもあり、今回の結果だけで結論を主張することは難しいが、日本で未開発のOrphan Drugの種類から考えると、日本では必ずしも米国と同じようにOrphan Drugが開発されるわけではないと考えられる。
一方で、これまで長年にわたり創薬を生み出すための貢献をしてきた成果もあり生活習慣病を中心に多くの疾患の治療満足度が飛躍的に増加してきた。それに加え、遺伝子技術をはじめとした技術革新が進み、高度かつ有用性の高い個別化医療も実現してきている。これらのことを鑑みると、アンメットメディカルニーズの高い希少難病に対する革新的な医薬品の創出が可能となり、それらの医薬品の開発が進むことは、米国だけでなく、日本を含む全世界の大きな流れとなっていくと予想される。
希少であるが故に、市場規模や臨床試験の実施可能性の問題は存在しているが、希少難病で苦しむ患者さんが、これらの疾病を改善する医薬品の創出を待ち望んでいるのも事実である。我々製薬企業としては、常に患者さんのことを第一に考え、これらの疾病を含み、世界の人々の健康に貢献する革新的な医薬品を創出する努力をしていくことが使命であろう。
-
1)医薬産業政策研究所.「日本における新薬の臨床開発と承認審査の実績」リサーチペーパー・シリーズ No.69(2016年11月)
-
2)医薬産業政策研究所.「新薬承認状況及び審査期間の日米欧比較-2018年承認実績を中心に-」政策研ニュース No.57(2018年11月).
-
3)日本で承認済みの73品目中、60品目が日本で希少疾病用医薬品の指定を受けている。
-
4)米国に対し日本が先行して承認された15品目のうち、14品目は日本も希少疾病用医薬品の指定を受けていたが、日本に患者数が多いといった特定の傾向は認めず、3年以上日本が先行している品目は、日本の企業が日本で先行して開発、特別な理由があり米国のみ遅れた品目(日欧が先行)等であった。
-
5)承認時期の差(中央値)を、日本での希少疾病用医薬品の指定の有無で分類すると、指定有(60品目)で0.74年、指定無(13品目)で0.95年であった。

