目で見る製薬産業 2019年に日本で承認された新医薬品とその審査期間
医薬産業政策研究所 主任研究員 澁口 朋之
主任研究員 粟村眞一朗
医薬産業政策研究所では、規制当局の公表情報をもとに、医薬品の承認情報および審査期間に関して継続的に収集、分析している1)。今回、2019年1~12月に日本で承認された新医薬品と新再生医療等製品の承認状況、およびその審査期間について調査したので、報告する。
研究方法
調査の対象は、PMDAのホームページの「新医薬品の承認品目一覧」2)に掲載されている医薬品とした。品目は審査報告書毎にカウントすることを基本とし、学会等からの要望により同一成分の品目を複数の企業が同時に公知申請したような場合や併用薬物療法等にて複数成分が承認されたものは1つの品目として集計した。各品目の承認情報は、審査報告書、新医薬品の承認品目一覧、添付文書および薬務公報から抽出した。解析には、標準的な統計解析ソフトStata/IC 14.0 for Windows(Stata Corp LP, College Station, TX, USA)を使用し、審査期間(申請日から承認日)を算出した。
新医薬品の承認品目数とその内訳
2010~2019年の10年間に日本で承認された新医薬品の承認品目数の年次推移を図1に示した。日本で2019年に承認された新医薬品の品目数は130品目で、2018年より21品目増加した。2010~2018年の平均承認品目数(116品目)より多い結果であった。そのうち、新有効成分含有医薬品(NME)は39品目が承認され、2018年と比較して2品目増加した。
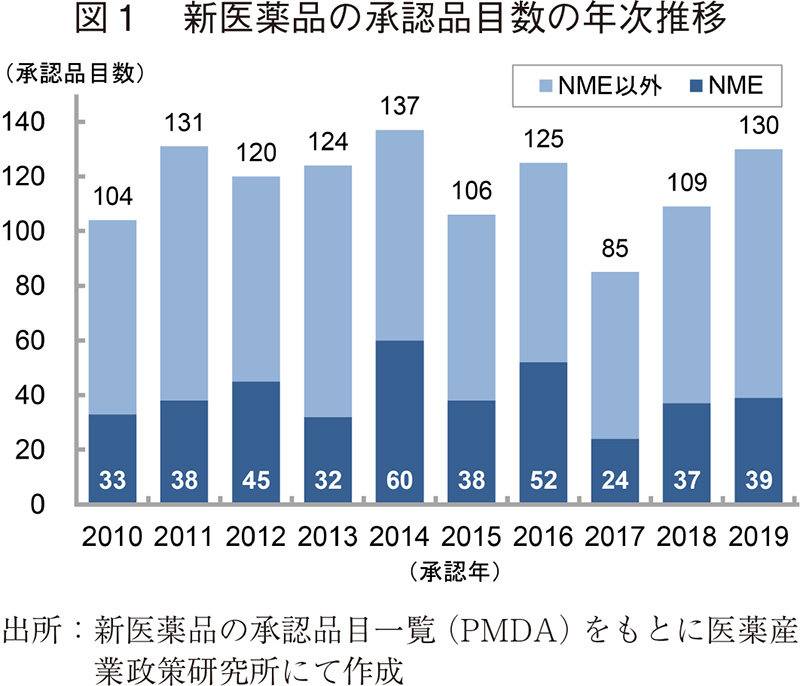
続いて、承認品目の内訳を表1に示した。申請区分別の内訳では、2019年は前述のNMEの他、新効能医薬品は45品目、新用量医薬品は18品目であり、この数値は2018年より増加した。また、バイオ後続品(バイオシミラー)が8品目3)と、2018年と比較して2品目増加し、これまでで最も多かった。
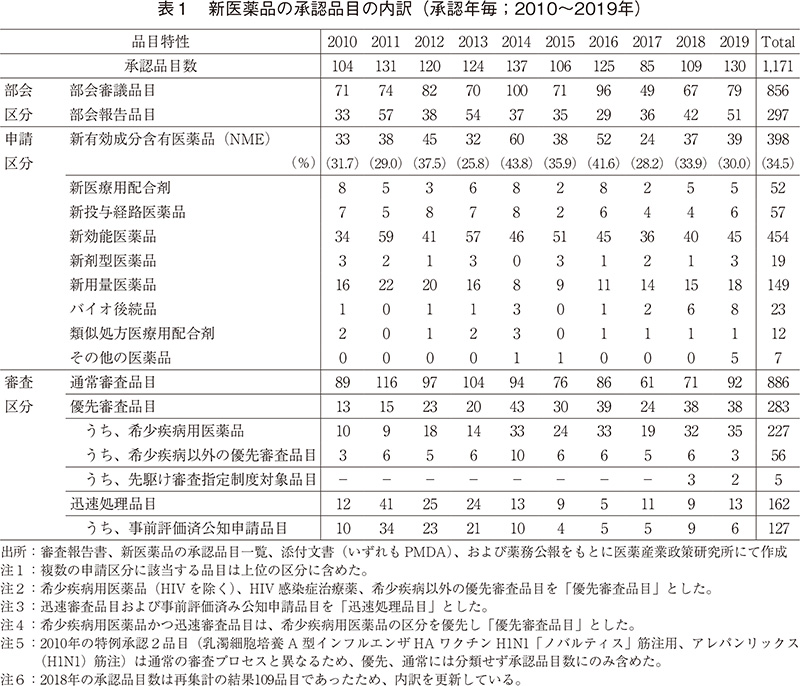
審査区分別の内訳では、通常審査品目が92品目、優先審査品目は38品目であった。優先審査品目が全承認品目に占める割合は29%であり、2014年以降は高い水準(30%前後)で推移していた。また、優先審査品目のうち、希少疾病用医薬品が35品目であり、2018年と比較し、3品目増加した。希少疾病用医薬品は2014年以降増加し、20~30品目前後で推移しているが、2019年は35品目とこれまでで最も多かった(図2)。
新医薬品の審査期間
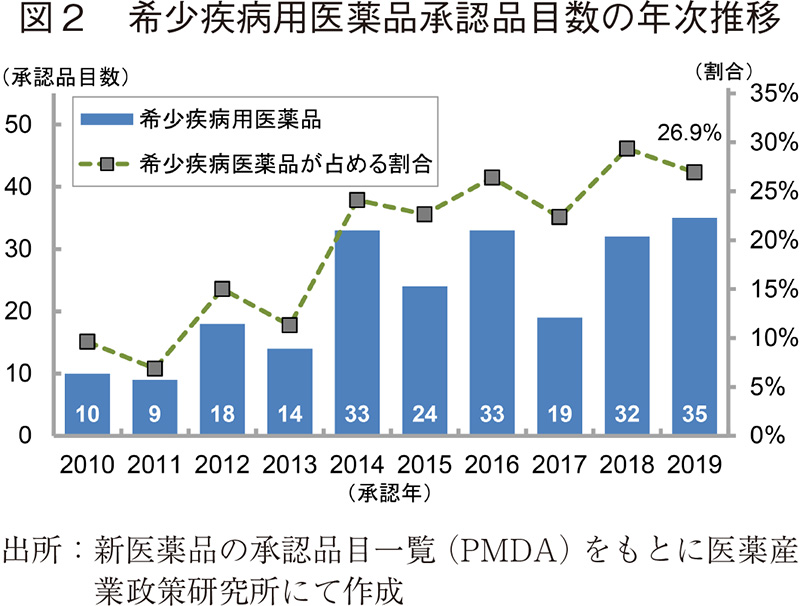
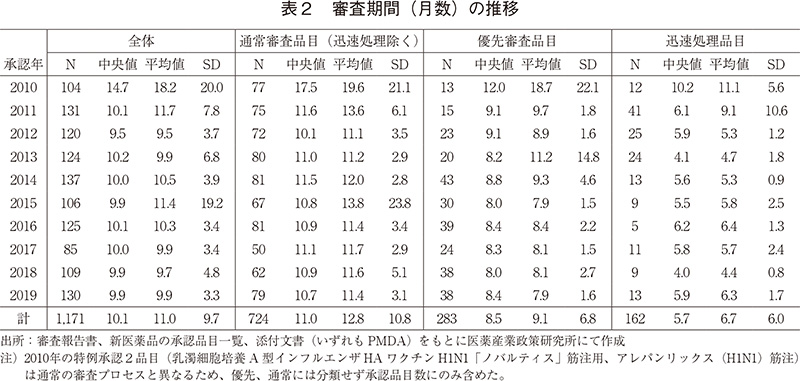
2010~2019年に承認された新医薬品の審査期間の年次推移を図3および表2に示した。
2019年に承認された全130品目の審査期間の中央値は9.9ヶ月と、2018年と同様で、審査期間が大幅に短縮した2011年以降10ヶ月前後でばらつき少なく推移していた。審査区分別で見てみると、審査期間の中央値は迅速処理品目を除いた通常審査品目では10.7月、優先審査品目では8.4ヶ月であり、こちらも2011年以降の審査期間と同様であった。なお、通常審査品目(迅速処理除く)における審査期間の80パーセンタイルは11.8ヶ月であり、目標値とされる12ヶ月以内4)に承認されていた。また、優先品目における審査期間の80パーセンタイルは8.7ヶ月であり、こちらも目標値とされる9ヶ月以内4)に承認されていることが確認できた。
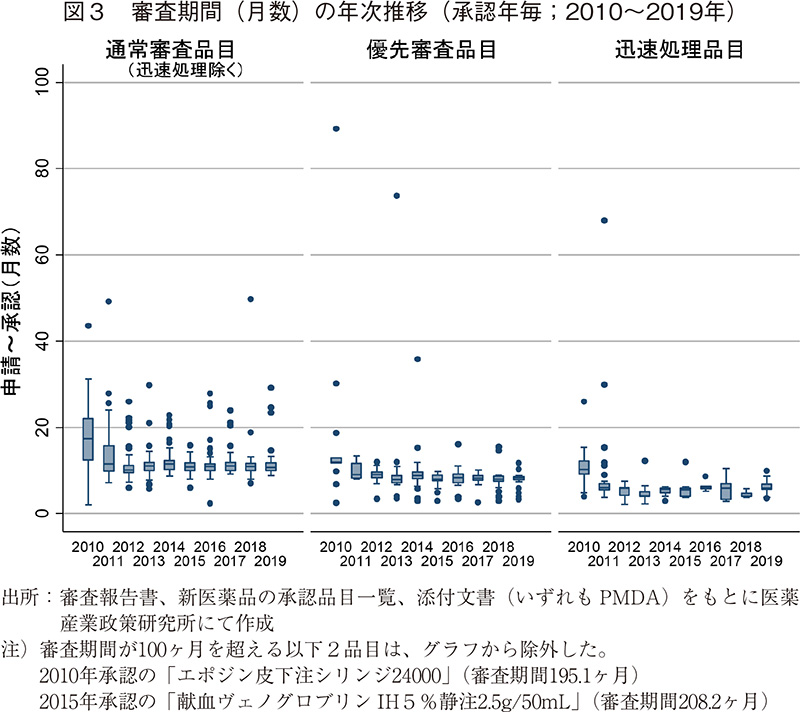
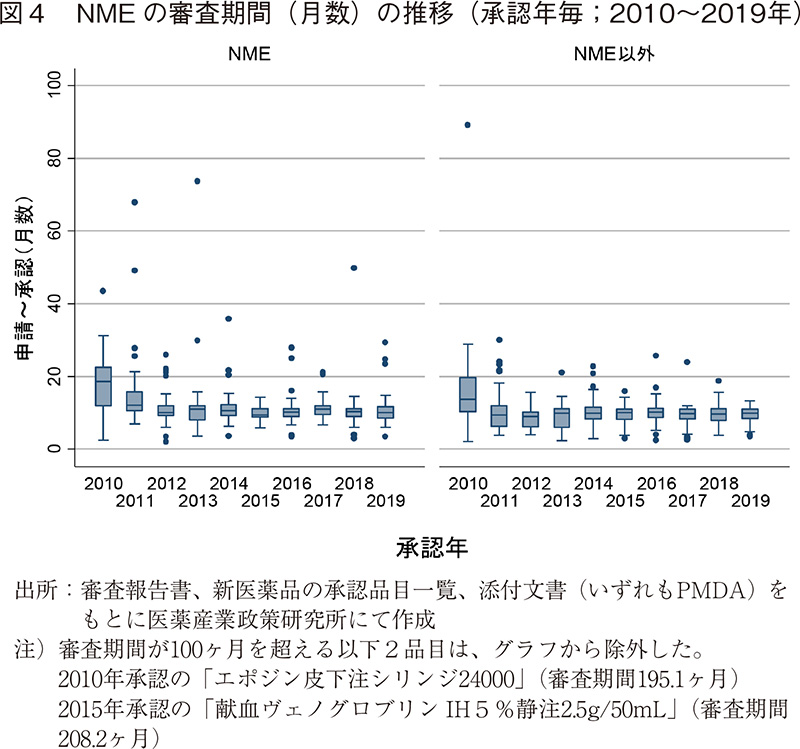
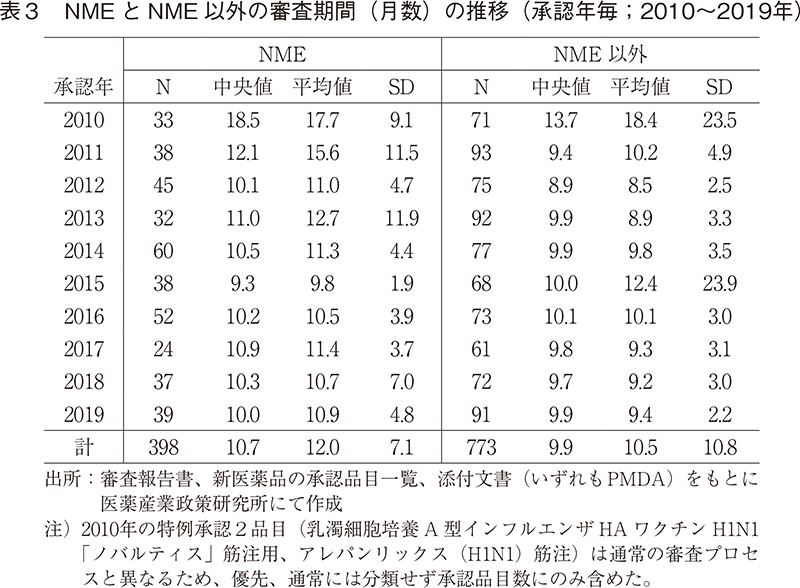
つづいて、NMEのみに限定した場合の審査期間の年次推移について、図4および表3に示した。2019年に承認されたNME39品目の審査期間の中央値は10.0ヶ月であり、2018年よりも0.3ヶ月短かった。NME以外の品目は9.9ヶ月となっており、2018年よりも0.2ヶ月長かった。NMEの中には一部審査期間がかかってしまう品目があるものの、その審査期間の中央値はNME以外の品目とほぼ同じであった。
新有効成分含有医薬品(NME)に関する分析
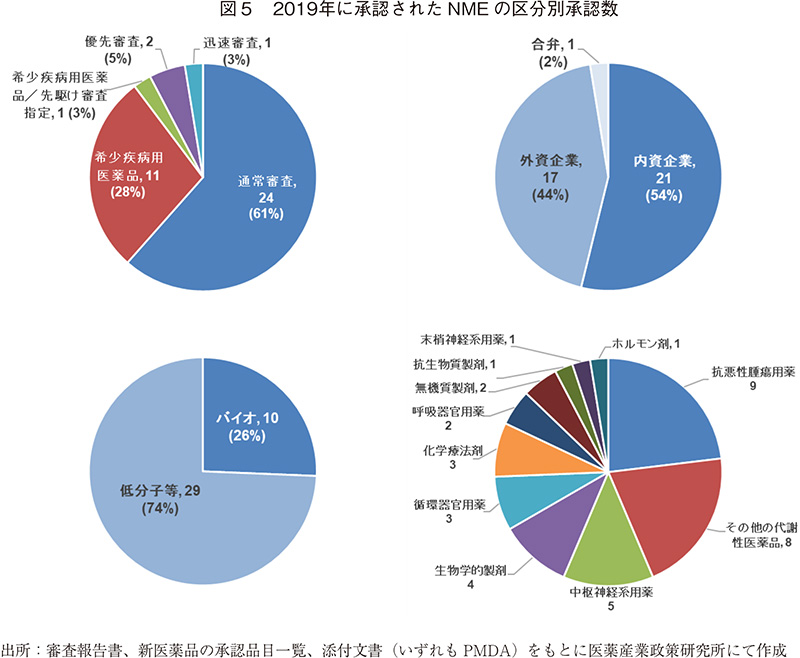
2019年に承認されたNME(39品目)の内訳に関して調査した。NMEの審査区分では、通常審査品目が24品目(61%)、希少疾病用医薬品(優先審査品目、先駆け審査指定品目含む)が12品目(31%)、希少疾病用医薬品以外の優先審査品目が2品目(5%)である。
NMEの申請企業を内外資企業別に見ると、内資企業のNMEは21品目(54%)、外資企業のNMEは17品目(44%)であり、例年に比べ内資企業の品目割合が多く、また承認数も外資企業より多い結果であった。2019年承認のバイオ医薬品のNMEは10品目であり、全NMEの26%を占めていた。そのうち、抗体医薬品が5品目あり、内資企業品目は2品目(合弁含む)である。薬効分類別では、抗悪性腫瘍用薬が最も多く9品目と約23%を占めていた。また、その他の代謝性医薬品は8品目、中枢神経系用薬5品目、生物学的製剤4品目、循環器官用薬3品目、化学療法剤3品目の順で多く承認されている。
先駆け審査指定制度の対象品目の承認
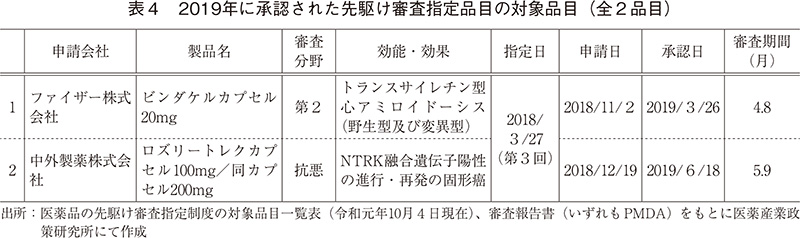
先駆け審査指定制度の対象品目として、2019年は2品目承認された(承認順に、ビンダケルカプセル、ロズリートレクカプセル:表4)。それらの品目の審査期間はそれぞれ4.8ヶ月、5.9ヶ月であり、優先審査品目の審査期間の中央値7.7ヶ月と比較して非常に短かった。先駆け審査指定制度の対象品目における特別措置の1つである優先審査については、承認申請から承認までの総審査期間の目標値を6ヶ月と設定されている4)が、2019年に承認された2品目はその目標期間の中で承認が行われていることが確認された。
新再生医療等製品の承認とその審査期間
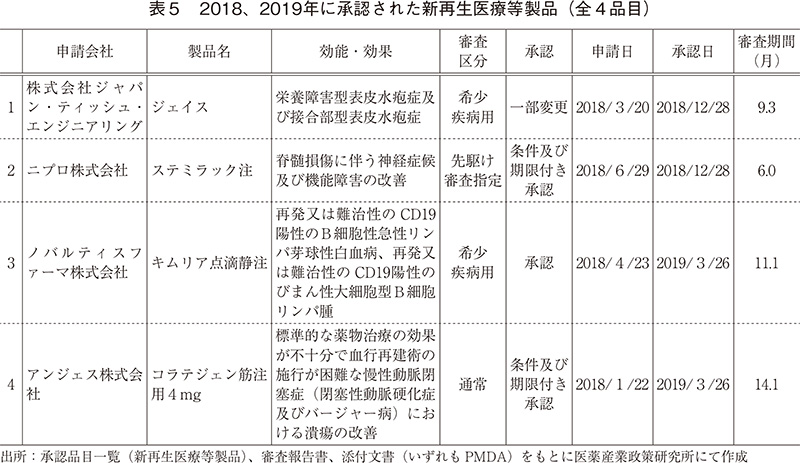
ここからは近年承認された新再生医療等製品の承認品目とその審査期間について紹介する(表5)。
2018年は、自家培養表皮ジェイスの効果・効能追加、および脊髄損傷に対する初の再生医療等製品であるステミラック注が承認された。2019年は、国内で初めてのCAR-T細胞療法であるキムリア点滴静注、および国内で初めての遺伝子治療用製品としてコラテジェン筋注用の2品目が承認された。なお、ステミラック注は7年間、コラテジェン筋注用は5年間の期限付き・条件付きでの承認となっている。それらの審査期間はそれぞれ9.3ヶ月、6.0ヶ月、11.1ヶ月、14.1ヶ月であった。先駆け審査指定制度の対象品目の審査期間の目標値は6ヶ月、また再生医療等製品における審査期間の目標値として優先品目では全品目の50%を9ヶ月以内、通常品目では50%を12ヶ月以内に処理4)、とされており、いずれも目標値に近い期間で承認されていることが確認できた。
おわりに
日本で2019年に新医薬品として承認された130品目について審査区分別にその審査期間の調査を行い、審査期間が大幅に短縮された2011年以降と同様の審査期間を維持していたことが確認できた。また、先駆け審査指定制度の対象品目に関しては医薬品および再生医療等製品共に前年と同様の迅速な審査が行われていた。
2019年11月に改正薬機法が成立し、2015年から試行的に運用されている先駆け審査指定制度、および条件付き早期承認制度が法制化された。遺伝子治療薬の登場など治療モダリティが多様化する中、革新的な医薬品や再生医療等製品が世界に先駆けて日本で申請および承認され、いち早く患者のもとに届くことを期待したい。
補足
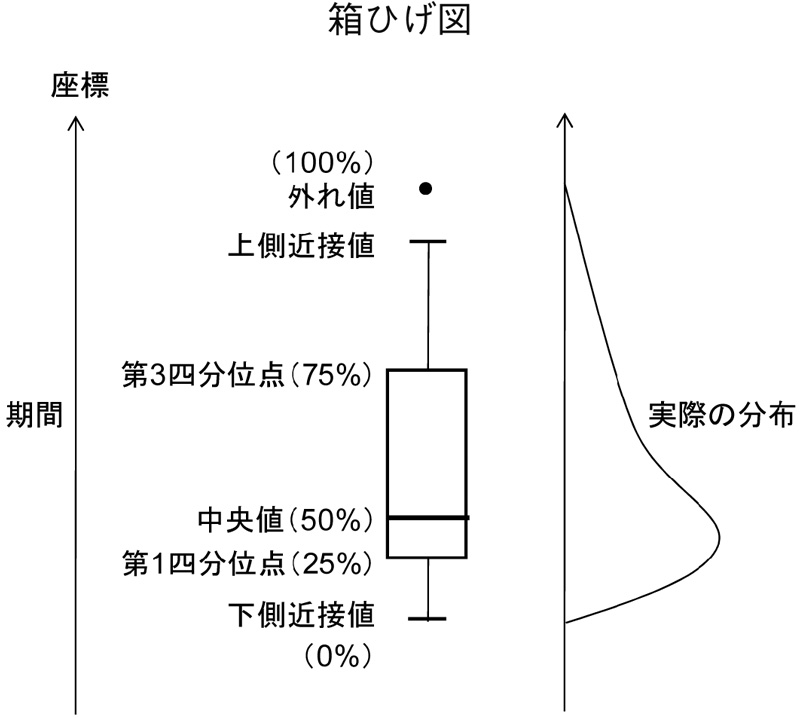
期間が著しく長い品目や特例により短い品目が存在することから、主たる基本統計量は中央値とし、サンプル数(N)、平均値、標準偏差(SD)を併記した。また、図3、図4は、データの分布がわかるよう箱ひげ図で示した。箱ひげ図の箱の中央の線は中央値(50%)、箱の下端、上端の線はそれぞれ第1四分位点(25%)、第3四分位点(75%)を示している。すなわち、100個のサンプルがあった場合、25番目のサンプルの値が第1四分位点、50番目が中央値、75番目が第3四分位点となる。箱の上下の近接値(ひげ)は箱の高さ(第1四分位点~第3四分位点の長さ)の1.5倍以内で中央値から最も離れているサンプルを示している。近接値外にある外れ値は点として示される。
-
1)医薬産業政策研究所.「日本における新薬の臨床開発と承認審査の実績」リサーチペーパー・シリーズ No.69(2016年11月)
-
2)
PMDAホームページ「新医薬品の承認品目一覧」 Accessed on Jan. 17th, 2020
-
3)2019年はバイオ後続品(申請区分)として、ダルベポエチンアルファ3品目、ベバシズマブ2品目、エタネルセプト1品目、リツキシマブ1品目、テリパラチド1品目が承認されている。なお、腎性貧血治療薬ダルベポエチンアルファの後発品(協和キリンフロンティア)は先行品と全く同じ条件で製造されたバイオ医薬品(バイオセイム)であり、バイオ後続品としてではなく、通常の後発医薬品(オーソライズジェネリック)として承認を受けているため、本集計に含まれていない。
-
4)

