Points of View 臨床開発における治験対照群の利活用
医薬産業政策研究所 主任研究員 中塚靖彦
1. はじめに
製薬産業では、医療機関において取得されるヒトを対象とした「医療データ」を様々な目的で活用することを検討している。例えば創薬研究においては、ターゲット探索やバイオマーカー探索などへの活用、臨床開発では治験のフィジビリティ調査や患者リクルートなどへの活用、Real World Data(RWD)1)による患者の層別化や治験対照群としての利用、RWDを解析した適応追加への応用も期待されている。市販後調査(Post Marketing Surveillance:PMS)ではMID-NETを活用した安全性情報の収集など既にRWDを使用した動きが進んでいる。
また、臨床開発においてもRWDの利活用に向けた動きが進み始めている。(詳細は日本製薬工業協会 医薬品評価委員会 臨床評価部会より2019年4月に発出された『既存の国内リアルワールドデータを医薬品開発にどこまで活用できるか』2)に日本での現状も含め詳細に記載されているためそちらを参照されたい。)また、公益財団法人ヒューマンサイエンス振興財団からも2019年3月に『医療リアルワールドの利活用』3)と題し、臨床研究に医療リアルワールドをいかに活用するか取り纏められている。
RWDを医薬品開発に活用することは臨床開発の効率化、開発費用の削減に繋げられることが期待されており、RWDを利活用すべく、欧米や日本といった新医薬品創出国などにおいて施策や対応方法が検討されている。本稿では医薬品開発のRWD利活用の1つのテーマでもある「治験対照群」を臨床開発に活用する取り組みを中心に紹介したい。
2. 米国の政策・ガイダンス
米国では2016年12月に21st Century Cures Act4)を制定し、モバイル医療アプリや関連するデジタルヘルスケア製品等の技術について食品医薬品局(FDA)の規制範囲や対応の明確化を図った。また、承認規制の緩和化としてReal World Evidence(RWE)5)の積極的な活用を推奨し、RWEを用いた評価方法についてのサポートをFDAに義務付けた。そのような背景により、FDAは2017年8月に医療機器開発におけるRWDの積極的な使用を推奨し6)、さらに2018年12月には「Real-world evidence program」7)を発出し、希少疾患およびがん領域において医薬品の有効性等の判断にRWEを活用することを推奨している。2019年5月には「Submitting Documents Using Real-World Data and Real-World Evidence to FDA for Drugs and Biologics(医薬品および生物製剤に関するリアルワールドデータおよびリアルワールドエビデンスを利用した文書のFDAへの申請-産業界のためのガイダンス)」8)のドラフト版を公表し、パブリックコメントの募集を開始している。今回のガイダンスはRWEを活用する医薬品の申請者が規制当局への承認申請時に、RWEの使用に関する情報を統一フォーマットに記載し、FDAに提供することを目的としている。
RWEの使用に関し記載される内容として以下の3項目が例示として挙げられている。
- A
- 承認申請の一部としてRWEを利用する目的
- B
- RWEを使用した試験デザイン
- C
- RWEを生成に使用したRWDのsource
このように米国ではRWD、RWEを活用するために国としての施策を制定し、様々なガイダンスを発出している。
3. RWD利活用に向けた日本の規制動向
日本国内においても、未来投資戦略20189)、経済財政運営と改革の基本方針(骨太の方針2019))10)にRWDの利活用が謳われており、「クリニカル・イノベーション・ネットワーク(CIN)11)」と医薬品医療機器総合機構(PMDA)の医療情報データベース(MID-NET)12)を連携させ、医薬品の開発から安全対策までの一連の過程で、より大規模なRWDの利活用推進を行うこととしている。また、厚生労働省からも医薬品の開発におけるRWDの利活用については「改正GPSP省令13)」、「製造販売後の医薬品安全性監視における医療情報データベースの利用に関する基本的な考え方14)」などの省令や通知を発出している。PMDAもレジストリの利活用を前提とした臨床試験計画の考え方や、レジストリの質向上・信頼性確保のための相談枠を設置している。この相談は2019年度に試行的に実施することとしており15)、国としてRWDの利活用を積極的に推進しようとしていることが分かる。また、PMDAはレジストリデータを承認申請などに用いるための基本的な考え方や、データの信頼性に関する留意点等が記載されたガイドライン案を2019年度に作成し、2020年度に公表することを予定している。
4. ヒストリカルコントロール16)の利用状況
日米ともにRWDを利活用するべくガイドライン、ガイダンスの作成に取り掛かっているが、実際、ヒストリカルコントロールを臨床試験に活用した試験はどのくらい実施されているのだろうか。前述の日本製薬工業協会がまとめた報告書(「既存の国内リアルワールドデータを医薬品開発にどこまで活用できるか」2))で使用された表1の検索条件を元に、ClinicalTrial.govで2019年9月30日に検索を行ったところ51件(現在実施されている試験)が該当した。
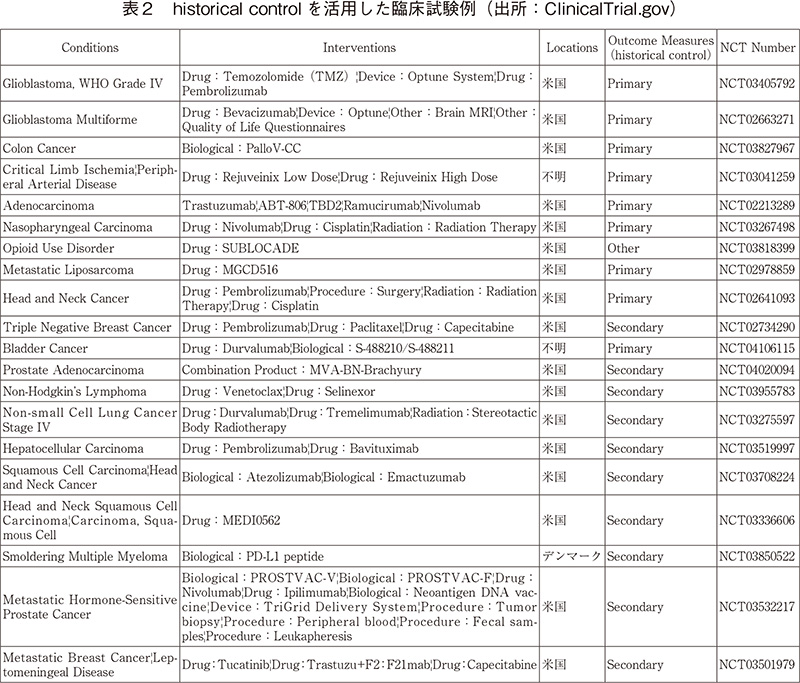
さらにOutcome指標historical controlを対照として設定している試験は20件あった。なお内訳として、Primary Outcome Measures 9件、Secondary Outcome Measures10件、Other Outcome Measures1件であった。(表2)
そのうち、米国で実施されている試験は17件で、残りはデンマーク1件、不明2件であった。米国での実施状況として、RWDを臨床試験に取り入れて試験を実施していることがうかがえる。ClinicalTrial.govの登録上、日本国内で実施されている試験はなかった。
また、実施されている臨床試験の対象疾患としては、がん18件、オピオイド使用障害1件、重症肢虚血1件であり、がんでの実施が多いことがわかる。がん種としては咽頭がん、乳がん、結腸がん、膀胱がん、非小細胞肺がん、B細胞リンパ腫など希少がんだけではなく様々ながん種でhistorical controlを使用した臨床試験が実施されている。
5. 治験対照群を活用する動き
5-1 Flatiron Health社の事例(民間企業)
Flatiron Health社は、がん領域に特化したクラウドベースの電子カルテである「OncoEMR」を保持・運用し、がん患者やその治療にあたる医師向けに、治療や研究開発に活用できるデータプラットフォームを提供しているベンダーである。2018年にスイスRoche社の傘下に入ったが、Flatiron-EHRsに関わるビジネスに関してはRoche社から独立しており、EHRデータベースに関するサービスは、Roche社以外にも提供が可能となっている。本プラットフォーム上では約200万人のがん患者の匿名化された膨大な症例の臨床データを活用することができる。
同社のデータベースを利用して、2019年4月にPalbociclibが「男性乳癌」での適応拡大17)、2019年8月にEntrectinibが「ROS1融合遺伝子陽性の局所進行又は転移性非小細胞肺癌(ROS1(+)NSCLC)」での適応18)をFDAより取得した実績がある。
Palbociclib(男性乳癌)の申請の際に用いられたデータはFlatironのデータベースだけでなく、IQVIA Insurance database、Pfizer社のglobal safety databaseと3つのRWDデータが適応拡大の根拠データとして利用された。FDAは「RWDの腫瘍縮小効果と安全性データ」を比較対照群に用いたとしている。また、Entrectinib(ROS1(+)NSCLC)で使用されたデータは非小細胞肺がんの治療薬であるCrizotinibが使用された被験者データをFlatironのデータベースより分析抽出し、承認申請時の根拠情報として用いられた。
承認申請時の根拠情報として使用されるためには、データの質19)、すなわちデータの「完全性」「一貫性」、「正確性」の点を確保することが求められる。Flatiron社が有しているデータベースはどのようにデータの質を担保しているのだろうか。まず、Flatiron社が有しているデータベースはデータベース構築にあたり、下記のような「データの質」が確保された臨床データを取得するための手順書が定められている。
Flatiron社のプラットフォームを構成する「OncoEMR」20)は、がん疾患に特化したクラウドベースの電子カルテであり、がん治療を行っている275カ所の医療機関をカバーしている。各医療機関に導入された「OncoEMR」によって、臨床検査値や血圧のような元々構造化されているデータは「OncoEMR」内で標準化可能となり、データベースとして一貫したデータが蓄積されることとなる。「OncoEMR」の医療情報には構造化されていないサマリーなど医師の記述があるが、そのような非構造化データを構造化するために、各医療機関にデータの品質を保つためのトレーニングを実施した「アブストラクター」と呼ばれる担当者を置き、本担当者が、構造化されていない臨床情報の中で構造化が必要な情報(例えばテキストデータから得られるがんのステージなど)を構造化するための作業を行っている。
このような手順に則った作業により、承認申請に利用可能な医療データベースの構築が行われている21)。
5-2 Medidata社の事例(民間企業)
Medidata社は、現在までにMedidata社のRave EDC(Electronic Data Capture)システムを使用した3000試験以上のプラットフォームに蓄積された対照群データの中から、新たに実施する急性骨髄性白血病を対象疾患とした臨床試験の条件に該当する個々の患者データをマッチングして合成対照群(Synthesis Control Arm:SCA)を作成する取り組みを行っている22)。
同社では、過去に実施された非肺小細胞がんを対象としたランダム化比較試験に関して、本プラットフォームを使用して作成したSCAのアウトカムデータを実際の比較対照群のデータと比較検証した結果、同等であることを証明している23)。本事例は既存のRWDとは異なり、各製薬企業がMedidata社のRaveを使用し実施した臨床試験データがデータベースとなる。Medidata社が各々のデータベースを統合し、様々な疾患での合成対照群を作成するものである。臨床試験データを使用しているため匿名化済みのデータとなる。臨床試験データを用いることにより「データの質」の観点からは、承認申請に使用できる十分な品質を有していることが予想される。また、取得するOutcomeの内容が規定・統一されているような疾患であれば、臨床試験で必要となるOutcomeデータの取得も可能であることが予想される。
5-3 対照群の実用可能性検証
2019年2月、FDAとFlatiron Health社は2016年に締結した医療健康電子記録(EHR)から得られるがんのRWDを活用する共同研究について拡大することを公表した。
さらに2019年4月、FDAと米Brigham and Women's Hospitalは7つの進行中の第IV相試験(Randomized Clinical Trial:RCT)の結果を予測するためにRWEを使用した実証プロジェクト(RCT DUPLICATE project)を実施することを発表した。24)本プロジェクトは、まだ結論が出ていない第IV相試験であるRCTが完了する前にRWE(保険データベース、電子診療記録など)より試験結果を予測し、RCTの結果とRWEで解析した予測結果との検証を行い、同じような判断が導けるかを検証するものである。
2019年半ばに中間結果、2020年末に最終結果を報告する予定となっている。
FDAが民間企業と連携してRWEを活用することでRCTの代替として利用可能か否かを積極的に検証していることからも、これらの検証からRCTへの代替が可能と判断できる良好な結果が得られた場合には、一定の条件下でRWEがRCTに代替する流れがおこるだろう。
5. まとめ
実際にヒストリカルデータを使用していた臨床試験の対象疾患はがん疾患が主であり、希少疾患も含め今後もヒストリカルコントロールを利活用する試験が増えてくることが予想される。このような背景にはがん疾患・希少疾患の臨床試験においては比較対照にプラセボを用いることが困難であること、また希少疾患(希少がん疾患含む)の場合には対象となる被験者数が少なく臨床試験内に対照群を設定することが困難であることが考えられる。ただし、既存のRWDを用い治験対照群として承認申請データの根拠資料として活用する場合には、RWDの質(一貫性、完全性、正確性の観点)、Outcomeデータの取得可能性、バイアスの影響等、様々な課題点があり、既存のRWDを活用することは難しい。
わが国では治験対照群の活用として、CINのレジストリ活用を推進することが提案されているが、医薬産業政策研究所発出の「医療健康分野のビッグデータ活用研究会報告書Vol.3」25)において、2次利用に適した疾患レジストリの構築・活用促進として電子カルテテンプレートを活用した診療データの構築・活用を提言している。疾患レジストリ活用も視野に入れつつ、Flatiron社のような信頼性の高いデータを取得できる統一されたプラットフォーム(電子カルテ等)の構築を、民間企業等も含め検討することも必要であると考える。そのようなデータベースを構築することにより治験対照群の利活用が進むのであれば、製薬企業にとっては治験の費用、治験に費やす時間の削減に繋げられ、さらにはRCTにおけるプラセボ投与に割り当てられる被験者をなくすことが期待できる。
-
1)RWD:診療録(電子カルテデータ)、健診データなど実診療行為に基づく二次利用可能な電子的データ
-
2)日本製薬工業協会 医薬品評価委員会 臨床評価部会「既存の国内リアルワールドデータを医薬品開発にどこまで活用できるか」
-
3)公益財団法人ヒューマンサイエンス振興財団「医療リアルワールドの利活用」
-
4)21st Century Cures Act(2019/9/30参照)
-
5)RWE:RWDを元に様々な手法(解析等)を適用して導き出されたエビデンス
-
6)
-
7)
-
8)
-
9)
-
10)
-
11)
-
12)MID-NET(2019/9/30参照)
-
13)
-
14)
-
15)
-
16)ヒストリカルコントロールとは、既存臨床試験データを新規試験の対照群として設定するもの
-
17)
-
18)
-
19)データの質については日本製薬工業協会が公表している「RWD:「データの質」に関する考察』を参照
-
20)https://flatiron.com/oncology/oncology-ehr/(2019/9/30参照)
-
21)第27回抗悪性腫瘍薬開発フォーラム『抗がん剤開発におけるリアルワールドデータの活用』 講演内容より
-
22)
-
23)
-
24)https://www.rctduplicate.org/(2019/9/30参照)
-
25)医薬産業政策研究所.「医療健康分野のビッグデータ活用研究会報告書Vol.3」(2018年5月)

