くすりは誰が、どこで、どのようにしてつくっているのかなど、くすりができる過程をご紹介します。

新しいくすり、すなわち「新薬」は、長い研究開発期間をかけて、新しい成分の有効性・安全性が確認された後、国の承認(しょうにん)を受けて発売されます。
日本において、「新薬」を1つ開発するには、約9~16年もの時間と、多額の費用がかかると言われています。それだけ費やしても、新薬の開発の成功率は約31,000分の1(※)しかありません。新薬を開発した製薬企業には、発売後も調査を続けて一定期間経った後に、有効性・安全性について再確認することが義務(ぎむ)付けられています(再審査(さいしんさ))。 ※出典「製薬協ガイド2025」
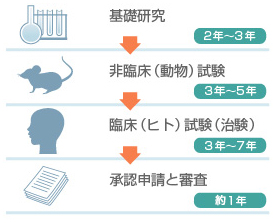

約9~16年の長い時間と多額の費用が必要です。

くすりのモトとなる新しい物質の発見と製造
くすりの開発は、将来くすりとなる可能性のある新しい物質(成分)を発見したり、化学的につくり出すための研究から始まります。 くすりのモトは、天然素材(植物・動物・微生物(びせいぶつ)など)から発見したり、2つ以上の物質を組み合わせてつくり出したり、さまざまな科学技術を用いてつくられます。
さらに新しい物質を時間をかけて調べ、ふるいにかけて、くすりになりそうなものだけを選び取ります。


-
 免疫抑制剤(めんえきよくせいざい)の開発により、臓器移植(ぞうきいしょく)の成功率が飛躍的(ひやくてき)に高まりました。
免疫抑制剤(めんえきよくせいざい)の開発により、臓器移植(ぞうきいしょく)の成功率が飛躍的(ひやくてき)に高まりました。 -
 アルツハイマー病の進行を遅らせるくすりが開発され、介護に要する労力・費用が軽減されました。
アルツハイマー病の進行を遅らせるくすりが開発され、介護に要する労力・費用が軽減されました。 -
 生物がつくり出すたんぱく質を利用することで、関節リウマチ治療(ちりょう)に新しい選択肢が増え、患者(かんじゃ)さんの生活の質(QOL※)が改善されました。 ※QOL:Quality of Life
生物がつくり出すたんぱく質を利用することで、関節リウマチ治療(ちりょう)に新しい選択肢が増え、患者(かんじゃ)さんの生活の質(QOL※)が改善されました。 ※QOL:Quality of Life
くすりのモトは、植物や微生物(びせいぶつ)などの天然素材から発見したり、科学技術を使ってつくり出したりしています。

新規物質の有効性と安全性の研究
くすりとして可能性のある物質を、動物や培養細胞(ばいようさいぼう)を用いて試験し、有効性と安全性を研究します。
また、くすりのモトの吸収・分布(ぶんぷ)・代謝(たいしゃ)・排泄(はいせつ)の過程(かてい)や、品質、安定性に関する試験も行います。


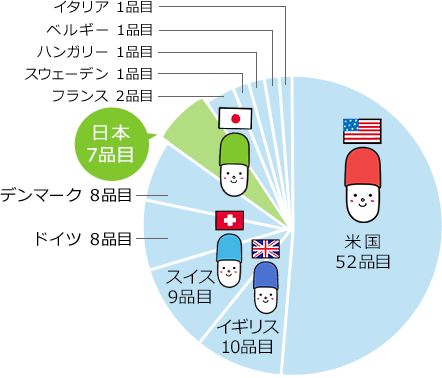
日本は世界で第6位の新薬創出国!
出所:Copyright©2025 IQVIA. IQVIA World Review Analyst, Data Period 2023, IQVIA Pipeline & New Product Intelligence, Evaluate Pharma®(2024年11月時点)、Clarivate Cortellis Competitive Intelligenceをもとに医薬産業政策研究所にて作成(無断転載禁止)
出典:医薬産業政策研究所 政策研ニュースNo.74(2025年3月)
注:特許帰属企業の国籍による分類
くすりのモトを、動物や培養(ばいよう)した細胞(さいぼう)に使用して、効き目と安全性を調べる試験を非臨床試験(ひりんしょうしけん) 、ヒトに使用して調べる試験を臨床試験(りんしょうしけん)といいます。
臨床試験(りんしょうしけん)については、新薬開発のステップ(3)を見てくださいね。

ヒトを対象とした有効性と安全性のテスト
必要な非臨床試験(ひりんしょうしけん)を通過したくすりの候補(治験薬(ちけんやく))が、安全で実際にヒトに効果があるかどうかを調べる最終的な確認が臨床試験(りんしょうしけん)(治験(ちけん))です。
治験(ちけん)は、さまざまな段階で法律(ほうりつ)にしたがい、多くの専門家による検討や審査(しんさ)にもとづいておこなわれます。
治験(ちけん)に先だって医療機関(いりょうきかん)は、治験(ちけん)に協力していただく患者(かんじゃ)さんには文書を用いて詳しく説明をしたうえで、内容を十分に理解していただき、文書による同意を得ることが義務(ぎむ)づけられています(インフォームドコンセントといいます)。


-
 対象:
対象:
少数の健康な人/副作用などの安全性について確認します -
 対象:
対象:
少数の患者(かんじゃ)さん/有効で安全な投与量・投与方法などを確認します -
 対象:
対象:
多数の患者さん/有効性と安全性について今まで使われてきた基準となるくすりなどとの比較をおこないます
治験(ちけん)はGCP(※)といわれる厳(きび)しい基準に基づいて実施されます。 ※GCP:Good Clinical Practice(医薬品の臨床試験の実施の基準)

厚生労働省への承認申請と専門家による審査
各種試験で有効性、安全性、品質などが証明(しょうめい)されたあとに、厚生労働省に新薬として製造・販売(はんばい)するための許可がもらえるように届けを出します。
そのあと、学識経験者(がくしきけいけんしゃ)などで構成する薬事・食品衛生審議会(やくじ・しょくひんえいせいしんぎかい)などの審査を受け、「くすり」としてみとめられると、製造・販売(はんばい)することができます。


くすりとして発売されたあとも、さまざまなチェックを受けて、より安全でより使いやすいくすりへの改善が行われます。