くすりの情報Q&A Q52.製薬産業は「未承認薬(みしょうにんやく)」に、どのように取り組んでいますか。
回答
日本製薬工業協会は、「未承認薬」を開発する企業を支援する組織を立ち上げ、日本では未使用のくすりを使用できるように積極的に取り組んでいます。
解説
「未承認薬」とは、海外で承認されていながら、日本では承認されていないくすりのことです。
また、日本で医薬品として承認され使用されているくすりでも、海外で認められている使い方(適応症)が認められていない場合があります。これを「未承認適応(適応外使用)」といい、未承認薬と同じように患者さんにとって大きな問題となっています。
現在、未承認薬を使用したい場合は、個人で輸入する必要があり、それにかかわる費用は個人負担となります。
また病院で未承認薬による治療を受けた場合、本来医療機関が保険請求できる薬剤費・診察料・検査料もすべて保険請求ができなくなります。その場合は、治療にかかったすべての費用を全額自己負担しなければならないこともあります。さらに、未承認薬を使って万一副作用が出た場合は、国の医薬品副作用被害救済制度(Q13参照)は適用されません。
このように未承認薬を使えず治療ができないという問題に加え、それを使う時でも大きな費用負担の問題を抱えています。
一方、未承認薬の中には患者さんの数がごく限られているものもあり、臨床試験の実施に長い時間と多額の研究開発費用がかかるため、製薬企業1社では負担が大きく対応できないこともあります。
このように未承認薬の問題にはさまざまな要素が複雑にからんでいるため、産官学の連携による問題解決に向けた対策が必要不可欠です。
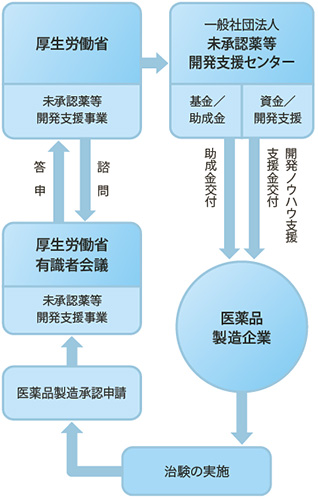
そこで日本製薬工業協会はこのような問題を解決するため、プロジェクトを設置して検討を重ね、2009年に「一般社団法人未承認薬等開発支援センター」を立ち上げました。同センターは、未承認薬の開発に取り組む企業に対して、その研究開発から製造販売までの各段階において、専門的・技術的な支援・アドバイスや研究開発資金の援助をおこなっています。(2013年3月末現在、14品目の開発を支援)
一方で、2010年4月から、新薬創出・適応外薬解消等促進加算が試行的に導入されるとともに、厚生労働省では、「医療上必要性の高い未承認薬・適応外薬検討会議」が設置されました。本検討会では未承認薬・適応外薬について、医療上の必要性を評価するとともに、公知申請(※)への該当性や承認申請のために追加で必要な試験の妥当性を確認することなどにより、製薬企業による未承認薬・適応外薬の開発促進に資することを目的としています。2013年5月末現在で、本検討会から製薬企業に対して開発要請があった未承認薬・適応外薬274件のうち、133件は既に承認・販売されており、33件が承認申請済み、その他についても開発中です。
このように、未承認薬・適応外薬にかかわるさまざまな問題の早期解決に向けた取り組みを進めるなど、製薬産業は、社会的使命・社会貢献の一環として、新しいくすりの研究開発だけにとどまらず、患者さんの治療上、必要性の高いくすりを提供するための努力を続けています。
-
※公知申請:すでに承認されている医薬品の適応外の使用については、科学的根拠に基づいて医学薬学上公知であると認められている場合に、臨床試験の全部または一部を、改めて実施する必要はなく、効能または効果などの承認が可能となる制度。
図表・コラム
52|未承認薬への取り組み
-
※公知申請:すでに承認されている医薬品の適応外の使用については、科学的根拠に基づいて医学薬学上公知であると認められている場合に、臨床試験の全部または一部を、改めて実施する必要はなく、効能または効果などの承認が可能となる制度。

